第一三共日前与默沙东达成了一笔总额可能高达220亿美元(预付金额40亿美元)的全球协议大单,其内核是三项抗体药物偶联物(ADC)。
这项巨额协议涵盖了第一三共的抗 HER3 ADC patritumab deruxtecan(HER3-DXd/U3-1402)、抗 B7-H3 ADC ifinatamab deruxtecan(I-DXd/DS-7300)和 靶向CDH6 的ADC raludotatug deruxtecan(R-DXd/DS_6000)。这些产品将在日本之外的全球范围内联合开发和商业化,第一三共保留在日本的独家权利。
此笔交易为相对往年稍显平淡的生物制药领域内的合作起到了提振作用,同时也凸显了ADC药物模态的重要性。
一、从合作看细胞毒性负载
先来看受到关注的三款ADC。
Patritumab deruxtecan:针对 EGFR 突变、局部晚期或转移性非小细胞肺癌,计划在 2024 年 3 月底之前申请BLA。
Ifinatamab deruxtecan:正在进行 II 期研究,作为单一疗法针对既往治疗过的广泛期小细胞肺癌(SCLC)患者。
Raludotatug deruxtecan:正在进行晚期肾细胞癌和晚期卵巢癌的 I 期试验。
第一三共与默沙东的合作项目中的三款ADC,其有效负载均为Deruxtecan(DXd,图1)。Deruxtecan(分子式C52H56FN9O13)是一种小分子药物,属于拓扑异构酶I抑制剂。它的作用机制是通过抑制拓扑异构酶 I(Topoisomerase I)实现的。拓扑异构酶I负责解开和重新缠绕 DNA 双螺旋结构,以帮助 DNA 复制和转录。
换言之,Deruxtecan 的抑制作用有助于阻止 DNA 复制,从而阻止癌细胞的增殖。这是它在治疗一些癌症类型时的主要作用机制。Deruxtecan作为ADC的负载,主要用于治疗HER2阳性乳腺癌。也被研究用于其他类型的癌症治疗,包括胃癌和非小细胞肺癌等。
以Deruxtecan为代表的小分子药物,算得上ADC细胞毒性有效负载发展历史上承前启后的一代。它上接甲氨蝶呤(methotrexate)、长春碱(Vinblastine)和阿霉素(doxorubicin,多柔比星)等传统化疗药物作为细胞毒性负载。
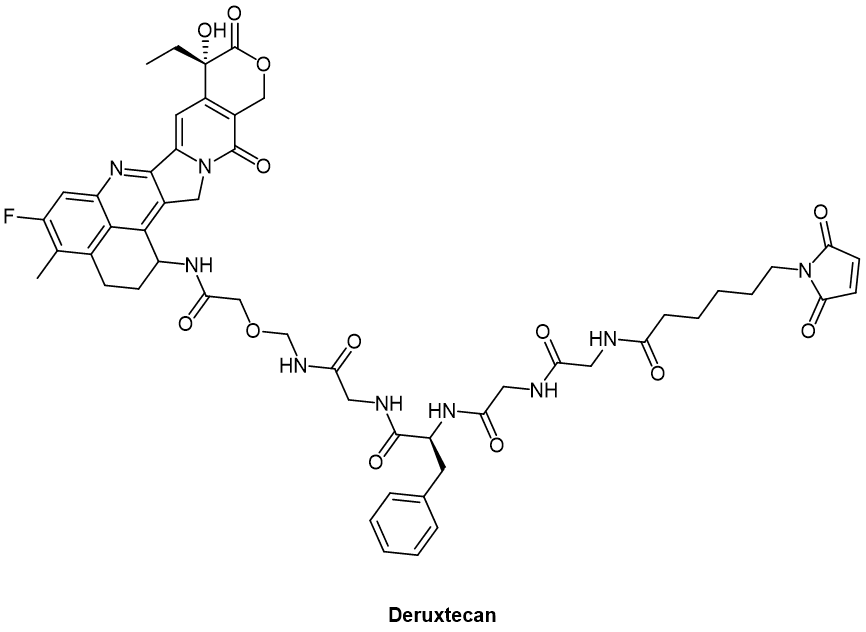
图1. Deruxtecan化学结构
由于严重的细胞毒性和非选择性,具有微管蛋白聚合抑制剂作用的第二代 ADC负载逐渐取代前辈而走上历史舞台。这个阵营,包括maytansinoids(美登素类,最初从长春花中提取)和 auristatins(奥瑞他汀类,最初从海洋藻类植物中提取)。它们都具有微管干扰作用,能够抑制癌细胞的微管聚合,从而阻止细胞的分裂和生长,最终导致癌细胞死亡。
然而,严重的副作用仍然是第二代ADC负载的阿喀琉斯之踵。除此之外,具有抗有丝分裂有效负载的 ADC 通常难以对抗生长较慢的癌症类型。
针对第二个问题,可靶向整个细胞周期的 DNA 损伤剂作为ADC负载的潜力受到了格外关注。这些类型的小分子药物包括烯二炔、拓扑异构酶 I 抑制剂、双卡霉素和吡咯苯并二氮杂卓(PBD)二聚体。它们可以有效地提供更广泛的肿瘤治疗选择。
尽管取得了进展,ADC 仍然需要在同时满足“足够的细胞毒性”和降低副作用的佯谬之间寻找精妙的平衡,同时还要兼顾抗药性的严峻挑战。
二、ADC作用新机制
随着人们对肿瘤的了解加深,新的靶标被不断发现。抑制导致肿瘤内的蛋白质,或者促使它们降解的方法也随之产生。对于有效负载的设计因此比以往要求更苛刻,避免影响周围组织,降低负载的毒性。
1. PROTAC负载
蛋白水解靶向嵌合分子(PROTAC)技术的突破为ADC的升级带来了新的思路。将有效负载与不同的作用机制相结合,为增强 ADC 的治疗活性并限制毒性提供了可能。PROTAC是双功能分子,可将E3连接酶与靶蛋白结合在一起,从而使后者泛素化并被蛋白酶体降解。PROTAC不是直接抑制其靶蛋白,而是触发其降解,因此具有多种潜在的临床优势,包括作用持久、具有催化活性以及高效的细胞毒性。
受到PROTAC的启发,降解剂-抗体偶联物(DAC,Degrader-antibody conjugates)形成了ADC领域中的新概念。在DAC设计中,PROTAC可以被mAb运输进入细胞,从而克服其有限的细胞渗透性。例如,BRD4(Bromodomain-containing protein 4)/VHL 降解剂构建的PROTAC GNE-987,其与抗CLL1抗体偶联,可在小鼠异种移植物中产生有效的体内活性(图 2)。
最近还产生了其他BRD4降解剂-抗体偶联物,使用VHL或CRBN配体的研究。同样,雌激素受体 (ER)、转化生长因子β受体II(TGFbR2)和 BRM(Brahma蛋白)降解剂,通过与抗HER2、抗B7-H4或抗CD22抗体偶联,作为DAC有效负载也在研究之中(图 2)。
ORM-5029是新公开的DAC,通过帕妥珠单抗(pertuzumab)将 GSPT1降解剂(Smol006)递送至 HER2 表达细胞。该 DAC 比其他 GSPT1 降解剂具有更强的细胞毒性。
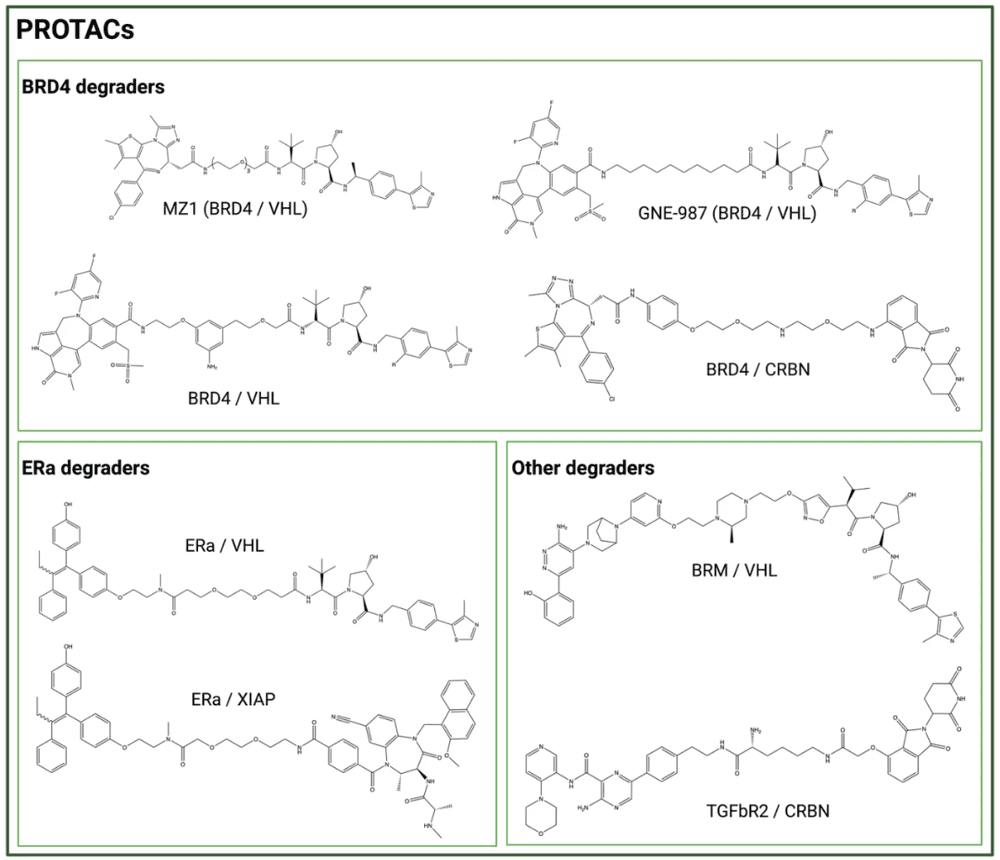
图2. PROTAC类型负载的降解剂的化学结构(图片来源:Journal of Hematology & Oncology)
2. HSP90抑制剂
HSP90 (heat-shock protein 90)是一种在肿瘤中经常过度表达的主要伴侣蛋白,几种来自格尔德霉素(GA,geldanamycin,图3)骨架的HSP90抑制剂已在临床环境中开发和测试。
与曲妥珠单抗治疗的小鼠相比,曲妥珠单抗-GA构成的ADC可以实现肿瘤小鼠总体存活率的提高。抗HER2 scFv和HSP90抑制剂结合域 (HER2 scFv-HBD) 组成的融合蛋白也在ADC得到了应用,当这个融合蛋白负载了GA衍生物构建ADC,对HER2阳性癌症的抗癌功效得到了提升。
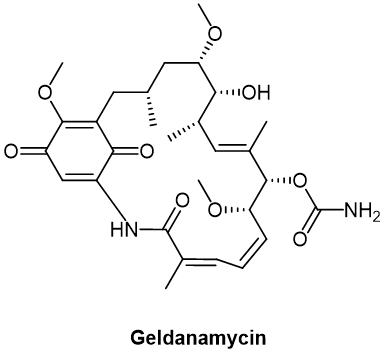
图3. Geldanamycin化学结构
3. 翻译抑制剂
由于翻译抑制剂会对健康组织产生影响,因此开发翻译抑制剂始终具有高度的挑战性,但omacetaxine于2012年获得FDA批准,用于治疗成年慢性粒细胞白血病患者,作为第一种上市的翻译抑制剂,为该领域的突破做出了表率。
其他蛋白质翻译抑制剂药物,例如psymberin,已经被用作ADC有效负载。Psymberin(图4),亦称irciniastatin A,是从海绵中分离出来的天然碳水化合物。它通过 β-葡萄糖苷酸连接体与抗CD30和抗CD70抗体结合,在体外表现出选择性和抗增殖活性,IC50在亚纳摩尔范围内,可靶向CD-30阳性和CD-70阳性恶性肿瘤。
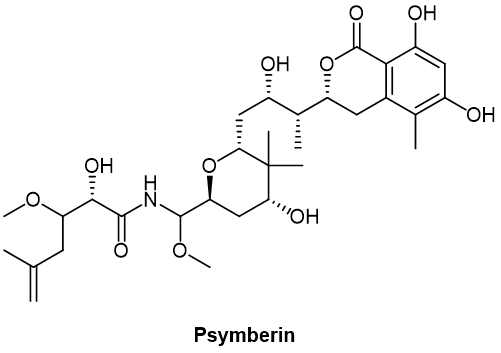
图4. Psymberin化学结构
4. 蛋白酶体抑制剂
自2003年硼替佐米(Bortezomib)获得批准以来,副作用降低的新型蛋白酶体抑制剂逐渐成为了新的抗肿瘤药物的研究重点之一。
环氧酮衍生物,例如强烈抑制20S蛋白酶体的Carmaphycin B类似物(图5),已经成功地与曲妥珠单抗结合组成ADC。尽管前景广阔,但不如其他ADC有效,这凸显了效力与安全性之间的微妙平衡。
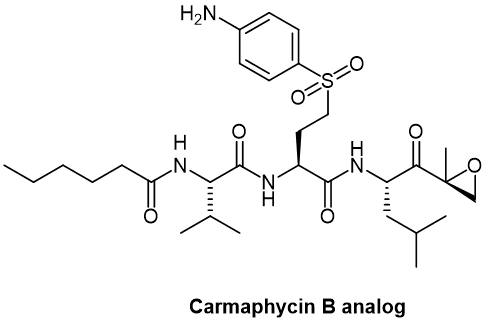
图5. Carmaphycin B 类似物化学结构
5. 双细胞毒性负载ADC
双细胞毒性负载ADC(Dual cytotoxic payload ADCs)也是新涌现出来的技术。
不同于传统ADC只装载一个细胞毒性负载,双细胞毒性负载ADC结合了两种不同的毒素。这两种毒素通常具有不同的作用机制,例如一种可以影响细胞的DNA合成,而另一种可以破坏细胞的微管结构。这种组合增加了杀伤效应,使癌细胞更难逃脱毒素的作用,提高抗癌治疗的效力,特别是对那些已经对单一毒素产生耐药性的癌症类型,解决肿瘤固有的异质性(肿瘤由不同基因表达谱的多个细胞组成)问题。
通过增强的靶向性,ADC可以减少对正常组织的毒性影响,改善治疗的安全性。通过同时影响不同的细胞生存途径,这种ADC可以减少癌细胞对特定药物的耐药性的风险。
除此之外,如果在一个ADC分子上载有免疫调剂和细胞毒性的两类负载,还可以放大细胞毒性负载的治疗效果,利用免疫系统的力量来靶向肿瘤细胞。这种思路已经成为ADC新的发展方向。
例如,剑桥研究人员利用他们的 Synthemer 平台设计了一种双负载 ADC,它结合了 auristatin F 羟丙基酰胺(AF-HPA)和 DNA 单烷基化剂(I-BiP),表现出很强的细胞毒性,并且可以发挥两种作用机制。
6. 免疫调节剂(Immune modulators)负载
通常意义上的ADC负载,大多是指那些具有直接的癌细胞杀伤作用的细胞毒性剂。但“非常规”的负载可能引发免疫原性细胞死亡 (ICD,immunogenic cell death)。使用这些试剂时,ICD过程会导致DMAP(damage-associated molecular patterns,损伤相关的分子模式。指机体自身细胞死亡所释放的内源性分子,即内源性危险信号,来源于受损或坏死组织激活的免疫细胞)分子被释放到周围环境之中。
这些DAMPs是一种信号分子,它们通常与细胞损害相关联。当它们被释放到细胞外时,它们可以激活免疫系统,引发免疫反应。则“借刀杀癌”,通过激活免疫细胞,实现更复杂的靶向策略,而且有可能产生保护性免疫记忆反应,减少未来肿瘤细胞的重新生长或转移。
这个肿瘤学领域正在迅速发展,多种新型免疫调节ADC药物正在处在不同阶段的研究中。包括Toll样受体 (TLR) 7或8激动剂(图6)和干扰素基因 (STING) 分子刺激剂等有效负载。精确靶向和强大调节的结合,有望开辟抗击癌症的新领域。
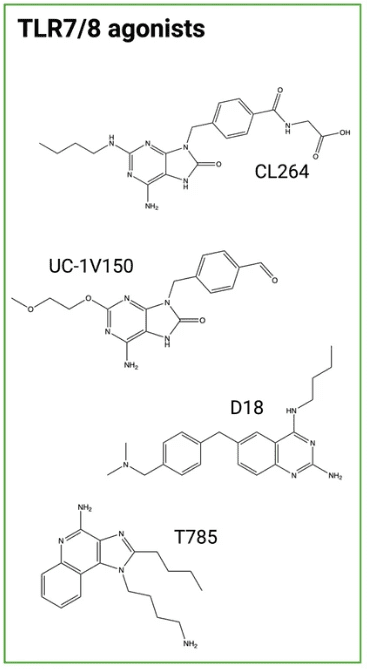
图6. TLR7/8激动剂分子结构(图片来源:Journal of Hematology & Oncology)
参考文献:
Takagi, L. Daiichi In Massive $22bn Global Deal With Merck & Co For Three ADCs. Scrip. 20. 10. 2023.
Camper, N. Antibody-drug conjugates payloads: then, now and next. Drug Target Review. 04. 10. 2023.
Conilh, L. et al. Payload diversification: a key step in the development of antibody–drug conjugates. Journal of Hematology & Oncology2023. 16, Article number: 3.
本文来自微信公众号:同写意Biotech(ID:TXYBiotech),作者:杨翼

