本文来自微信公众号:同写意 (ID:tongxieyi),作者:写意君,原文标题:《Lecanemab完全获批,解救困在AD里的做药人》,题图来自:视觉中国
阿尔茨海默病(AD)药物研发,是一个充斥着模糊、破碎与不确定的试验场。
我们清楚地知道人类无法逃避衰老与失去,却依然想要去延长这场漫长的告别。但AD的发病机制仍模糊不清,前仆后继的在研药物屡屡碰壁。
7月6日,拿到完全批准的Lecanemab无疑是穿透迷雾的一束光,对“这条路能不能走通”给出了一个肯定的答案。在几十年令人沮丧的试错之路上,它是人类历史上抗击AD的道路上里程碑节点。在几位业内人士的反馈中,我们看到,Lecanemab的数据可能不算完美,但足够激动人心。
“20年来首款”“与会专家6:0认可完全批准”“CDR-SB评分的变化降低27%”“脑肿胀降低至13%,出血降低至14% ”……我们常用这些数字来让Lecanemab更具象化。但当成功与失败浓缩成冰冷的数字,人们在创造历史过程中的喜悦、激动、苦恼和不甘往往会被淹没,这究竟是一款怎样的药物?AD赛道正在发生着怎样的变化?仅有这些数字还不足以解答。
我们能从Lecanemab的历程中触碰到这种真实的生命力和偶然性,也能感知到每位科研人,乃至整个赛道的顽强不息,以及决心做出一款AD药物的共同愿望。
Lecanemab在接力中一路走到今天。大约30年前,Lars Lannfelt驱车前往地球尽头的北极社区,在那里,他首次在AD患者身上发现产生β淀粉样蛋白的基因突变。20年前,Lannfelt和同伴创立BioArctic,开始与同样决心开发AD药物的卫材接触,并不断加深、扩大合作。11年前,Gunilla Osswald和几位专家离开即将撤出CNS领域的阿斯利康,加入仅有20人的BioArctic,助力AD药物开发。9年前,卫材的合作伙伴渤健也加入Lecanemab项目的研发和商业化进程中。
Lecanemab讲述的是一个众人拾柴的故事,而它的火焰又能成为其他同行者的柴,让无数仍困在AD药物研发里的制药人看到前路有光,再燃前进动力。
四十年,穿行在迷雾中
卫材,日本五大制药巨头之一,对初代AD药物多奈哌齐的研发可回溯至1983年。
当时卫材研究组原本计划开发他克林的衍生物,却发现它们均有跟他克林类似的毒性。于是,该团队转向对公司内部研制的化合物进行随机筛选,发现研发抗动脉硬化新药时合成的化合物对乙酰胆碱酯酶有一定的抑制活性,卫材在后续一系列结构修饰与片段优化后,多奈哌齐诞生了。
初始方向正确,过程相对顺利,多奈哌齐在1996年底成功上市。深谙美国市场“接力做药”的通则,卫材找到辉瑞一起推进多奈哌齐在美国市场的商业化,这款药物很快就成为爆品,卫材也进入世界制药企业销售额排名前20榜单。
然而,短暂的辉煌之后,卫材和一众专研AD药物的团队一样,陷入泥沼。
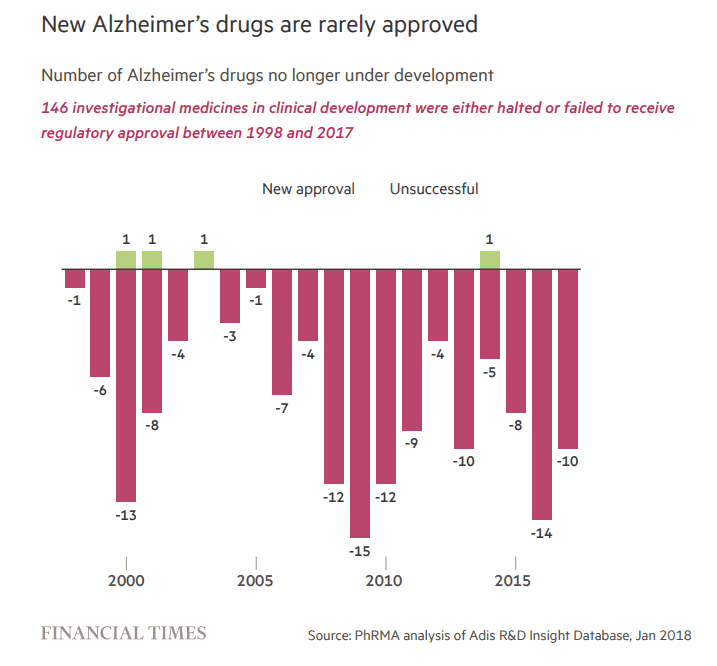
图1 1998-2017年阿尔兹海默药物获批与失败数量对比(绿色为获批、深红色为失败)
根据美国药物生产与研发协会发布的研究报告,2000年到2017年,药企针对AD累计投入的研发费用已超过6000亿美元,但这一时期内仅有4款AD药物获得批准。虽然这与FDA收紧Me-too药物的审评尺度不无关系,但那些获批上市的药物,都只能延缓症状发生,疗效有限。
AD作为当今最难攻克的疾病之一,在胆碱酯酶抑制剂和美金刚之后,很长一段时间都再无全新机制的创新药被成功研发出来。即便是已深耕AD领域数十年的卫材,也鲜有收获。
这些年,有不少MNC因AD药物的失败而宣布减少投资甚至是退出CNS领域。2017年,默沙东verubecestat的III期临床宣告失败,该公司在AD药物竞争中逐渐退场;同年,GSK关闭了以AD、帕金森和各类疼痛疾病为主要研究领域的中国研发中心。就连最初在多奈哌齐上吃到甜头的辉瑞,都于2018年宣布结束所有AD和帕金森等CNS在研项目;2019年,安进退出CNS领域。去年年底,罗氏宣布AD候选药物gantenerumab的III期临床再次以失败告终。
卫材与渤健推出的Aducanumab曾给业界带来希望,在2021年6月获得FDA加速批准,初期资本市场预估该药物将达到百亿销售额,成为“重磅炸弹”。事实上,由于美国医保拒绝覆盖、医生对这种药物有效性抱有严重怀疑,Aducanumab几乎从未得到市场的支持。这样难以预测的失败使AD药物研发又蒙上一层阴影。
今天,幸运的是,在不确定中寻找确定,有人真的找到了。
解救困在AD里的做药人
“跟挽救患者相比,Lecanemab解救了一众CNS做药人,这个层面的意义同样重大”。深耕CNS领域的周显波博士在听到这一消息时,如释重负,喜悦溢于言表。
与Aducanumab相比,Lecanemab显著降低了脑肿胀的发生率——在研究期间,接受Lecanemab治疗的患者中仅有13%出现脑肿胀。同时,Lecanemab已被证明可以减少斑块的积累,并将早期阿尔茨海默氏症患者的认知能力下降速度减慢了27%。
27%并不是一个惊人的数字,且仅仅是认知下降的减缓,而非提高。和现在被称为金标准的多奈哌齐、美金刚等药物相比,不算出彩,很多人因此认为Lecanemab的临床价值不大。但对于AD赛道来说,抗体药物的主要贡献在减缓疾病的进程,一点微小的进步都足以振奋人心。
更重要的是,现在Lecanemab完全获批让一众后继者看到,这条路是走得通的。“我们终于不是在完全的黑暗中摸索了。”一位CNS领域的教授说。
无论是争议不断的底层理论Aβ学说,还是关于副作用的安全性难题,抑或FDA态度上的转变,对AD药物赛道都可谓是一个极大的利好。在绝症药物上,比如AD、渐冻症、肿瘤等,市场明显察觉FDA近年的松口,有些药物凭借生物标志物等间接终点结果也能获批上市。
“我们可以看到,在Lecanemab这款药物的推进中不断有MNC来接下接力棒。虽然AD发病机制还有很大模糊的成分,但是在努力的不止有我们,产业里上下游包括理论、诊断、批准、商业化等都综合起来解决问题。”周显波博士表示,这是一件令人振奋的事,以整体性的理解来推进AD药物开发,没有人在孤军奋战。
当然,在此之前,大到MNC,小到每一位做药人,都曾敏锐地嗅到一丝机会。
2020年开始,几家MNC高调回归CNS领域,多项重磅交易直指AD药物开发。GSK与Alector达成合作,开发针对神经退行性疾病的两款抗体AL001和AL101;默沙东与Cerevance达成11亿美元的合作,利用Cerevance的NETSseq 技术平台筛选新的AD药物靶点;艾伯维以10亿美元收购了主推AD药物管线SDI-118的Syndesi Therapeutics;BMS与Prothena达成研发合作,获得了Prothena在研Tau蛋白抗体疗法PRX005的美国开发权益。
一些做药人瞄准了即将来临的“黄金时代”,准备好要大展拳脚。今年初,周显波博士离开了中泽医药,转而成立了阿斯诺来,他已经感知到“AD药物研发风口就要来了”。
再给AD药物一些时间
Lecanemab最终的临床获益情况还需要更多时间来验证,但在商业化上是否会重蹈Aducanumab的覆辙?市场会不会买单,这是许多投资人仍在摇摆的主要原因之一。
Lecanemab在1月获得加速批准后,实际上已经打开了通往美国市场的大门,但很少有老年人能够负担得起这一昂贵的治疗(每年定价为2.65万美元),那时美国联邦医疗保险(Medicare)对该药物的覆盖范围仅仅限制在参与临床试验的人上。
此前,STAT的一篇报道表示,Medicare称尽管受到来自国会和倡导者的压力,Medicare也不会很快改变其对AD药物的覆盖计划。但是,情况随着Lecanemab获得完全批准而转变,据华尔街见闻披露,Medicare已承诺在FDA批准这一药物的同一天开始承保Lecanemab,只是会附加一些条件。高盛估计,Lecanemab的销售峰值或可达到157亿美元。
商业化之路虽还不能完全看清,可从Lecanemab的优势与不足中,业界对于AD药物的开发已经进一步摸索出方向。
Lecanemab提供了一个很好的基础,“在这个基础上的联合用药很值得一试,比如Lecanemab和免疫药物的联用,以及和可塑性神经元结合实现的创造性疗法,都是国际AD新药研发领域的风口”,周显波分享说,毒副作用如果也能在临床上得到解决,药物前景会更好。
在中国,已上市的AD原研药物仅有绿谷制药的甘露特钠。当我们谈到“中国AD药物开发的种子选手”时,周显波表示,虽然要判断竞争格局还为时尚早,但中国AD药物开发无疑已经进入了百花齐放、百家争鸣的“黄金时代”。“阿斯诺来引进了AD领域全球唯一的口服通过迷走神经脑肠轴起效的多肽药物,卓凯的基于AD遗忘机制的全球首个Rac1靶向药已经进入临床,恒瑞的自主研发的抗Aβ单克隆抗体SHR-1707也已经进入了临床I期,还有一些团队在做目前AD临床一线药物衍生物。”
同时,中国是世界上老年人口最多的国家,据估算,到2040年,中国AD患者人数将超过2200万人。无论从患者人数还是临床医生资源来看,中国在精准神经学、AD早筛领域都具备绝对的资源优势。
另一方面,我们也能看到来自CDE的一些好消息。比如,今年初,CDE将礼来的AD抗体新药Donanemab注射液纳入了“拟突破性治疗品种”。
中国还需要2~3年时间,AD药物的竞争格局就会相对明朗。在这一过程中,像Lecanemab的故事一样,产业上下游的合力起到至关重要的作用。这场关于AD药物开发的接力,仍在继续。
参考资料
1.多奈哌齐-阿尔茨海默症(AD)治疗药物 ;DTDM-药三角0215
2.跨国药企回归CNS的“姿势” | 行业观察;研发客
本文来自微信公众号:同写意 (ID:tongxieyi),作者:写意君

