本文来自微信公众号:同写意Biotech(ID:TXYBiotech),作者:十七,原文标题:《HER3三十余载的沉与浮》,题图来自:《我不是药神》
HER3与明星靶点EGFR、HER2同属HER家族,由于结合力低、内在激酶活性极低等问题迟迟无法成药,目前尚无靶向药获批上市。
HER3研究已有三十余载,很多单抗因没有达到临床疗效或安全性问题而被终止研究如Patritumab、KTN3379、Elgemtumab和Lumretuzumab等,除了单抗外,也有一些双抗临床开发失败,如靶向EGFR和HER3的双抗Duligotuzumab等。
随着人们对HER3的作用机制越来越了解,加上ADC、双抗技术的发展逐渐成熟,研发人员对于HER3靶向药物的开发热情又被唤醒起来。
一、HER3与肿瘤关系
人表皮生长因子受体(HER)蛋白是受体酪氨酸激酶家族,在正常细胞和肿瘤细胞生物学中均发挥作用。该家族由四个高度同源的成员表皮生长因子受体EGFR(ERBB1/HER1)、HER2(ERBB2)、HER3(ERBB3)和HER4(ERBB4)组成,包含配体结合胞外结构域、跨膜结构域、胞内激酶结构域和C末端尾部四个部分。
虽然与其他家族成员相比,HER3单独过表达时不具有致癌作用,但是,当HER3与神经调节蛋白(NRG)配体结合后,便会与其他受体酪氨酸激酶形成异源二聚体。当配体结合后,HER3优先与EGFR或HER2二聚,诱导受体对的构象变化。构象变化导致细胞内激酶尾部的转磷酸化事件,其中HER3的C端尾部作为多重磷酸化的受体。这诱导信号级联的激活,促进细胞存活和增殖(图1)[1]。
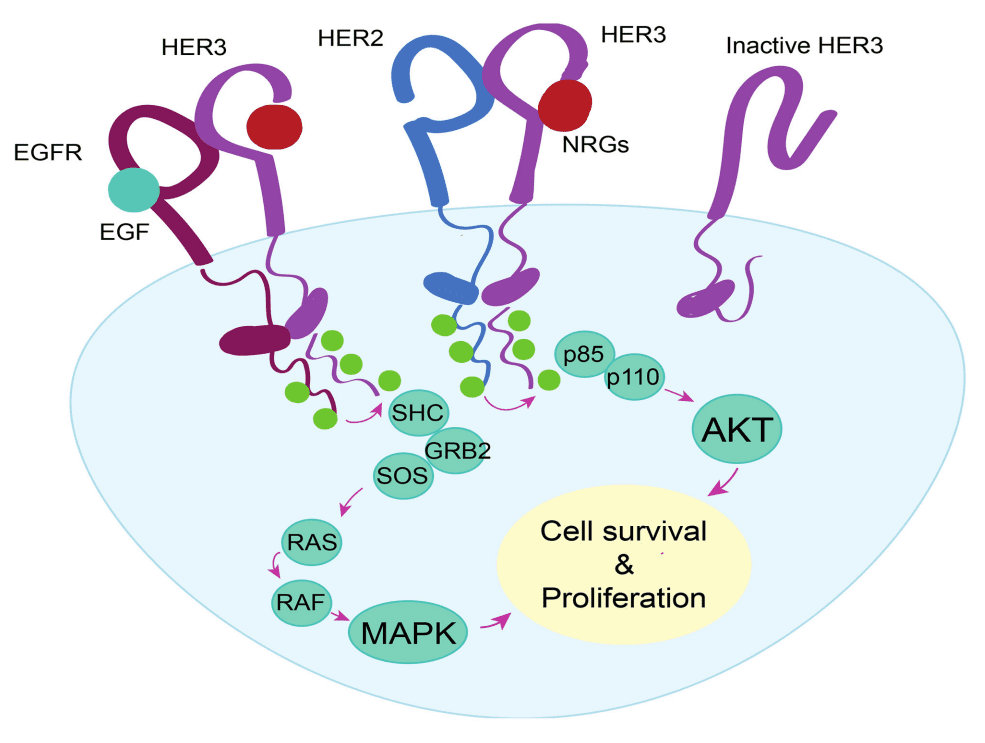
图1. HER3二聚合信号通路
HER3在癌症生物学中的作用是多方面的。在不同实体瘤中检测到普遍存在的HER3表达(图2),已证实在疾病中起作用。对多种实体瘤类型的两项系统分析表明,HER3表达与更差的总生存期相关,与HER3阴性患者相比,死亡风险高1.60倍[2]。
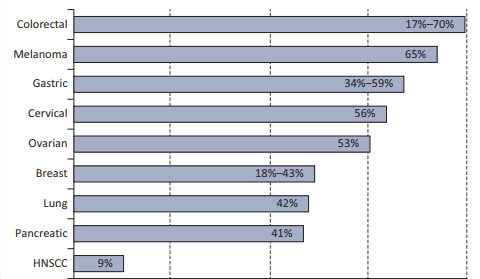
图2. 不同肿瘤类型的HER3过表达率
大约30%的NSCLC患者具有EGFR基因激活突变,最常见的(85%)包括外显子19缺失(ex19del)和外显子21中的单氨基酸取代L858R。这些突变使肿瘤对EGFR定向酪氨酸激酶抑制剂(TKI)具有敏感性,奥希替尼是目前EGFRm NSCLC一线治疗的标准治疗标准,对FLURA试验中未治疗的EGFRm NSCLC有效(与第一代EGFR TKI相比);中位无进展生存期(PFS)为18.9个月 vs 10.2个月(HR,0.46;p < 0.001),中位总生存期(OS)为38.6个月 vs 31.8个月(HR,0.80;p = 0.046)[3]。
然而,许多患者在奥希替尼治疗后会出现疾病进展,并且与一线或二线治疗后进展相关的耐药机制是异质性的,目前尚无批准在奥希替尼耐药后的靶向治疗。一线奥希替尼治疗进展后,患者通常接受铂类化疗作为标准治疗;但是,响应通常不持久,EGFR TKI 后接受铂类化疗的患者的中位PFS约为5个月。
在83%的原发性NSCLC肿瘤中观察到HER3表达,包括EGFR突变的肿瘤。患者肿瘤样本中mRNA表达的分析表明,与野生型EGFR肿瘤相比,EGFRm NSCLC肿瘤的HER3 mRNA水平升高。在NSCLC中,HER3表达与晚期疾病、转移时间缩短和生存率降低有关。HER3的高表达也与EGFR TKIs耐药有关。EGFRm NSCLC的临床前研究表明,EGFR TKI抗性的异种移植小鼠模型中相对HER3膜蛋白表达增加。所以人们寄希望于HER3靶向药能解决奥希替尼耐药问题。
二、靶向HER3治疗药物的沉
从发现三十多年以来,由于激酶活性较弱,长期以来HER3作为治疗靶点的研究并不充分, 尚未有靶向HER3的药物获批上市。
既往的HER3单克隆抗体和酪氨酸激酶抑制剂(TKI)的研发均以失败告终, 很多单抗因没有达到临床疗效而终止研究如Patritumab、KTN3379和Elgemtumab等,也有很多因为安全性问题而终止研究如Lumretuzumab的一项Ⅰb期研究纳入35例HER3阳性/HER2低表达乳腺癌患者,在帕妥珠单抗和紫杉醇的基础上加入Lumretuzumab,增加了腹泻发生率,而且治疗窗口狭小限制了进一步的临床应用,已经停止开发(图3)。
除了单抗外,也有一些双抗临床开发失败,如靶向EGFR和HER3的双抗Duligotuzumab(MEDH7945A)。尽管duligotuzumab在头颈癌的2b期研究中显示出可接受的安全性,并与顺铂/ 5-氟尿嘧啶联合使用显示出了一定的临床活性,但在转移性结直肠癌中,duligotuzumab联合FOLFIRI与西妥昔单抗联合FOLFIRI相比,并不能改善RAS exon 2/3野生型转移性结直肠癌患者的预后(图3)。
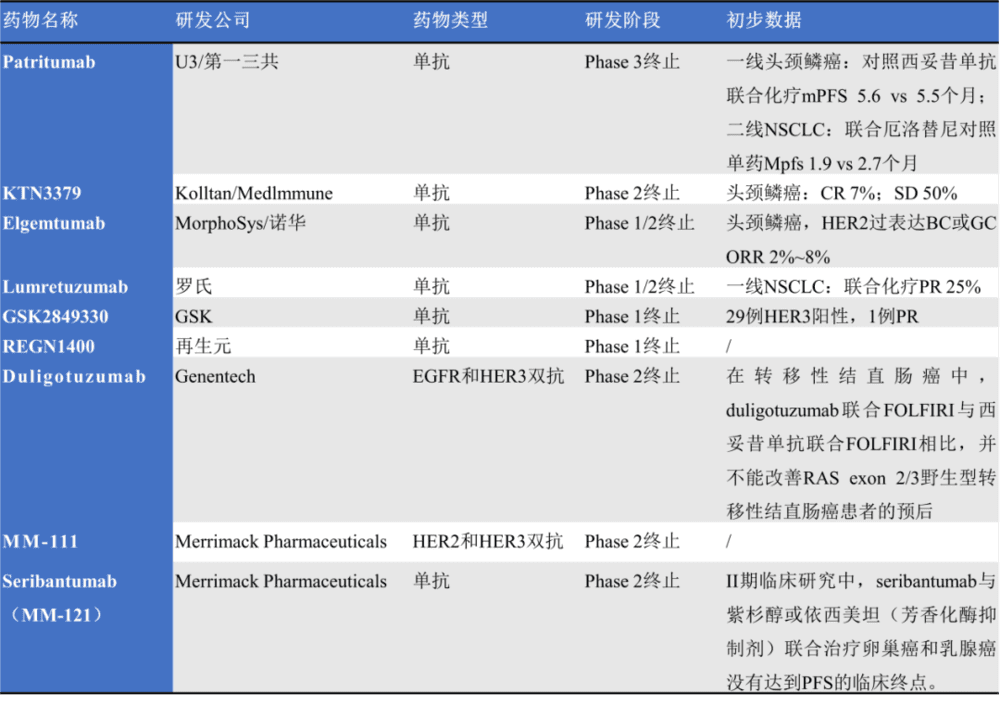
图3. 临床(或部分临床)开发终止的药物
三、靶向HER3治疗药物的浮
HER3药物的研发也由此进入了一段冷静期。随着研发人员对HER3的作用机制洞察更加深刻,叠加ADC、双抗技术的发展逐渐成熟,HER3的药物研发又迎来了第二春(图4)。
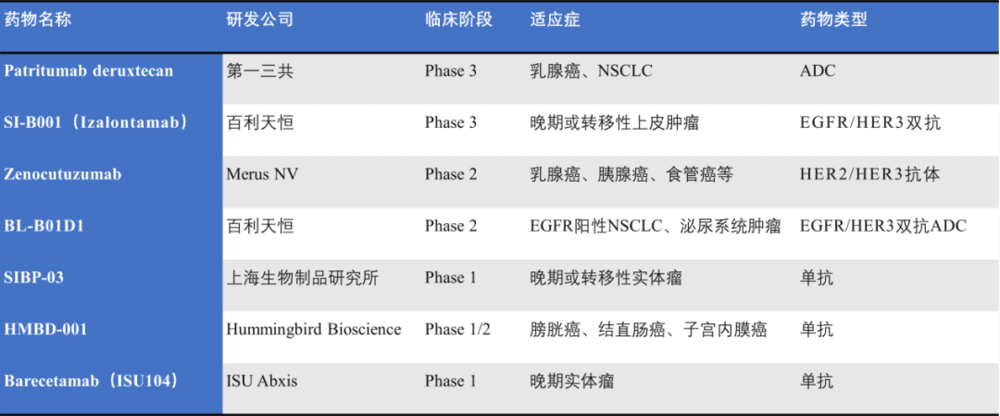
图4. 临床在研的靶向HER3药物
四、代表性药物
1. Patritumab deruxtecan
Patritumab deruxtecan(HER3-DXd,U3-1402)是由第一三共开发的一款HER3-ADC药物,是全球首款靶向HER3的新一代ADC药物。其抗体部分为patritumab(U3-1287),是一种针对HER3胞外结构域的单克隆抗体,其可以有效的阻止HER2/HER3异源二聚体形成。
HER3-DXd和DS-8201的载荷相同,都是deruxtecan(一种拓扑异构酶I抑制剂)并通过马来酰亚胺-GGFG接头连接到抗体上,连接方式为半胱氨酸定点偶联,DAR值为8。Linker在血液循环中具有较高的稳定性,在肿瘤的溶酶体中被切割并释放能够透过细胞膜的DXd(具有旁观者效应)(图5)。
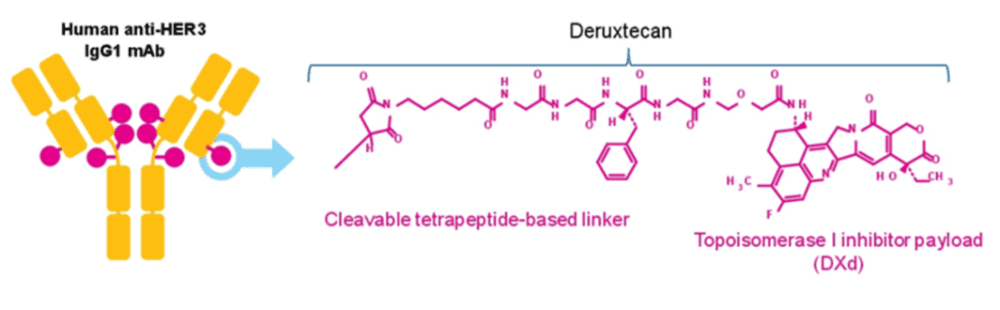
图5. HER3-DXd的结构
HER3-DXd已在多种鼠癌模型中显示出抗肿瘤活性,包括患者来源的EGFRm NSCLC异种移植模型。基于这些发现,U31402-A-U102是一项I期开放标签,剂量递增和剂量扩展研究,评估了HER3-DXd在NSCLC患者中每3周(Q3W)静脉注射(IV)的有效性和安全性。
在U31402-A-U102研究中,HER3-DXd在对一系列已知和未知的EGFR TKI耐药的EGFRm NSCLC患者中表现出持久的抗肿瘤活性。在U31402-A-U102中,稳健的剂量选择过程导致先前接受治疗的EGFRm NSCLC患者的推荐剂量为HER3-DXd 5.6mg / kg[3]。
研究结果发现,在经过重度预治疗的患者群体中(从接受HER3-DXd 5.6 mg/kg静脉注射和剂量扩展队列1的剂量递增队列中合并的患者;N = 57),客观缓解率为39%(1例完全缓解和21例部分缓解),中位缓解持续时间为6.9个月,中位PFS为8.2个月(图6)[3]。
虽然患者人数有限,但ex19del患者的ORR(42% [14/33])高于L858R患者(25%[5/20])。在既往接受过奥希替尼和铂类化疗的亚组患者(n=44)中,ORR为39%(1例完全缓解和16例部分缓解),中位缓解持续时间为7.0个月,中位PFS为8.2个月(图6)[3]。
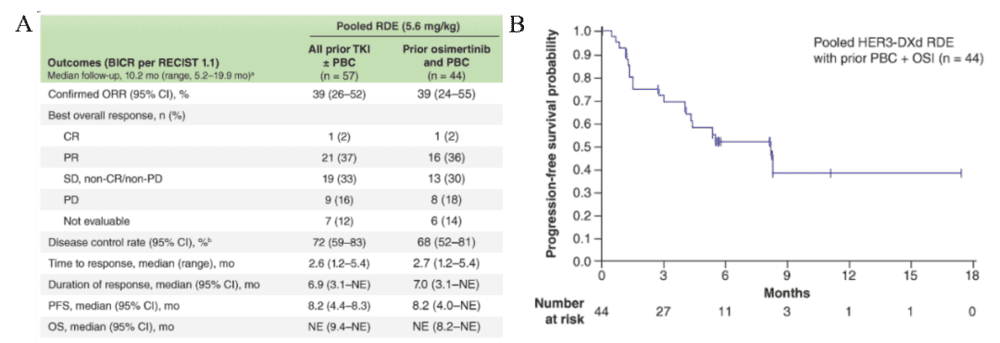
图6. HER3-DXd在U31402-A-U102研究中的临床结果
HERTHENA-Lung01是一项全球性、多中心、开放标签的II期试验,评估HER3-DXd在具有EGFR激活突变(外显子19缺失或L858R)的转移性或局部晚期NSCLC患者中的有效性和安全性,这些患者的疾病在奥希替尼,第三代EGFR TKI和≥1铂类化疗方案或之后耐药(图7)。该研究于2021年2月开始,预计研究完成日期为2024年7月。
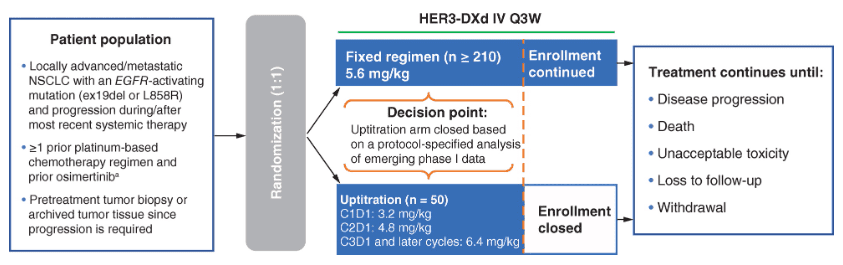
图7. HERTHENA-Lung01研究设计
今年ASCO大会的口头报告中,第一三共进一步公布了HER3-Dxd治疗Her2阴性转移性乳腺癌(MBC)患者的II期研究的Part A结果。研究的主要终点是ORR和6个月无进展生存(PFS)率(图8)[4,5]。
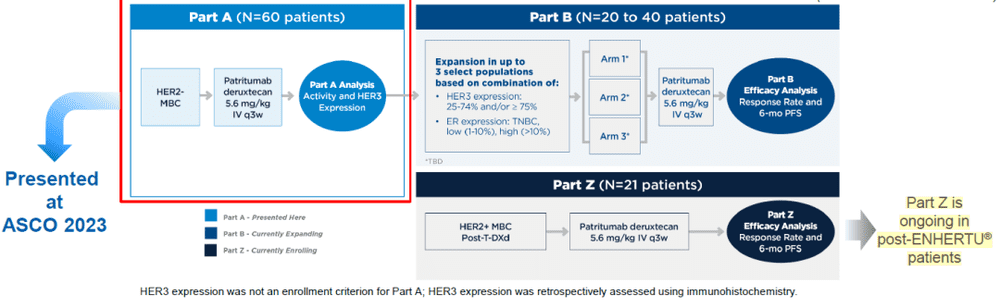
图8. HER3-Dxd治疗Her2阴性MBC患者方案
研究结果显示,整体人群的总缓解率(ORR)为35%,临床获益率(CBR)为48%,中位DOR为10.0个月,6个月PFS率为60%(图9)。
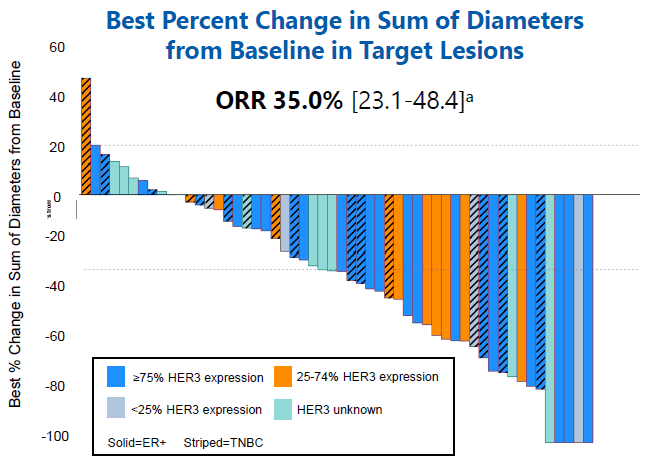
图9. Part A的临床结果
此外,针对不同类型患者亚组的分析结果显示,在HER3表达≥75%、25%-74%亚组中,ORR分别为33%和46%(图10)。
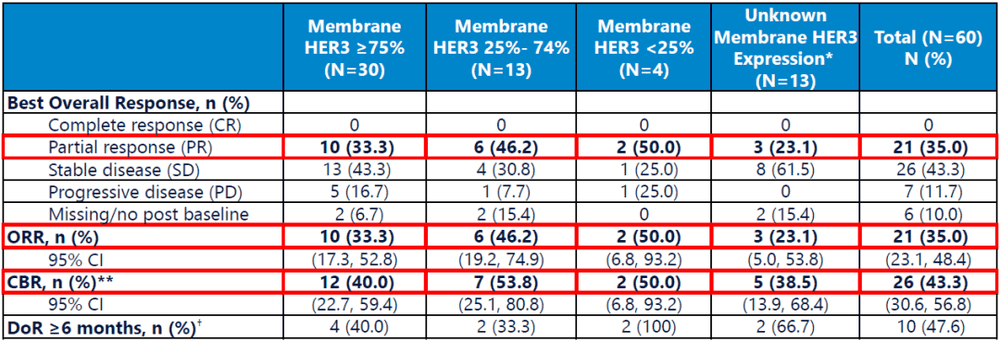
图10. 不同类型患者亚组的分析结果
在5.6mg/kg时观察到可控的安全性,最常见的不良事件是恶心、疲劳和腹泻。大多数不良事件为1级和2级。在超过7%的患者中没有发生单个3/4级不良事件,判定治疗相关ILD的发生率较低(1.7%,1 级)(图11)。
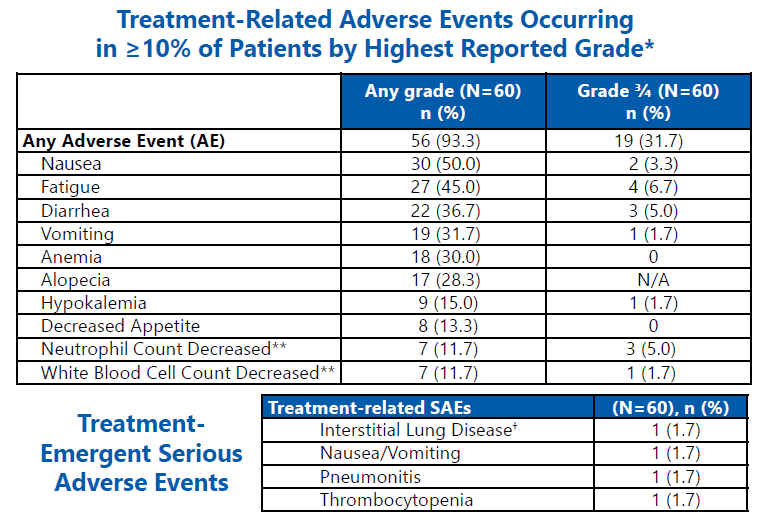
图11. Part A试验的安全性
总之在经过大量预处理的雌激素受体(ER)阳性和三阴性转移性乳腺癌患者中,HER3-DXd的疗效不受HER3表达水平的影响,即使HER3低表达患者也有相当不错的疗效。若HER3-Dxd能够顺利完成III期研究并上市,乳腺癌治疗范式会将再次革新。
2. SI-B001
SI-B001(Izalontamab)是目前全球唯一一款进入临床的EGFR/HER3双特异性抗体(图12)。
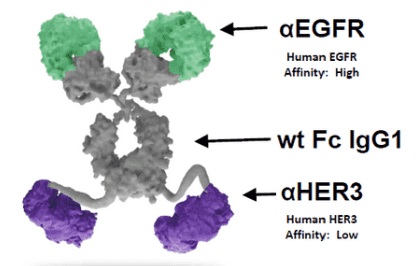
图12. SI-B001结构
今年ASCO会议上,百利天恒公布了SI-B001联合/不联合化疗治疗复发性和转移性头颈部鳞状细胞癌(HNSCC)患者的两项II期研究结果(NCT05044897和NCT05054439)以及SI-B001加化疗用于局部晚期或转移性EGFR / ALK野生型非小细胞肺癌患者的II期,多中心,开放标签研究(NCT05020457)。
NCT05044897和NCT05054439两项临床试验,介绍了SI-B001在复发性和转移性HNSCC中的有效性和安全性结果。
S209包括既往抗PD-1/L1加铂类化疗(PBC)中复发和转移性HNSCC进展的患者。患者用SI-B001 16mg/kg IV QW处理。
S206包括具有复发性和转移性HNSCC的患者,在先前的抗PD-1 / L1联合或不伴PBC时耐药,并且接受的治疗不超过两线。S206组的患者分为两组:A组,既往未接触紫杉醇的患者用SI-B001(12mg/kg IV QW)加紫杉醇(80mg/m2 IV QW)治疗;B组,先前暴露于紫杉醇的患者用SI-B001(12mg / kg IV QW)加多西他赛(35mg / m2 IV D1D8D15 Q4W)处理。
截至2022年12月31日,S 209组11名患者获得了SI-B001治疗。患者先前的治疗中位数为4线。在S209组9个患者至少有1个基线后肿瘤评估,ORR(n/N)为22.2%(2/9),mPFS [95%CI]为2.7 [1.8-7.9]个月。
S206中有29名患者接受SI-B001加化疗,包括A组19名和B组10名患者。在22例患者中至少进行1次基线后肿瘤评估的,ORR为45.5%(10/22),mPFS为5.1 [3.7-5.6]个月。在A组中14名患者至少进行1次基线后肿瘤评估的,ORR为64.3%(9/14),mPFS为5.6 [5.1-6.3]个月。B组8名患者至少有1次基线后肿瘤评估,ORR为12.5%(1/8),mPFS为1.9 [1.2-3.7]个月(图13)[6]。
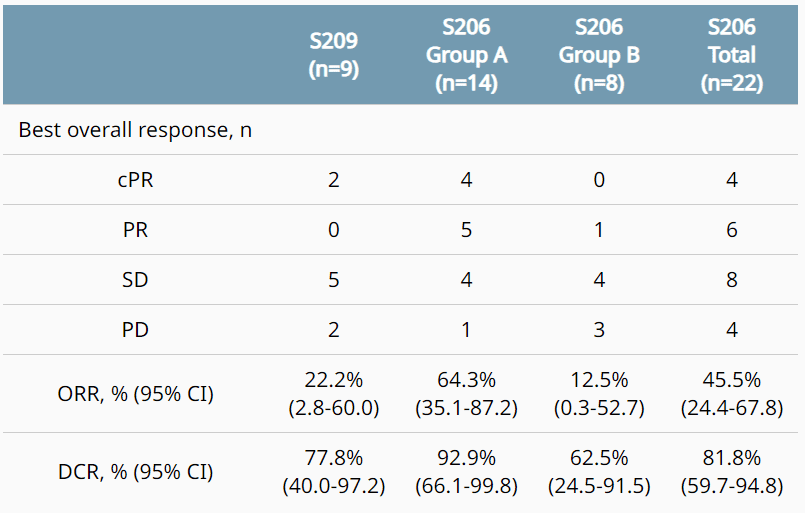
图13. NCT05044897和NCT05054439两项临床试验结果
NCT05020457研究由三个队列组成:在队列A中,患者在一线抗PD-1 / L1抗体单药治疗失败后接受SI-B001加PBC作为二线治疗;队列B:患者在一线抗PD-1/L1治疗加PBC失败后接受 SI-B001加多西他赛作为二线治疗;队列C:患者在一线抗PD-1/L1治疗和PBC失败后接受SI-B001加多西他赛作为三线或更高治疗。
结果:截至2022年11月11日,已有55名患者入组,其中1名患者入组A组,45名患者入组B组,8名患者入组C组,1名患者根据研究者的意愿入组。在23个可评估患者中,ORR为43.5%,DCR为69.6%(图14)[7]。
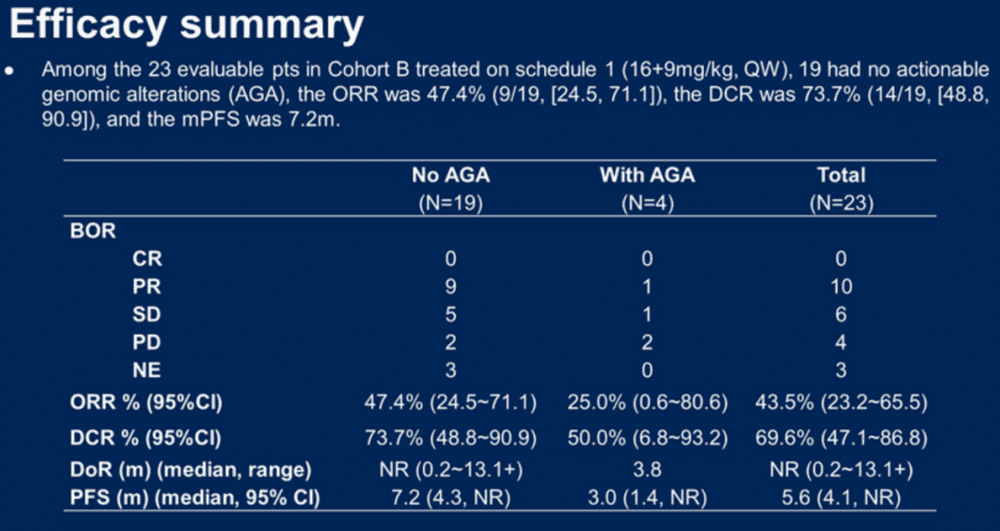
图14. NCT05020457临床试验结果
最常见的≥3级治疗相关不良事件(TRAEs)是骨髓抑制(17%),中性粒细胞计数降低(15%)和白细胞计数减少(12%)。没有与药物有关的死亡。
3. BL-B01D1
BL-B01D1是由百利公司研发的第一款在临床研究阶段的靶向EGFR×HER3的双抗ADC新药。它由EGFR×HER3双特异性抗体和新型DNA拓扑异构酶I抑制剂ED04(喜树碱类似物)通过可裂解连接子连接而成(图15)。EGFR和HER3在多个实体瘤中高表达,包括EGFR-TKI耐药后的NSCLC,使其成为具有较大开发潜力的靶点。
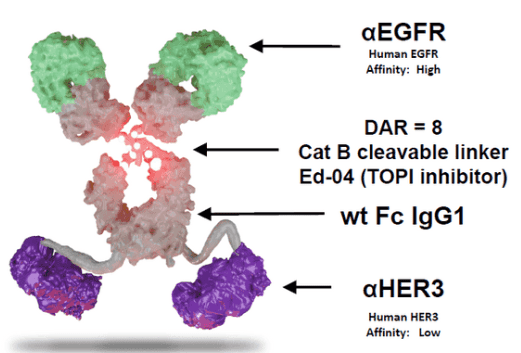
图15. BL-B01D1的结构
近期百利天恒公布了BL-B01D1在鼻咽癌中的Ib期临床试验结果。研究显示,所有有效剂量下,至少有1次疗效评估的鼻咽癌受试者共27例,中位经治线为3线,其ORR为58.8%,DCR为100%,mPFS尚未达到,除此之外,它在NSCLC患者中的两项I期试验也达到了理想结果(图16)。
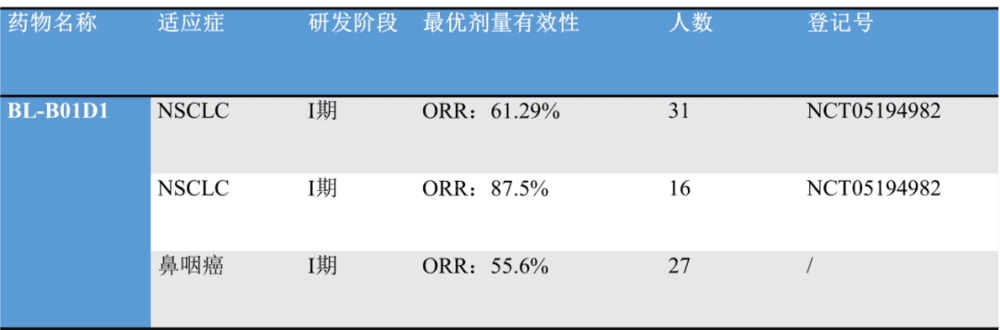
图16. BL-B01D1部分试验结果
近期,Zhang等人在ASCO会议上介绍了BL-B01D1的FIHI期研究的安全性/有效性结果(NCT05194982)。截至2022年12月31日,已入组150名pts并至少接种了一剂。最大耐受剂量(MTDs)被确定为3.0mg / kg D1D8 Q3W和6.0mg / kg D1 Q3W。剂量扩展(D-EXP)在2.5,3.0mg / kg D1D8 Q3W和4.5,5.0,6.0mg / kg D1 Q3W下进行[8]。
38例经治EGFR突变非小细胞肺癌患者,全部接受过靶向治疗,其中89%为3代EGFR-TKI,74%的患者接受过含铂化疗,这些经治的EGFR突变患者ORR高达63.2%,疾病控制率89.5%。
49例经治EGFR野生型非小细胞肺癌患者,全部接受过含铂化疗,90%接受过抗PD-1/L1免疫治疗和含铂化疗,这些经治的EGFR野生型患者的ORR也达44.9%,疾病控制率91.8%。
7例经治小细胞肺癌患者,ORR为14.3%,疾病控制率为85.7%(图17)。
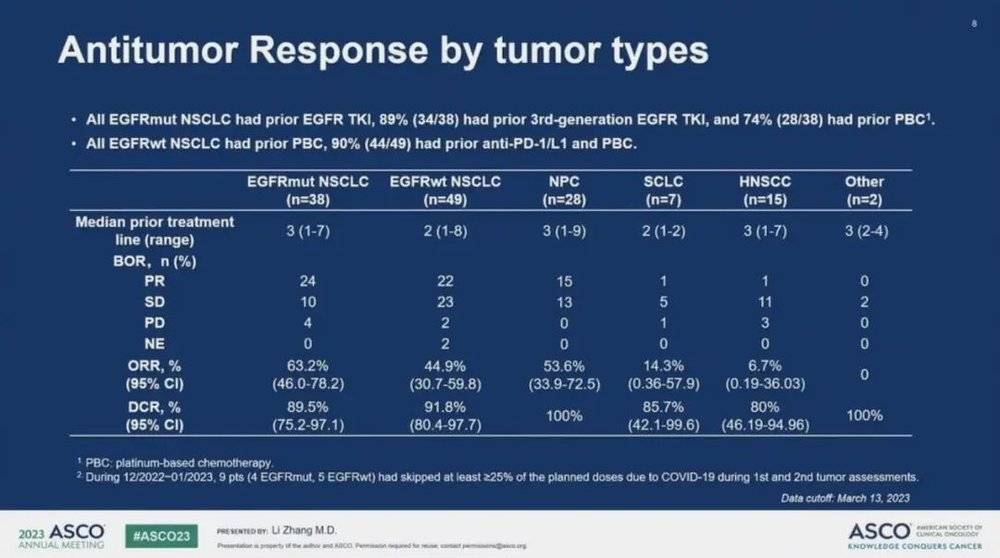
图17. NCT05194982临床试验结果
最常见的TRAEs(>10%,所有等级/≥G3)是白细胞减少(60%/30%),中性粒细胞减少(51%/34%),贫血(45%/15%),血小板减少症(44%/19%),脱发(30%/0%),恶心(29%/<1%),呕吐(28%/0%),虚弱(21%/<1%),食欲下降(22%/<1%),虚弱(21%/<1%),食欲低下(16%/0%),腹泻(15%/2%),口腔溃疡(15%/<1%),皮疹(13%/0%)。未观察到间质性肺病。
五、小结
HER3与明星靶点EGFR、HER2同属HER家族,当配体结合后,HER3优先与EGFR或HER2二聚,诱导受体对的构象变化,引发下游信号通路促进细胞增殖导致癌症。近期有研究发现靶向HER3药物可能解决奥希替尼耐药问题,尚无批准在奥希替尼后使用的靶向治疗。
HER3自发现的三十多年以来,因为结合力低、内在激酶活性极低等问题一直没有靶向药研发成功,很多单抗因没有达到临床疗效而终止研究如Patritumab、KTN3379和Elgemtumab等,也有很多因为安全性问题而终止研究如Lumretuzumab等。除了单抗外,也有一些双抗临床开发失败,如靶向EGFR和HER3的双抗Duligotuzumab(MEDH7945A)等。
HER3药物的研发也由此进入了一段冷静期。近些年来,随着研发人员对HER3的作用机制洞察更加深刻,叠加ADC、双抗技术的发展逐渐成熟,HER3的药物研发又迎来了第二春。
目前来看,HER3靶点最有希望成功的是ADC药物。相比于单抗,ADC的优势是通过诱导受体内吞和降解导致癌细胞死亡,不必完全依赖HER3诱导癌细胞死亡。第一三共的HER3-DXd是目前进展最快的靶向HER3的ADC药物,多项临床试验取得积极结果,未来能否成功上市还需看后面进一步的临床结果,毕竟很多药物折戟在临床3期。
除了ADC,百利天恒的双抗ADC产品BL-B01D1也取得了积极临床结果,但目前都是早期临床数据,未来进展如何还需考察。
参考文献:
1.Haikala, Heidi M, and Pasi A Jänne. “Thirty Years of HER3: From Basic Biology to Therapeutic Interventions.” Clinical cancer research : an official journal of the American Association for Cancer Research vol. 27,13 (2021): 3528-3539. doi:10.1158/1078-0432.CCR-20-4465
2.J. Uliano, C. Corvaja, G. Curigliano & P. Tarantino, Targeting HER3 for cancer treatment: a new horizon for an old target, ESMO Open. 2023 Feb;8(1):100790.
3.Helena A Yu, James Chih-Hsin Yang et.al, HERTHENA-Lung01: a phase II study of patritumab deruxtecan (HER3-DXd) in previously treated metastatic EGFR-mutated NSCLC, Future Oncol, 2023 May 22.
4.ASCO Highlights 2023, DAIICHI SANKYO CO., LTD.
5.ASCO 2023/ESMO BC 2023 Presentation Materials
6.Results from two phase II studies of SI-B001, an EGFR×HER3 bispecific antibody, with/without chemotherapy in patients (pts) with recurrent and metastatic head and neck squamous cell carcinoma (HNSCC).
7.SI-B001 plus chemotherapy in patients with locally advanced or metastatic EGFR/ALK wild-type non-small cell lung cancer: A phase II, multicenter, open-label study.
8.BL-B01D1, a first-in-class EGFRxHER3 bispecific antibody-drug conjugate (ADC), in patients with locally advanced or metastatic solid tumor: Results from a first-in-human phase 1 study.
本文来自微信公众号:同写意Biotech(ID:TXYBiotech),作者:十七

