本文来自微信公众号:同写意 (ID:tongxieyi),作者:写意君,原文标题:《Nature子刊:最高保护效力超90%,RSV疫苗迎来里程碑式批准》,题图来自:视觉中国
呼吸性合胞病毒(RSV)预防领域近60年来的潜心研究,终于在2023年获批,捷报频传。
具有高度传染性的RSV,主要引起6个月以下婴儿患细支气管炎和肺炎等下呼吸道感染,以及5岁以下儿童、体弱者和老年人中可能引发危及生命的下呼吸道疾病(LRTD)。全球范围内,RSV每年导致超过33.6万老年人住院和1.4万人死亡。
公开数据显示,RSV药物全球整体市场规模,预计将从2020年的18亿美元增长至2030年的128亿美元,年复合增长率达到21.4%。潜力巨大的市场容量,使众多MNC都渴望在这一领域站稳脚跟,包括GSK、辉瑞、赛诺菲、阿斯利康、Moderna等药企,皆有所布局。
如今,随着RSV疫苗的上市,这一市场的竞争愈发激烈。Nature Reviews Drug Discovery近期刊发了一篇文章,以讨论目前RSV药物的市场格局。
一、F蛋白打开RSV疫苗市场大门
作为一种带有包膜的RNA病毒,RSV的感染高发于冬季。光是在美国,每年65岁及以上的成年人中,就有6万~16万重症患者住院接受治疗。
自20世纪60年代以来,研究人员就开始研究RSV疫苗,但一直难以取得成功。情况在2013年开始转好,研究人员通过关注病毒融合(F)蛋白的结构,打开了研制有效RSV疫苗的大门。
F蛋白是一种表面蛋白,可以吸附在宿主细胞上,将病毒包膜与宿主细胞膜融合,从而传递致病载荷。F蛋白有两种构象——融合前(preF)和融合后(postF)状态。基于两种结构,免疫学家和病毒学家Barney Graham通过与NIH的Jason McLellan和Peter Kwong合作,还解开了preF的晶体结构,发现一种与预期截然不同的抗原——直到那时研究人员才清楚,在preF蛋白上有抗体着陆点,而在重组后的蛋白上却不存在。
此后,研究人员通过化学调整来稳定preF,例如在特定位点添加半胱氨酸桥,表明它也是一种可行的疫苗抗原。在恒河猴研究中,稳定的preF前诱导的中和抗体滴度比F蛋白疫苗高70-80倍。
锡耶纳生物技术中心基金会科学主任、GSK前首席科学家Rino Rappuoli表示,经过化学方法对特定点位的修饰,印证了经此研制RSV疫苗是可能的。这也为COVID-19来袭时,科学家们能迅速研制出相关的冠状病毒刺突蛋白抗原奠定了基础。
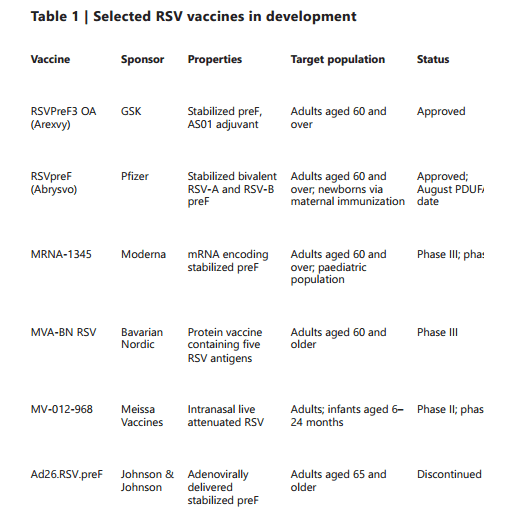
日前,FDA批准了两款基于蛋白质的RSV疫苗——GSK的Arexvy和辉瑞的Abrysvo。两款疫苗均获批用于60岁以上成年人,Rappuoli表示,二者都是出色的,将成为RSV疫苗组合中重要的新添资产。
值得一提的是,Abrysvo还可能获批用于孕妇人群。当孕妇接种疫苗时,她们会产生中和抗体,这些抗体会穿过胎盘,为婴儿出生后的头几个月提供保护。此外,诸如正在进行临床试验的Moderna的mRNA候选疫苗等竞品,也走到中后期,并计划向FDA提交上市申请。
图/FDA
二、成功冲线后的老年组,仍需监管
1. GSK的Arexvy
5月4日,FDA已批准Arexvy用于预防60岁及以上人群因感染RSV引发的下呼吸道疾病(LRTD)。这是全球首款获批用于老年人的RSV疫苗,来自RSV亚型A(两种感染亚型之一),由稳定的preF与AS01佐剂组成。
批准是基于AReSVi-006关键性III期试验的积极结果。在试验中,该疫苗对60岁及以上成人的RSV-LRTD的保护效力为82.6%,具有显著的统计学和临床意义,达到试验主要终点。
此外,在至少患有一种基础疾病的老年人中,如心血管疾病和内分泌代谢疾病,该疫苗的保护力为94.6%。对于重度RSV-LRTD患者(即因RSV-LRTD妨碍日常活动的患者),其保护效力为94.1%。
一项旨在将可能受益于RSV疫苗接种的人群扩大到50岁~59岁成年人(包括有基础疾病的受试者)的临床试验,正在进行且受试者已经招募完毕,预计2023年会有结果,同时还会有AReSVi-006 III期保护效力试验和AReSVi-004免疫原性试验等结果。
这些试验将继续评估每年接种的程序以及接种一剂疫苗后覆盖多个流行季的保护效力、免疫原性的可能性。其他两项流感疫苗联合接种的临床试验结果,也有望在2023年6月的免疫实践咨询委员会(ACIP)会议前公布。
2. 辉瑞的Abrysvo
6月1日,辉瑞宣布其RSV二价疫苗Abrysvo获得FDA批准,用于预防60岁及以上成人由RSV引起的LRTD。该疫苗是一种非佐剂二价疫苗,含有来自RSV-A和RSV-B的稳定preF蛋白亚基。
此次获批是基于辉瑞在2022年8月公布的III期临床试验RENOIR的积极顶线结果。数据显示,与安慰剂相比,Abrysvo提供了与GSK疫苗相当的保护,该疫苗在预防至少有两种症状的RSV-LRTD方面的有效率为66.7%,在预防有三种或以上症状感染方面的有效率为85.7%。
此外,这项研究还表明,针对融合前形式蛋白的特异性抗体在阻断病毒感染方面非常有效,这表明基于preF蛋白的疫苗可能对RSV起到最佳保护作用。
三、安全性不容忽视
尽管,GSK和辉瑞的疫苗总体上都是安全且耐受性良好的,但FDA委员会还是指出,关于这些疫苗单独使用或与其他疫苗的联合使用,还存在安全性、持久性等各种悬而未决的问题。
此前有数据表明,在接种Abrysvo疫苗中有3名患者患上了由周围神经的自身免疫攻击引起的格林-巴罗综合征(GBS)。无独有偶,在对Arexvy疫苗与流感疫苗联合使用的研究中,2名患者患上了急性播散性脑脊髓炎,这是一种罕见的影响中枢神经系统的免疫介导疾病,并且其中1名试验参与者死亡。FDA委员会还表示,接种疫苗后30天内,心脏房颤也是监测重点。
对此,辉瑞表示,将根据FDA的要求进行Abrysvo上市后的后续试验,以了解与该疫苗相关的GBS风险,并根据实际数据进行药物警戒研究。Fred Hutchinson癌症中心的生物统计学家Holly james也表示赞同,监测过程中要明确罕见的不良事件是否值得关注。
但另一个关键问题是,如若将RSV疫苗与流感疫苗或COVID-19疫苗联合使用,是否会影响治疗的安全性和有效性?事实上,在GSK开展的研究试验表明,目前为止,RSV疫苗与流感疫苗联合使用不会产生任何疗效上的差异。辉瑞疫苗研发副总裁Alejandra Gurtman也表示,辉瑞也将尽快提供类似研究的数据。
四、下一个突破口是保护婴幼儿群体
在老年人群中,辉瑞Abrysvo上市批准的确比GSK的Arexvy晚了几周,但这并不能掩盖Abrysvo在孕产妇人群中出色的疗效。Gurtman表示,这不仅对RSV很重要,而且对孕产妇免疫领域也很重要。
去年11月,Abrysvo的关键III期临床试验MATISSE结果披露。这些孕妇在妊娠24-36周时,接受RSV preF疫苗或安慰剂单次肌肉注射。在出生后90天和180天,辉瑞的RSV疫苗在减少需要医疗护理的RSV相关严重LRTD方面的有效率分别为81.8%和69.4%。安全性方面,试验中未发现在母亲和≤24个月婴孩的安全信号。
疗效总是与风险并存,尽管MATISSE结果喜人,但安全数据则不那么明朗。数据显示,早产发生率在疫苗组为5.6%,在安慰剂组为4.7%。这一差异在统计上并不显著,也与死亡率增加无关,咨询会议上的专家们也表达了担忧。
密歇根大学流行病学家Arnold Monto表示,尽管早产的信号有点令人担忧,不过这是人类第一次有机会用疫苗来预防新生儿的RSV感染。
基于前述研究数据,5月18日,FDA专家咨询委员会通过投票的方式,支持批准辉瑞研发的针对孕妇接种的RSV疫苗,旨在保护6月龄以前的婴儿免受RSV的侵害。同时,所有委员会成员都强调,有必要对Abrysvo的安全性信号进行积极的上市后监测。
事实上,GSK也一直致力于测试Arexvy十是否适用于孕产妇免疫,可喜的是,在研究过程中,GSK发现该疫苗安全性与早产风险显著增加(疫苗组为6.8%,安慰剂组为5.0%)以及婴儿死亡率相应增加,故而暂停了该项III期试验。
此外,阿斯利康和赛诺菲也正瞄向这一赛道。1月,这两家已经向FDA提交长效单克隆抗体nirsevimab上市申请。6月8日,FDA抗菌药物咨询委员会(AMDAC)以21:0的投票结果一致认为,nirsevimab在预防RSV相关LRTD方面具有良好的获益风险特征,适用于即将进入或在第一个RSV感染季期间出生的新生儿和婴儿。此外,委员会还以19:2的投票结果支持nirsevimab对24个月以下的儿童使用,FDUFA日期为2023年第三季度。
除已获批的欧盟和英国市场外,nirsevimab于2月在日本递交上市申请,4月在加拿大获批上市。如今,中国CDE已正式授予nirsevimab创新药优先审评资格,有望于8月前完成批准。
在关键的IIIb期研究HARMONIE研究中,与未干预组相比,nirsevimab降低了83%因RSV引起LRTD导致的住院率,且nirsevimab组婴儿全因LRTIs住院率降低58%。这意味着,如果婴儿接受nirsevimab作为预防手段,对儿科因呼吸道疾病引起的医疗系统负担会降低。同时,nirsevimab还可有效降低75%因严重RSV相关LRTIs(患者的经皮血氧饱和度低于90%,需要氧疗)导致的住院率。
可是,这些策略并不能保护所有处于RSV感染中的年轻群体。Graham表示,对于6个月到5岁的婴幼儿疫苗还尚未解决有效安全性问题。
Moderna则从自己的所长切入。该公司认为,mRNA进入细胞的方式与病毒非常相似,mRNA疫苗的蛋白质产物也可以进入细胞,向免疫系统发出病毒感染信号并进行抗原加工和呈递。其候选产品mRNA-1345正在进行I期临床测试,涵盖了5岁及以下的RSV暴露和未暴露的儿童。
参考资料:
1. RSV vaccines score landmark FDA approvals;Nature Reviews Drug Discovery
2. 决胜RSV的“冲锋号”?半个多世纪沉浮,单抗、疫苗如千帆竞发;同写意
3. 百亿美元RSV蓝海:GSK、辉瑞竞品评审在即,Moderna超车可能吗?;同写意
本文来自微信公众号:同写意 (ID:tongxieyi),作者:写意君

