本文来自微信公众号:同写意Biotech(ID:TXYBiotech),作者:杨翼,题图来自:视觉中国
如果药物最初被FDA批准用于指定罕见病,它便拥有了孤儿药物的头衔。在一项涉及孤儿药的研究中,研究者发现了孤儿药利用其特殊身份,在享受福利恩泽的同时,大肆开疆拓土,成为重磅药物的情况。研究者针砭时弊地指出这种现象的危害,并呼吁立法者修改法案加以限制。[1]
这项研究对于孤儿药和非孤儿药的定义如下:只有当药物的初始适应症在FDA批准之前被授予孤儿指定时,才将该药物归类为孤儿指定。在药物具有多个初始适应症的情况下,仅在所有适应症均为孤儿指定的情况下将药物归类为孤儿指定。同时具有孤儿药和非孤儿药适应症的6种药物归类为非孤儿药。
研究者将2008年1月1日到2016年12月31日首次上市的药物作为研究对象,并进行了5年的随访,直至2021年12月31日。在这315种药物中,83种(26%)最初被指定为孤儿药。这些孤儿药的5年美国市场净销售额【净销售额=总销售额-(退货价值+折扣损失+销售税+津贴)。计算净销售额,需从总销售额中减去生产以外的所有影响销售额的因素】的中位数为7.19亿美元,非孤儿药的5年美国市场净销售额中位数为8.12亿美元。
在83款孤儿药中,有67种(81%)具有单一适应症,16种(19%)在5年内衍生出了多种适应症,其中6种(7%)包含次要非孤儿适应症。具有1个适应症的孤儿药的销售额,与83款整体孤儿药之间没有显着差异(中位数,7.17亿美元)。
这项研究表明,作为孤儿药获得首次批准的药物,对于制造商来说与为更常见病症开发的药物一样有利可图。其中6例孤儿药,在获得首次批准之后,在随后的5年内扩展了非罕见病标签。在这种情况下,药品制造商受益于孤儿药法案的激励措施,将孤儿药的价格仍然移花接木到所有适应症上。
这意味着,制造商以更高的价格抵消了孤儿药市场狭小的弊端。从2008年到2018年,孤儿药的上市价格是非孤儿药价格的7倍。从1998年到2017年,孤儿药的平均价格增长了26倍,而特殊药和传统药的价格仅翻了一番。孤儿药也在以前所未有的速度获得批准并进入市场。在新上市的药物中,孤儿药的份额在1998-2017年的20年间增加了4倍多,从10%增加到44%(图1)。
作为孤儿药上市的药物,它们处方数量也越来越多,而且通常是针对非罕见病,且原本可以用其他疗法治疗的病症。2017年,前10名最畅销药物中有7种是孤儿药,但它们被广泛用于非孤儿适应症和标签外用途。[2] 其中最具代表的是修美乐Humira,可用于治疗类风湿性关节炎、银屑病关节炎、强直性脊柱炎、克罗恩病、溃疡性结肠炎、斑块状银屑病、化脓性汗腺炎、葡萄膜炎和幼年特发性关节炎等多种疾病,2017年仅一名患者每年的费用就超过69295美元。
尽管享受着孤儿药价格的红利,但超过90%的修美乐处方都用于非罕见病。[2] 另一款类似产品是Remicade ,它可治疗类风湿性关节炎和结肠炎等多种疾病,2017年仅一名患者每年的费用就超过31531美元。尽管价格是孤儿药的价格,但超过93%的Remicade处方用于非罕见病。[2]

图1. 1998-2007年上市药物类型分布图:孤儿药(粉色)、特殊药品(灰色)和传统药物(黑色)。(图片来源:AHIP)
以下一组数据也很能说明问题:2019年,88%的孤儿药每年在每个患者身上产生的费用超过1万美元;2017年10大畅销药中,有7款自带“孤儿药”光环;孤儿药的毛利润率高于80%,而医药行业平均毛利润率为16%(2019年数据)。[2] 1998至2017年的20年间,孤儿药的年平均费用为12万3543美元,是传统药物的25倍(图2)。
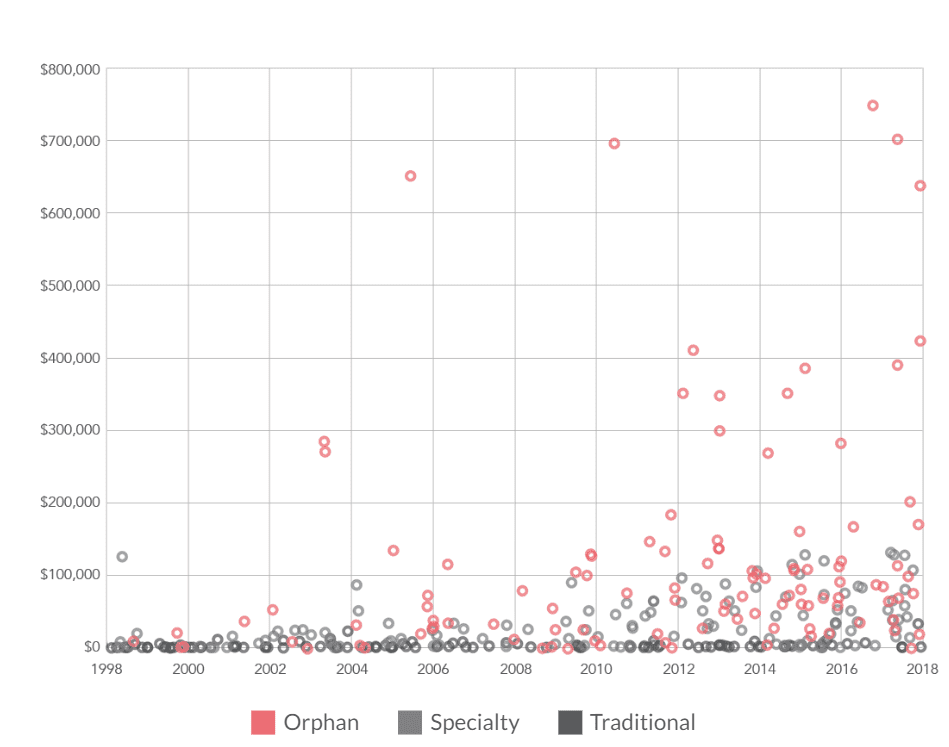
图2. 孤儿药(粉色)、特殊药品(灰色)和传统药物(黑色)费用年份分布图。(图片来源:AHIP)
那么问题来了,当孤儿药成为重磅炸弹之后,它之前享受的种种特殊扶持优待,是不是应该吐出来一些?你不能一手拿着特困补助,一手又去赚着大钱。孤儿药已成为制药商有利可图的商机。制药公司正在寻求“孤儿”地位,以开发用于治疗其他常见疾病的重磅药物。他们获得了孤儿地位的好处包括但不限于补贴、税收抵免和豁免,但同时却可能创造数十亿美元的利润。
该研究建议,国会可以改革《孤儿药法》(Orphan Drug Act)中的法定激励措施,例如要求制造商在孤儿指定产品取得商业成功时偿还税收抵免。
早在2021年,民主党人就曾试图削减税收抵免。前众议院议长Nancy Pelosi的一项法案将调整孤儿药法部分的措辞,从“测试必须与罕见疾病的使用相关”转变为“测试必须与首次用于罕见疾病的使用相关。”[3] 一个“首次用于”,指出了孤儿药不应凭借其孤儿药的“丹书铁券”,在获得了上市成功之后,在扩大的标签使用上,仍然享受“孤儿药”身份的红利。用孤儿药的价格,享受着非罕见病的市场。
政策上的这些信贷扶持,在2015年为生物制药公司节省了超过1亿美元的开发费用。这种政策,多年来一直遭受争议,民主党也曾经试图完全取消孤儿药的信贷扶持,尽管它能起到积极作用。根据GAO(Government Accountability Office, 美国政府问责局)的数据,FDA在2008年至2017年在27个不同治疗领域批准了351种孤儿药。[4] 美国国会最近还重新授权了从2023年到2027年的3000万美元孤儿药拨款,以帮助支付开发罕见疾病药物的费用,包括试验费用。该拨款计划由FDA运营,自1983年以来一直资助临床研究,扶持了80多种药物获得批准的试验。
药品价格失控,伤害了患者的利益。立法者应该重新审视《孤儿药法》中的激励措施,以确保享受了孤儿药红利的那些药物,是“术业专攻”地使用于罕见疾病和相应的患者,而不是作为获得溢价和畅销药物,应用于超出罕见病的高利润领域。如果后者情况发生,那么当初享受的福利待遇应该返还。
参考文献:
[1] Rome, B. N. et al. Trends in prescription drug launch prices, 2008-2021. JAMA. 2022, 327, 2145-2147.
[2] The Rise Of Orphan Drugs. AHIP. Nov. 2019.
[3] Brennan, Z. When orphan drugs are blockbusters: Researchers call on Congress to make companies pay back tax credits. Endpoints News. 09. 05. 2023.
[4] Orphan drugs. FDA Could Improve Designation Review Consistency; Rare Disease Drug Development Challenges Continue. United States Government Accountability Office. Nov. 2018
本文来自微信公众号:同写意Biotech(ID:TXYBiotech),作者:杨翼

