本文来自微信公众号:同写意Biotech(ID:TXYBiotech),作者:十七,原文标题:《饱受争议的Aβ假说何时能被彻底攻破?》,题图来自:《实习生》
随着老年化的加剧,阿尔兹海默病(AD)成为困扰千千万万家庭的心魔。但尽管科学家们已经非常努力,目前,仍然没有任何一种疗法可以达到大幅减少认知能力下降的终极目标。
阿尔兹海默症的发病机制复杂,至今仍未完全破译具体机制。尽管β淀粉样蛋白(Aβ)假说饱受争议,但在阿尔兹海默病新药研发领域,目前为止β淀粉样蛋白假说依然是影响最深远的理论。
在阿尔兹海默症领域,失败的案例太多,制药巨头纷纷倒下,如诺华、安进和班纳的BACE1抑制剂CNP520(umibecestat),罗氏的crenezumab,礼来的semagacestat、solanezumab以及lanabecestat,辉瑞与强生的bapineuzumab,强生的atabecestat等。
这些失败的案例让人们对阿尔兹海默症药物的开发蒙上厚厚的阴影,但是全球老年化加速增加了人们对阿尔兹海默症药物的渴望和需求。从2022年到2028 年,全球阿尔兹海默病治疗市场预计将以12.19%的复合年增长率增长,预计到2028年阿尔兹海默病治疗市场规模达到71.6亿美元,这一极大的市场也吸引络绎不绝的企业前仆后继。
近年来,只有卫材/Biogen靶向Aβ的两款阿尔兹海默病单抗新药Aducanumab和Lecanemab获得了FDA的批准,而国内只有九期一(sodium oligomannurarate,GV-971)被批准上市并被纳入医保。
除此之外,还有很多进入临床的直接靶向Aβ蛋白或使Aβ含量降低的药物。如近期,恒瑞医药宣布其自主研发的抗Aβ单克隆抗体SHR-1707注射液用于治疗早期阿尔兹海默病的Ib期临床试验在中国科学技术大学附属第一医院完成了首例患者入组及给药。
靶向Aβ的药物大部分是单抗,但也有一些小分子抑制剂可以减少Aβ的聚集和含量,从而治疗阿尔兹海默病,本文主要总结直接靶向Aβ蛋白的单抗或间接减少Aβ的聚集和含量的小分子药物研发进展。
Aβ假说和治疗
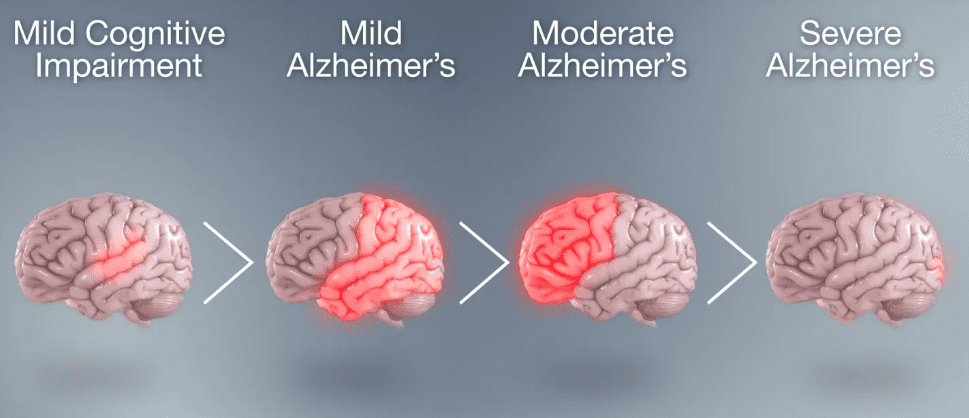
阿尔兹海默病(AD)是最常见的神经退行性疾病,对大脑造成损害(图1),占所有痴呆症病例的60 - 70%。随着社会老龄化的加深,AD的防治变得越发重要,但尽管科学家们已经非常努力,目前,仍然没有任何一种疗法可以达到大幅减少认知能力下降的终极目标。
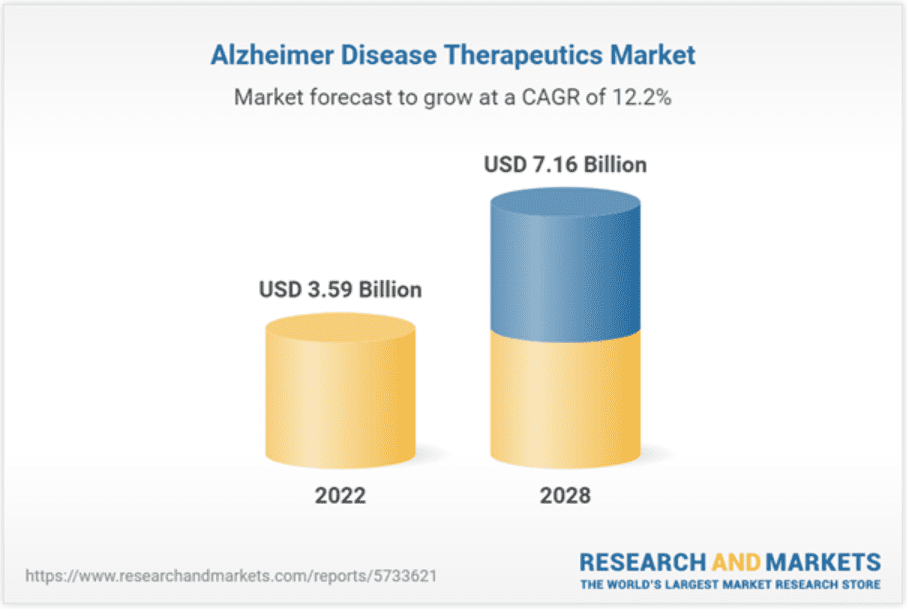
从 2022 年到 2028 年,全球阿尔兹海默病治疗市场预计将以12.19%的复合年增长率增长,预计到2028年阿尔兹海默病治疗市场规模达到71.6亿美元[1]。据估计,中国的阿尔兹海默病患病率很高,其次是美国和日本,2021年。阿尔兹海默病患病率的增加正在推动全球阿尔兹海默病治疗市场的增长。据估计,仅在美国,每年就有大约900,000名新患者被诊断出来(图2)。
阿尔兹海默症的发病机制复杂,至今仍未完全破译具体机制。尽管β淀粉样蛋白(Aβ)假说饱受争议,但在阿尔兹海默病新药研发领域,目前为止β淀粉样蛋白假说依然是影响最深远的理论,Aβ假说的基本观点为Aβ的沉积是发病的始发因素,Aβ的聚集具有神经毒性。
Aβ含有39~43个氨基酸的多肽,是通过β-和γ-分泌酶对跨膜淀粉样前体蛋白(APP)的蛋白水解过程产生的。
因此,以Aβ级联假说为理论基础,设计药物靶向患者脑内Aβ,通过减少Aβ生成或促进Aβ清除,以阻止疾病进展,是目前抗Aβ治疗的核心思路,包括分泌酶抑制剂和Aβ免疫疗法等。
分泌酶抑制剂通过减少Aβ生成以降低脑内Aβ水平,如β分泌酶-1抑制剂、γ-分泌酶抑制剂。但前期的临床药物试验多因安全性问题而终止。
Aβ免疫疗法包括主动免疫疗法(疫苗)和被动免疫疗法(抗体)。主动免疫疗法是通过接种Aβ抗原,使机体获得Aβ免疫清除能力,但大多数因严重的不良反应而终止试验。而被动免疫疗法则是通过直接注射人源性Aβ抗体(单抗)以清除脑内Aβ,相比前者,其安全性大大提高,是目前新药开发的热点。
批准上市的靶向Aβ假说疗法
近年来,只有卫材/Biogen的两款阿尔兹海默病新药Aducanumab和Lecanemab获得了FDA的批准,而国内只有九期一(sodium oligomannurarate,GV-971)被批准上市并被纳入医保。
但是不管是Aducanumab还是九期一的上市都饱受争议,人们对于它们是否能治疗AD持怀疑态度。
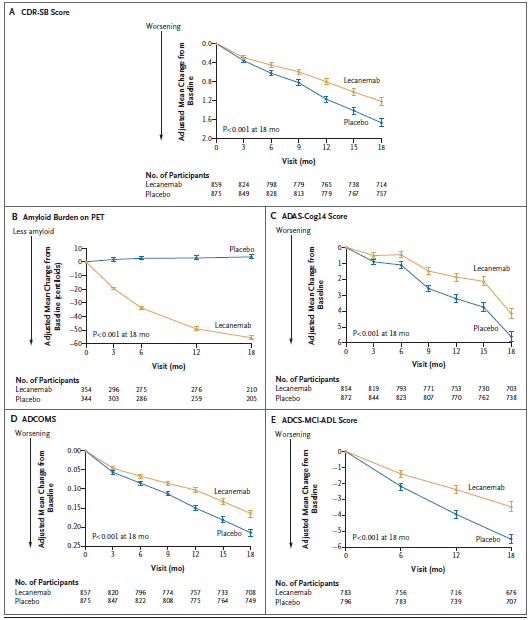
Lecanemab是人源化的与Aβ可溶性原纤维高亲和力结合的IgG1单克隆抗体,近期Dyck等人在NEJM杂志上发布了他们为期 18个月、多中心、双盲的3 期试验,涉及50至90岁患有早期阿尔兹海默病(轻度认知障碍或阿尔兹海默病引起的轻度痴呆)的人(图3)[2]。
在这项3期试验中,18个月时,相对于基线,lecanemab组中CDR-SB评分(主要评分)低于安慰剂组。次要临床终点的结果与主要终点的结果方向相同。与单体淀粉样蛋白相比,lecanemab对Aβ的可溶性聚集物质具有高选择性,对纤维状淀粉样蛋白具有中等选择性;该概况被认为是针对最具毒性的病理性淀粉样蛋白物种。
2023年1月6日,FDA通过加速批准途径批准了Leqembi(lecanemab-irmb)用于治疗阿尔兹海默病(图3)。

图3. FDA通过加速批准途径批准了Leqembi用于治疗AD
临床III期的靶向Aβ假说疗法
近期,礼来宣布终止其III期阿尔兹海默症药物solanezumab的开发,原因是在临床试验中未能清除或阻止β-淀粉样蛋白斑块蓄积,也没能减缓阿尔兹海默病早期患者的认知能力衰退。
目前,礼来除了solanezumab之外,还有另两种处于III期的阿尔兹海默病单抗药物donanemab和remternetug。与solanezumab不同,这两种药物专门针对沉积的淀粉样蛋白,并已被证明可清除淀粉样斑块。
2022年11月30日,礼来发布Donanemab治疗阿尔兹海默症三期临床TRAILBLAZER-ALZ4的最新数据,该研究选择与Biogen已经获批的Aducanumab头对头对比。经过6个月的治疗,Donanemab治疗组37.9%的患者实现脑部amyloid的清除,而Aducanumab治疗组这一比例为1.6%。Donanemab将脑部amyloid斑块水平减少了65.2%,Aducanumab治疗组这一比例为17.0%。
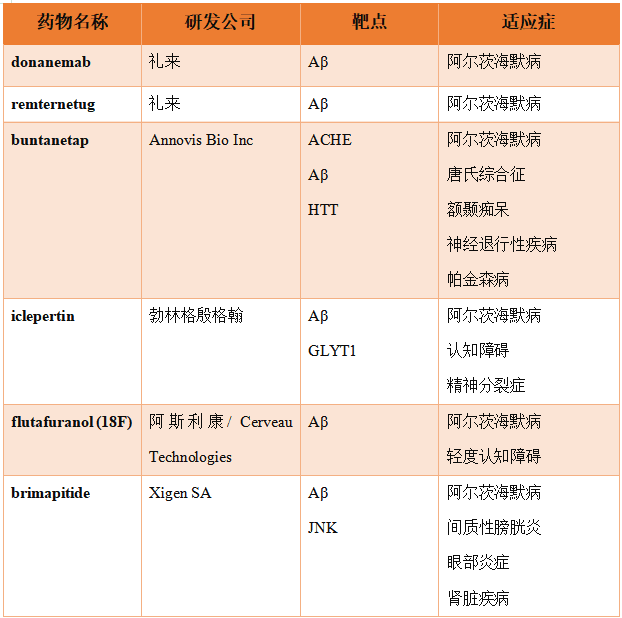
除此之外,进入临床III期的靶向Aβ假说疗法还有Annovis Bio的buntanetap,勃林格殷格翰的iclepertin,罗氏的crenezumab,阿斯利康/ Cerveau Technologies 的flutafuranol (18F),Xigen SA的brimapitide(表1)。
Buntanetap(ANVS401)是一种口服脂质小分子药物,它具有独特的作用机制,能够通过与mRNA上的调控元件结合,抑制多种蛋白的合成,包括生成β淀粉样蛋白的淀粉样前体蛋白(APP),tau蛋白和α突触核蛋白。与靶向单一潜在致病蛋白的疗法不同,它相当于在一种药物里集合了靶向多种蛋白的潜力(图4)[3]。
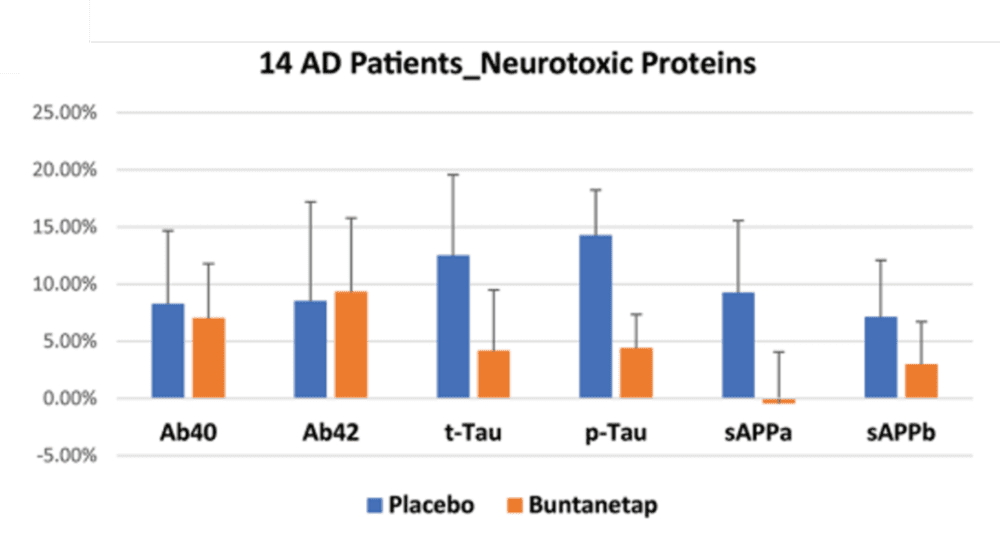
图4. Buntanetap减少APP和tau蛋白含量
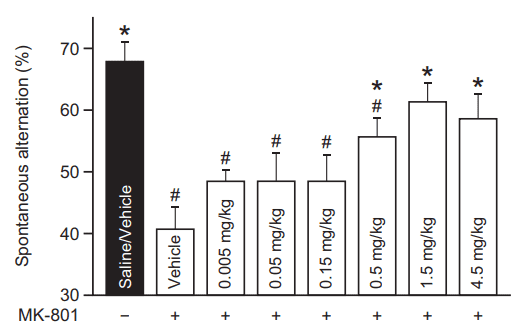
新型GlyT1抑制剂iclepertin(BI 425809)在最近的一项精神分裂症患者临床研究中改善了认知能力(图5)[4]。
临床II期的靶向Aβ假说疗法
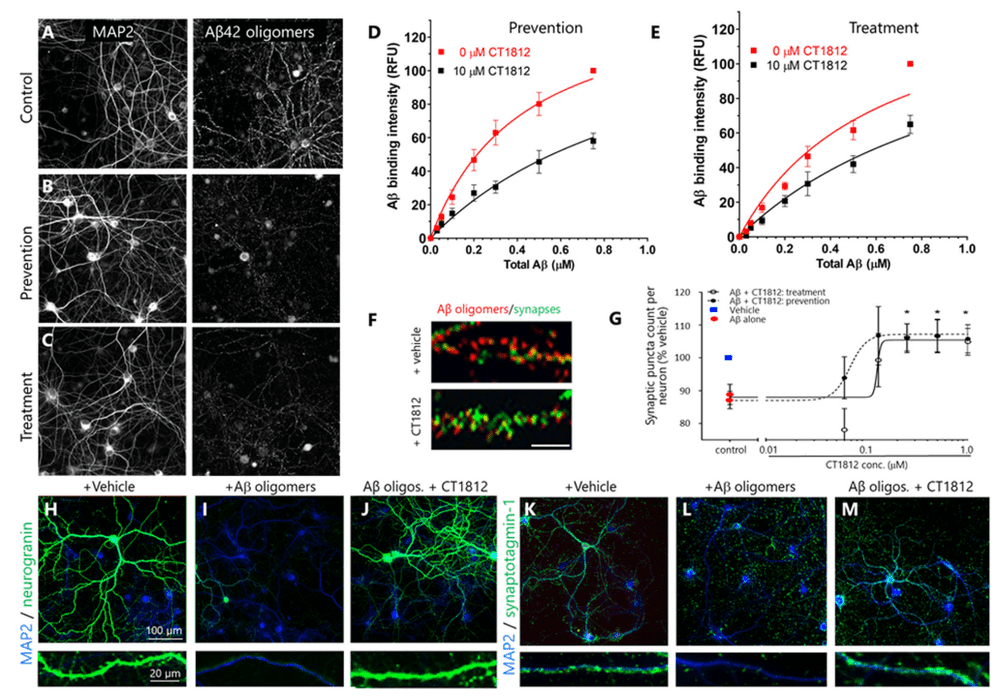
CT1812是一种研究中的口服小分子药物,可穿透血脑屏障并选择性地与sigma-2(σ-2)受体复合物结合,可有效阻断Aβ低聚物毒性(图6)[5]。
2023年2月23日,Cognition Therapeutics公司于宣布用于AD的药物CT1812已经通过了FDA评论期,现已可以进行CT1812在患有轻度认知障碍或早期阿尔兹海默病的成年患者中的临床Ⅱ期START研究。这项随机、安慰剂对照试验将在北美约50至60个不同地点进行,共招募540位志愿者。
AC Immune的ACI-24.060抗淀粉样蛋白β疫苗在1b/2期ABATE试验中显示出积极的初始中期安全性和免疫原性(图7)。

除此之外,其它进入临床II期的靶向Aβ假说疗法显示如表2。
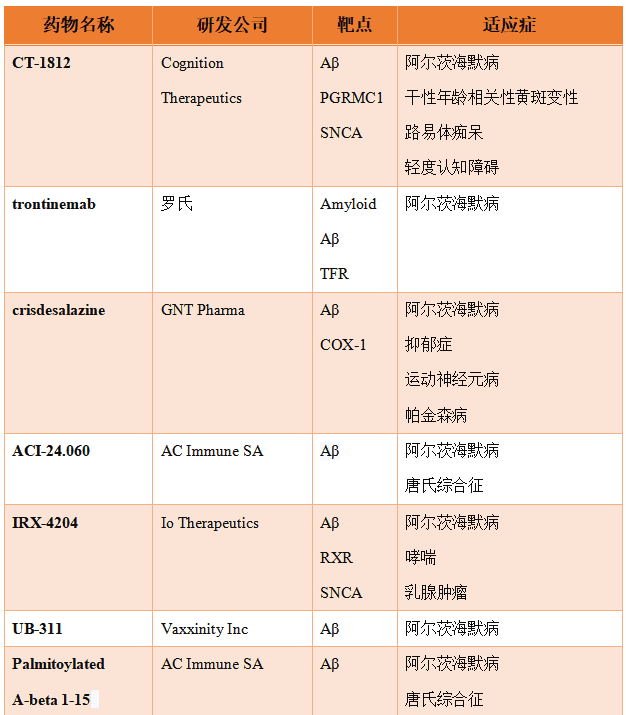
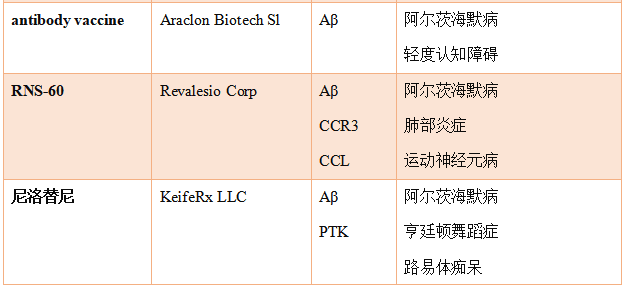

表2. 临床III期的靶向Aβ假说疗法
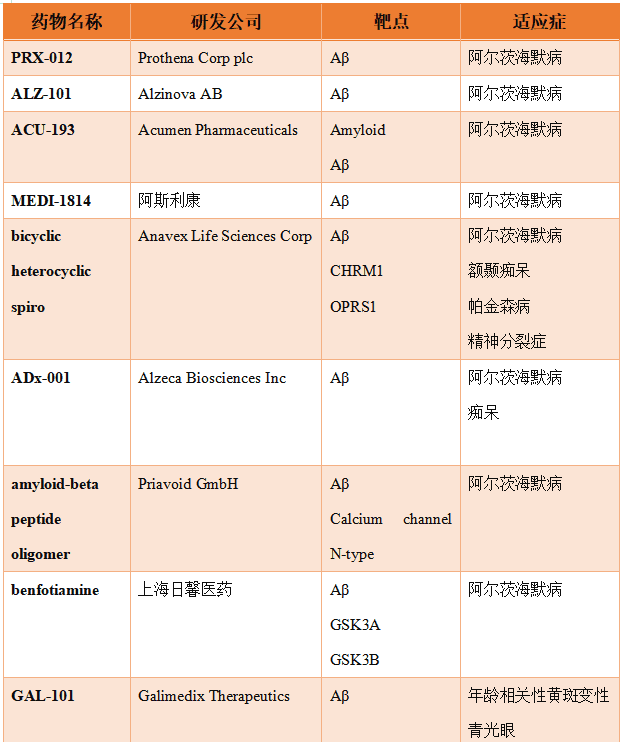
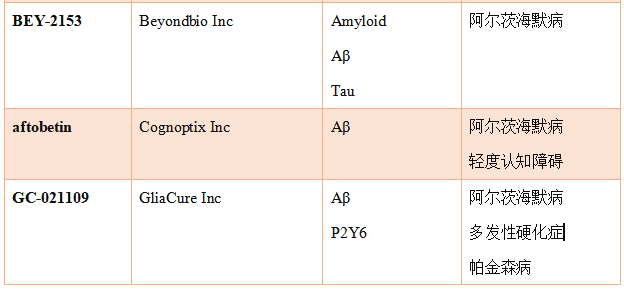
临床I期的靶向Aβ假说疗法
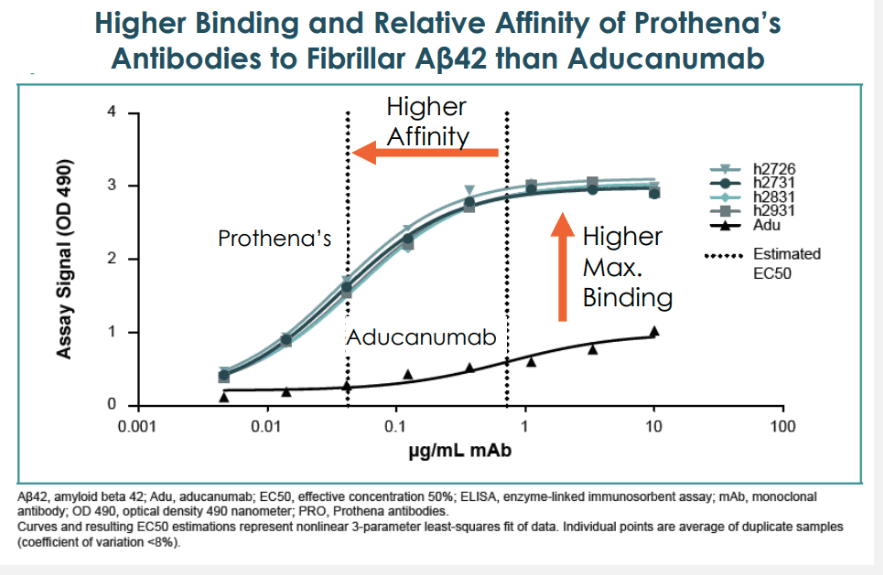
PRX012是一种潜在的同类最佳的抗淀粉样β蛋白(Aβ)抗体,对原纤维Aβ的亲和力是Aducanumab的11倍,并且具有更强的识别Aβ病理的能力(图8),这意味着即使在较低的抗体浓度下,斑块结合的覆盖范围也更大,正在开发用于治疗AD。2022年3月,Prothena宣布FDA批准IND用于PRX012。
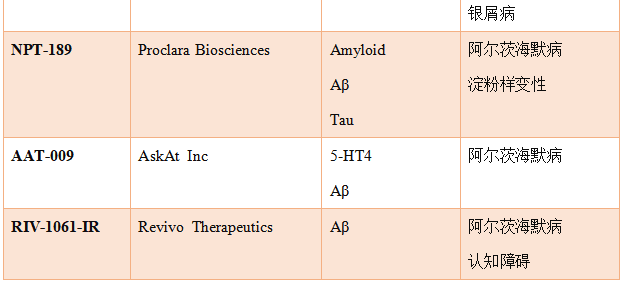
除此之外,其它进入临床I期的靶向Aβ假说疗法总结如表3。
小结
随着老年化的加剧,人们对阿尔兹海默症药物的需求越来越多,然而关于阿尔兹海默症发病机制争论不休,除了Aβ假说,还有tau蛋白等其它理论。
即使已经有两款FDA批准的治疗阿尔兹海默症药物,但是它们并不能彻底治愈阿尔兹海默症,Aducanumab的上市更是饱受争议,带来的影响和销售额远远低于预期。
还有很多折戟在临床的药物纷纷让人们对于这一领域感到迷茫,但这一领域巨大的需求使得无数企业前仆后继,国内也有很多企业从事阿尔兹海默症药物开发。相信不久的将来阿尔兹海默症一定能被攻破。
参考文献:
1. Alzheimer's Disease Therapeutics Market Forecast - Epidemiology & Pipeline Analysis 2023-2028 (researchandmarkets.com)
2. C.H. van Dyck, C.J. Swanson, P. Aisen, R.J. Bateman, C. Chen, M. Gee, M. Kanekiyo, D. Li, L. Reyderman, S. Cohen, L. Froelich, S. Katayama, M. Sabbagh, B. Vellas, D. Watson, S. Dhadda, M. Irizarry, L.D. Kramer, and T. Iwatsubo, Lecanemab in Early Alzheimer’s Disease, n engl j med 388;1 nejm.org January 5, 2023
3. C. Fang, P. Hernandez, K. Liow, E. Damiano, H. Zetterberg, K. Blennow, D. Feng, M. Chen, M. Maccecchini, Buntanetap, a Novel Translational Inhibitor of Multiple Neurotoxic Proteins, Proves to Be Safe and Promising in Both Alzheimer’s and Parkinson’s Patients, J Prev Alz Dis 2023;1(10):25-33
4. Holger Rosenbrock, Cornelia Dorner-Ciossek, Riccardo Giovannini, Bernhard Schmid, Niklas Schuelert, Effects of the Glycine Transporter-1 Inhibitor Iclepertin (BI 425809) on Sensory Processing, Neural Network Function, and Cognition in Animal Models Related to Schizophrenia, J Pharmacol Exp Ther. 2022 Aug;382(2):223-232.
5. Nicholas J Izzo, Carla M Yuede, Kelsie M LaBarbera, Colleen S Limegrover, Courtney Rehak, Raymond Yurko, Lora Waybright, Gary Look, Gilbert Rishton, Hank Safferstein, Mary E Hamby, Claire Williams, Kelsey Sadlek, Hannah M Edwards, Charles S Davis, Michael Grundman, Lon S Schneider, Steven T DeKosky, Daniel Chelsky, Ian Pike, Christopher Henstridge, Kaj Blennow, Henrik Zetterberg, Harry LeVine 3rd, Tara L Spires-Jones, John R Cirrito, Susan M Catalano, Preclinical and clinical biomarker studies of CT1812: A novel approach to Alzheimer’s disease modification, Alzheimers Dement. 2021 Aug;17(8):1365-1382.
本文来自微信公众号:同写意Biotech(ID:TXYBiotech),作者:十七

