本文来自微信公众号:同写意Biotech(ID:TXYBiotech),作者:杨翼,原文标题:《Gilead与GSK的抗HIV药物竞赛》,题图来自:视觉中国
长期以来,GSK一直是长效HIV药物领域的开拓者。在近期的逆转录病毒和机会性感染会议(CROI)上,GSK介绍了他们的联合药物Cabenuva(包含Cabotegravir和Rilpivirine两种活性物质) 的数据,可以实现每两个月注射一次的给药频率。
在与竞争对手Gileade的Biktarvy® (每日一次给药)的头对头Solar试验中,Cabenuva表现出了不次于对手的疗效,而且90%的转换了产品的患者更喜欢长效疗法。
Biktarvy®(Bictegravir, Emtricitabin, Tenofovir)
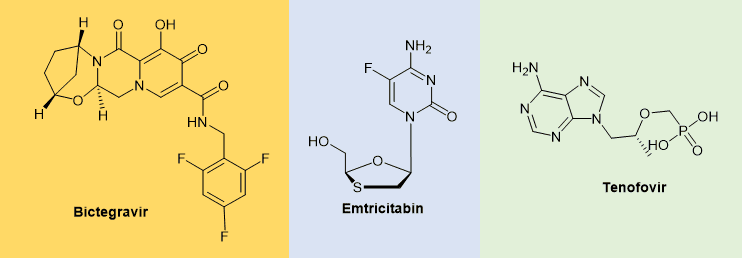
Bictegravir (Biktarvy®的活性成分之一)是一种小分子整合酶抑制剂(图1),用于治疗HIV感染。Bictegravir适用于治疗既往未接受过抗逆转录病毒治疗的患者的HIV-1感染。此外,Bictegravir适用于病毒学抑制(HIV-1 RNA <50 c/mL)患者的HIV-1感染管理,这些患者接受了至少三个月的常规抗逆转录病毒治疗,无治疗失败史且无耐药性表现。Bictegravir与tenofovir和emtricitabin联合使用(图3)。[1]
Bictegravir抑制HIV-1病毒复制到人类基因组中,它抑制病毒DNA链转移到宿主基因组中,从而阻止HIV-1复制。它可以每天服用一次,无需额外给药。
Cabenuva(Cabotegravir和Rilpivirine)
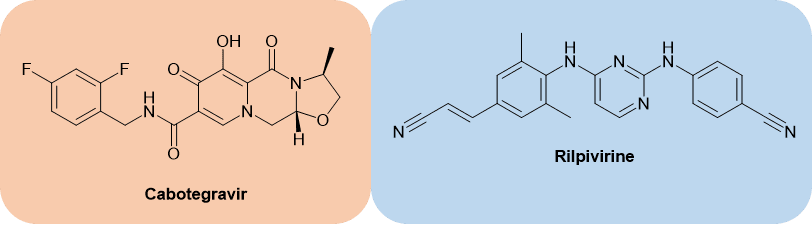
GSK的长效HIV药物Cabenuva包括两种活性物质:Cabetegravir和Rilpivirine(图2)。
Cabenuva是一种长效、完整的HIV治疗方案,可以每两个月注射一次,一年只需6次。同bictegravir 一样,cabotegravir是一种HIV-1整合酶抑制剂(HIV-1 integrase inhibitor),与HIV整合酶的活性位点结合,阻止病毒基因组转移到宿主基因组中,并阻止病毒复制。[2] Rilpivirine是一种非核苷逆转录酶抑制剂(non-nucleoside reverse transcriptase inhibitor)。[3]
Cabotegravir于2021年1月21日获得FDA批准,与rilpivirine联合治疗病毒学抑制个体的HIV-1感染。[4] 虽然最初为每月给药一次,但该组合产品于2022年2月1日获得FDA批准,可以每两个月给药一次 并且不需要事先进行口头导入期(oral lead-in period)。
口服 cabotegravir与rilpivirine联合,用于短期治疗HIV-1病毒学抑制的成人,这些成人没有治疗失败史。[2]
肌内缓释cabotegravir与rilpivirine联用,被指定为治疗成人和12岁及以上体重至少35公斤的青少年HIV-1感染的完整方案,以取代目前那些针对病毒学抑制患者的抗逆转录病毒方案。他们采用稳定的抗逆转录病毒疗法,没有治疗失败史,并且没有对 cabotegravir或rilpivirine的耐药性。[5]
Cabotegravir的缓释注射混悬液制剂也适用于体重至少35公斤的高危成人和青少年中预防性获得性HIV-1感染(即暴露前预防,pre-exposure prophylaxis, PrEP)。[6]
Lenacapavir
虽然长效药物Cabenuva数据表现优良,但Gilead也有自己开发长效HIV药物的计划,lenacapavir就是他们信心的来源。Gilead提供了关于lenacapavir与广泛中和抗体相结合的早期数据,他们的目标是实现每六个月给药一次的频率。
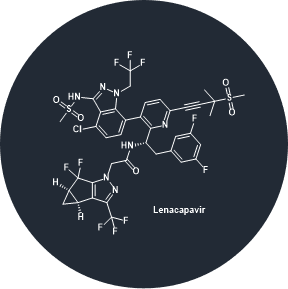
抗HIV病毒治疗的过程中,最为艰巨的挑战之一来自于多药耐药性(multidrug resistance)和患者难以坚持治疗方案。[7] Lenacapavir是一种小分子药物(图3),是首创新药的衣壳抑制剂(capsid inhibitor)。在体外单一疗法中,显出皮摩尔量级的HIV-1抑制活性,与现有抗逆转录病毒药物几乎没有交叉耐药性,并且通过皮下给药的方式实现药代动力学的优化。欧盟委员会于2022年8月22日首次在全球范围内批准了Lenacapavir治疗患有多重耐药性HIV感染的成人;2022年12月22日,它获得了FDA的批准。
Lenacapavir是一种具有扩展药代动力学特性的抗病毒药物。Lenacapavir通过抑制病毒复制来对抗HIV-1病毒:它干扰病毒生命周期的许多重要步骤,包括病毒摄取、组装和释放。[8] HIV病毒在与宿主细胞膜初始融合后,病毒衣壳被释放到宿主细胞的细胞质中。衣壳包含大约250个六聚体和恰好12个五聚体,每个都由单体衣壳蛋白(CA)组成。为了促进HIV-1基因组整合,衣壳必须穿过核膜。Lenacapavir 与 CA 六聚体结合,lenacapavir的强结合,竞争性地中断衣壳与关键宿主蛋白的结合,从而抑制衣壳进入细胞核,阻断了病毒的复制。Lenacapavir口服给药后的中位半衰期为10至12天,皮下给药后为8至12周。[2]
Lenacapavir每年注射两次的药物,已经作为Sunlenca®被批准用于治疗多重耐药HIV,这是一个小众市场。扩展到更广泛的HIV患者群体将取决于将其与其他疗法相结合。

除此之外,Gilead还在尝试其它的联合疗法,比如在CROI公布的 lenacapavir + 广泛中和抗体(bNAbs,broadly neutralising antibodies)teropavimab 和 zinlirvimab的1期研究结果。这项研究在病毒学抑制的HIV患者中测试了该组合,其基线抗逆转录病毒治疗被单次皮下剂量的lenacapavir(加上口服负荷剂量)和单次静脉内剂量的teropavimab和zinlirvimab取代。主要终点是安全性,但该药厂还研究了患者是否在六个月时保持病毒学抑制。在20名可评估的患者中,18名在6个月时仍受到病毒学抑制。在安全性方面,没有发生4级或5级不良事件,也没有任何导致停药的事件。这些结果足以让Gilead进入2期临床。
Cabenuva与Biktarvy、Lenacapavir的抗HIV竞赛
反弹是抗HIV药物面临的严峻挑战。上文提及的接受lenacapavir+广泛中和抗体bNAb治疗的20名患者中,有一名在第16周出现病毒反弹。另一名患者退出了研究,但在第12周(最后一次可用测量)时显示出病毒抑制。Gilead没有对反弹做出解释,称该患者的lenacapavir与bNAb浓度与同一剂量组中的其他受试者一致。调查仍在继续,但这将是未来对更多患者进行的试验中需要特别关注的事情。那位出现反弹的患者,在使用口服抗逆转录病毒药物重新抑制了病毒。病毒学反弹可能是由对治疗的抵抗力引起的,这一直是联合疗法关注的问题。
Solar头对头试验(Gilead的Biktarvy® vs GSK的Cabenuva)的结果再次引发了人们对于抗药性的关注。这次3期试验招募了670名已经接受Biktarvy®病毒抑制的患者,并将他们随机分配到继续治疗或改用Cabenuva。主要终点是一年的非劣效病毒学疗效,通过HIV-1RNA为50c/ml或以上的患者比例来衡量。结果是两组之间的比率相似。然而,三名接受Cabenuva治疗的患者已证实病毒学失败并伴有耐药性相关突变,而Biktarvy®组则没有。
尽管如此,Viiv(GSK、辉瑞与盐野义联合创办的专门研发HIV药物的公司)的发言人称,Cabenuva的好处,包括其给药频率较低。其优势“超过了耐药性发展失败的低风险”。她指出,耐药性发展失败的风险不到1%。
该发言人还补充说,Biktarvy®组之所以没有造成病毒学失败,是因为招募的受试者此前已经接受了超过两年的Biktarvy®治疗,已经算是Biktarvy®获得成功的人选。颇有一些幸存者偏差(survival bias)的逻辑影响。
GSK的Cabenuva尽管在给药频率上优势明显,但它要取代Biktarvy®的地位还有很长的路要走。根据Evaluate Pharma的预测,Gilead的Biktarvy®到2028年将实现超过120亿美元的总销售额;Jefferies的分析师预测它的全球峰值销售额将为30亿美元。
除了Cabenuva与Biktarvy®的头对头竞争之外,在长效领域,Cabenuva与Lenacapavir也必定有一番龙争虎斗。
参考文献:
[1] EMA Approved Drug Products: Biktarvy (bictegravir, emtricitabine, tenofovir alafenamide) Oral Tablets.
[2] FDA Approved Drug Products: Vocabria (Cabotegravir) Oral Tablets.
[3] Johns, B. A. et al. Carbamoyl pyridone HIV-1 integrase inhibitors 3. A diastereomeric approach to chiral nonracemic tricyclic ring systems and the discovery of dolutegravir (S/GSK1349572) and (S/GSK1265744). J. Med. Chem. 2013, 56, 5901-5916.
[4] FDA News Release: FDA Approves First Extended-Release, Injectable Drug Regimen for Adults Living with HIV.
[5] FDA Approved Drug Products: Cabenuva (Cabotegravir and Rilpivirine) Intramuscular Extended-Release Suspension.
[6] FDA Approved Drug Products: Apretude (cabotegravir) extended-release suspension for intramuscular injection.
[7] Zhuang, S. et al. Interactions of HIV-1 Capsid with Host Factors and Their Implications for Developing Novel Therapeutics. Viruses. 2021, 13, v13030417.
[8] EMA Approved Drug Products: Sunlenca (lenacapavir) Subcutaneous Injection or Oral Tablets.
[General] Armstrong, M. CROI 2023 – GSK and Gilead’s long-acting HIV battle intensifies. Evaluate Vantage. 27, 02, 2023.
本文来自微信公众号:同写意Biotech(ID:TXYBiotech),作者:杨翼

