本文来自微信公众号:同写意(ID:tongxieyi),作者:杨翼,原文标题:《Covid-19警世通言:广谱抗病毒药物开发的思考》,题图来自:视觉中国
一、广谱抗病毒药物开发的大背景
全球 Covid-19 大爆发,暴露了人类公共卫生事业的巨大缺陷与漏洞。对于制药组织来说,及时开发出有针对性的抗病毒药物成为了这场风暴的核心要素。尽管疫苗和抗病毒药物以完全超越常规标准的速度实现,但全球仍然成为了病毒肆虐的欢场,而带给人类的却是极其惨痛的损失。
尽管风暴尚未消退,但制药界对于这场挑战带给人类的反思已经开始,其中重要的一项在于广谱抗病毒药物(BSA, broad-spectrum antivirals)的开发。
我们知道,市场上有很多广谱抗生素(broad-spectrum antibiotics)药物。所谓广谱抗生素,是同时作用于革兰氏阳性菌和革兰氏阴性菌这两个主要细菌群的抗生素,[1] 或任何作用于多种致病细菌的抗生素。[2] 当怀疑细菌感染但细菌群未知(也称为经验性治疗),或怀疑感染多组细菌时,通常可以使用这些广谱抗生素药物稳定病情。特别是对于危及生命的感染,针对性的治疗不能等到病原体被确定才开展,广谱抗生素的作用在这种情形下就是无可替代了。
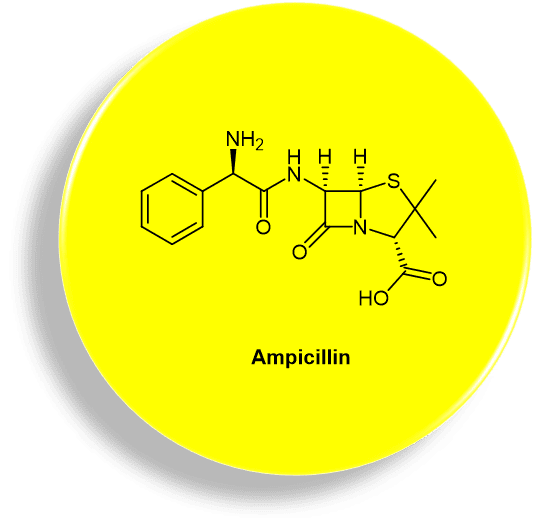
广谱抗生素与那些针对特定细菌群有效的窄谱抗生素(narrow-spectrum antibiotic)形成对比。[3] 常用的广谱抗生素的一个例子是氨苄西林 (Ampicillin,亦称氨苄青霉素,图1)。Ampicillin是一种β-内酰胺类抗生素,可治疗多种细菌感染。[4] 适应症包含呼吸道感染、泌尿道感染、脑膜炎、沙门氏菌感染症,以及心内膜炎。
除了Ampicillin之外,常见的广谱抗生素药物还包括强力霉素、米诺环素、氨基糖苷类(链霉素除外)、阿莫西林/克拉维酸 (Augmentin)、阿奇霉素、碳青霉烯类(例如亚胺培南)、哌拉西林/他唑巴坦、喹诺酮类药物(例如环丙沙星)、四环素类药物(Sarecycline除外)、氯霉素、替卡西林、甲氧苄氨嘧啶/磺胺甲恶唑 (Bactrim)等众多类型。
相对于广谱抗生素的遍地开花,广谱抗病毒药物 BSA 的开发明显滞后。尽管有很多潜在的广谱抗病毒药物处在不同的临床阶段,但目前很少有真正的广谱抗病毒药物得到有效利用。概念中的广谱抗病毒药物 BSA 是可抑制多种病毒(属于两个或多个病毒科的病毒)复制的药物。BSA 通过抑制病毒蛋白(如聚合酶和蛋白酶),或通过靶向宿主细胞的因子起效,这些宿主细胞的因子在病毒感染和复制过程中为病毒所利用。[5]
截至 2021 年,有 150 种已知的 BSA 处于不同的开发阶段,可有效对抗 78 种人类病毒。[6] BSA 是治疗新出现以及重新出现的病毒的潜在候选者,例如埃博拉病毒、马尔堡病毒和 SARS-CoV-2。[7] 许多 BSA 显示出对其他病毒的抗病毒活性,而不是最初研究的病毒,例如瑞德西韦(Remdesivir)和干扰素 α (interferon alpha)。
二、广谱抗病毒药物开发的必要性与挑战
导致缺乏广谱抗病毒药物的一个因素是病毒检测技术滞后,尤其是针对呼吸道病毒的检测。今天开发流感和呼吸道合胞病毒(RSV,respiratory syncytial virus)的常规检测,是因为已知这些感染会导致全世界数以千计的患者住院,并且可以对他们进行治疗。但直到最近,用于广泛检测其他病毒的测试仍不可用,或未被常规使用。
这种迟滞导致了一种恶性循环:没有正确的测试,人们就不知道病毒引起的严重疾病的范围;而出于对病毒致病严重程度的不可知,对于病毒诊断和抗病毒药物的开发动力就不能被调动起来。尽管检测技术在不断改进,但检测仍未广泛开展。即使进行了检测,许多病毒病原体也无法获得治疗。这正是 COVID-19 大流行初期发生的情况:我们对致病病毒知之甚少,也没有针对感染的治疗方法。
尽管 SARS-CoV-2 是已知的第七种感染人类的冠状病毒,但人类在挑战面前快速应对的表现仍然不够合格。虽然有效的 COVID-19 管理需要抗病毒和抗炎治疗策略,但在危局面前,人们需要一种有效、安全并且快速(这个快速的标准这里尤为重要)的抗病毒药物用于治疗和预防。
然而,鉴于药物开发从靶标发现到批准,平均需要 12 年的时间,期望在短时间内开发出安全且具有选择性的抗病毒药物是不切实际的。试想如果存在合理开发,效果明显的广谱抗病毒药物,它们就有可能改变全球对 SARS-CoV-2 的反应,并显著减轻大流行对全球人民生命安全和全球经济的影响。
如果从积极的角度来看到这场 COVID-19 疫情,它至少促使人们在开发广谱抗病毒药物的方面进行反思与改进,这一点可以从两个方面看待[8]:
首先,疫情提高了人们对于病毒致命性的认识:除流感和 RSV 之外的多种呼吸道病毒,包括冠状病毒、人偏肺病毒(HMPV)、副流感病毒,甚至普通感冒病毒(鼻病毒),都可能导致严重疾病和高住院率,甚至严重威胁患者生命安全。这刺激了一个“良性循环”:我们测试得越多,我们发现的导致严重疾病的病毒就越多,我们就越认识到需要开发新的治疗策略来对抗它们。
其次,最近由甲型禽流感(H3N2,1968 年)、猪流感(H1N1,2009 年)和 COVID-19 冠状病毒(SARS-CoV-2,2019 年)等新型病毒引起的疫情,凸显了需要用于大流行防范的广谱抗病毒药物。与 SARS 和 MERS 冠状病毒一样,这些大流行性病毒是人畜共患的:它们从非人类动物宿主传播,有时通过中间宿主传播。
这意味着它们对人类健康构成严重威胁,特别是当病毒(如 SARS-CoV-2)非常适合人际传播的情况下,因为人类宿主对这些新出现的病原体缺乏特异性免疫力。在这种困局面前,开发广谱抗病毒药物就是抑制病毒快速失控传播的关键武器。
三、广谱抗病毒药物开发思路[9]

大多数批准的抗病毒药物以病毒蛋白为靶点,通常选择性地针对一种病毒起作用。例如 Paxlovid 中的抗病毒活性拟肽 nirmatrelvir,靶向的就是 SARS-CoV-2 病毒的 3C 样蛋白酶(3C-like protease,或称main protease,简写为3CLPro或MPro)。从历史上看,抗病毒药物开发更是不成比例地集中在靶向病毒蛋白上,支持了“直接作用抗病毒药物” (DAAs, direct-acting antivirals)的开发。
然而,除了直接靶向病毒蛋白受体之后,我们也知道,病毒利用大量宿主细胞蛋白(host proteins)来执行其生命周期中的重要步骤,这些被病毒挟持的宿主细胞蛋白同样可以作为开发“宿主定向抗病毒药物 ”(HDAs,host-directed antiviral agents)的目标。由于来自一个家族的病毒通常使用相同的宿主细胞蛋白,因此靶向这些蛋白可能产生具有广谱抗病毒活性的药物,并对病毒耐药性制造了障碍。HDA 的一个关键特征是它们的开发可以在病毒病原体爆发之前进行。近年来,有十几种人畜共患病毒引起了致命的人类疾病,并且仍可能将是未来爆发的潜在来源,这一事实凸显了对 HDA 的需求。
1. 阻止病毒入侵的宿主蛋白酶抑制剂
流感病毒、副流感病毒和冠状病毒等呼吸道病毒,依赖宿主蛋白酶来激活它们的进入因子(entry factor),从而促进膜融合和进入气道上皮细胞。跨膜蛋白酶丝氨酸 2 (TMPRSS2, transmembrane protease serine 2)是一种普遍表达的丝氨酸蛋白酶,对人流感病毒的血凝素(HA, hemagglutinin)和 SARS 样冠状病毒的刺突 S 蛋白的切割和激活至关重要。[10]
TMPRSS2 对于宿主发育和体内平衡是可有可无的,因此可能构成一个有吸引力的治疗靶点。[11] 需要注意的是,那些被 HDA 靶向的宿主蛋白,应该是那些对宿主细胞本身不构成关键作用的蛋白,因此它们的抑制不会产生不良影响或者安全问题,这一点是开发 HAD 的前提条件。
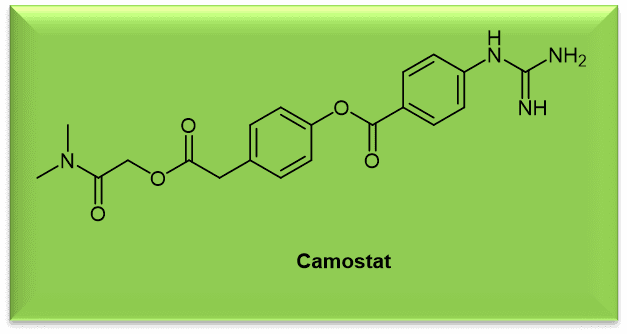
卡莫司他(Camostat,图2)是一种临床阶段的丝氨酸蛋白酶抑制剂,能够阻断 SARS-CoV-2 和流感病毒的病毒进入。[9] 与呼吸道病毒的发病机制有关的丝氨酸蛋白酶被归类为胰蛋白酶样蛋白酶(trypsin-like proteases),具有结构上保守的活性位点。胰蛋白酶样蛋白酶的这一特性可用于设计具有广谱活性的抑制剂。[12] 尽管卡莫司他抑制了 SARS-CoV-2 的进入和复制,但它并没有完全消除病毒复制,这可能反映了S 蛋白激活的方式有可能不是通过单一途径实现的。
除了TMPRSS2之外,宿主细胞的弗林蛋白酶(furin)也在病毒侵入宿主的过程中起到关键的切割作用,因此也可以提供开发HDAs的思路。弗林蛋白酶介导的切割可以作用于不同病毒家族的几种病毒糖蛋白,包括 Borna-、Bunya-、Corona-、Filo-、Flavi-、Herpes-、Orthomyxo-、Paramyxo-、Pneumo-、Retro - 和 Toga 病毒。[13]
二、诱导干扰素抗病毒[8]
HDAs 的开发也可以通过增强患者自身对病毒感染的免疫反应来实现。这种策略不仅可以避免病毒耐药性,而且为开发广谱抗病毒药物提供了可能。这是因为它们触发了人体对任何病毒的自然防御,而无论病毒的身份、突变状态或耐药性如何。因此,这种针对宿主的抗病毒药物作为广谱抗病毒药物具有最大的前景。
干扰素(IFN,Interferons)是一类信号蛋白,由各种细胞类型分泌,协调人体的天然抗病毒反应。干扰素家族中的I 型干扰素,作为先天免疫反应的一部分组成人体抵御病毒的第一道防线,它包括多种 IFNα和 IFNβ亚型,以及四种 III 型 IFNλ 亚型。先天免疫(innate immunity)是人体对感染的一种本能反应,对感染病原体而言是自发的和非特异性的。
在受感染细胞内,IFNβ 和 IFNα 亚型启动即时强烈的反应,来协调抗病毒反应;与此同时,它们也启动未感染细胞,以阻止病毒复制的途径,产生针对病毒的抗体和T细胞的适应性免疫反应,并激活免疫调节途径。由于 I 型干扰素受体在全身广泛表达,因此它们可以保护许多不同类型的细胞免受病毒侵害。IFNβ 对大多数呼吸道病毒的反应比 IFNα 更强。IFNλ 的作用类似,但其受体主要在上皮细胞上表达,因此限制了它对其它细胞的保护作用。
IFNβ 和 IFNα 的注射剂已获得 FDA 批准,用于治疗复发缓解型多发性硬化症(MS,multiple sclerosis) 和人乳头瘤病毒(HPV,human papillomavirus)、乙型肝炎病毒(HBV,hepatitis B virus)和丙型肝炎病毒 (HCV,hepatitis C virus)感染。由于 IFNβ 对呼吸道病毒的效力和对多种细胞类型的影响,IFNβ 作为治疗剂可能比 IFNα 和 IFNλ 具有更大的开发潜力。
3. 细胞内核苷酸耗尽,以阻止病毒复制的策略
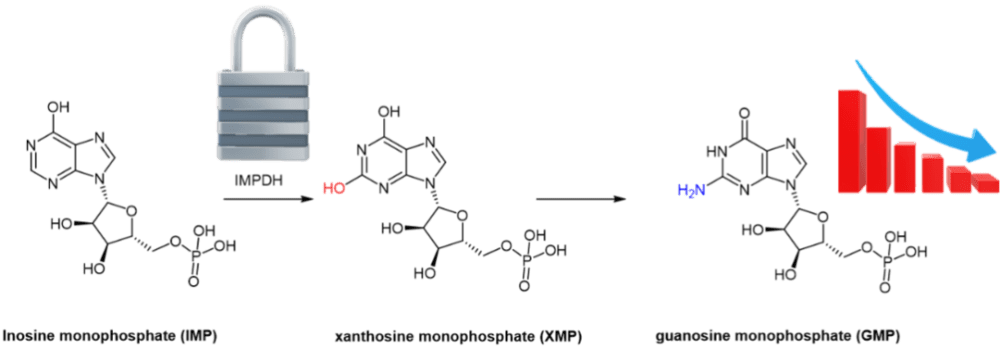
病毒复制增加了可用核苷酸的细胞负担,这个思路可以作为干扰病毒复制的机理。肌苷 5'-单磷酸脱氢酶(IMPDH)催化鸟嘌呤核苷酸(guanine nucleotides)生物合成中的一个重要步骤,即将 IMP(肌苷酸,Inosine monophosphate)转化为黄苷单磷酸(XMP,xanthosine monophosphate)。
XMP 介导单磷酸鸟苷(GMP,guanosine monophosphate)的形成,这是许多细胞过程的关键分子。抑制 IMPDH 会导致细胞内鸟嘌呤核苷酸水平耗尽,从而限制病毒复制所需的 RNA 和 DNA 合成。
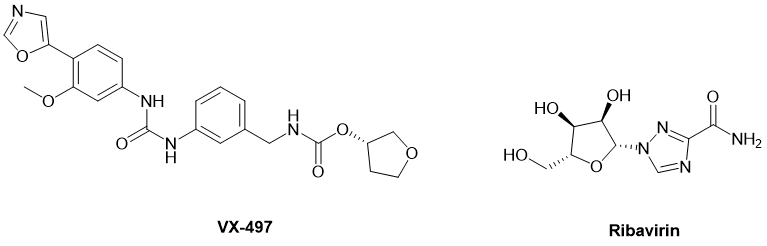
IMPDH 抑制剂的例子有VX-497(图4),它一种具有广谱活性的非竞争性 IMPDH 抑制剂;[14] 还有利巴韦林(Ribavirin,图4),它是一种竞争性 IMPDH 抑制剂(所谓竞争性或非竞争性,指的是抑制剂是否与天然底物竞争性地结合受体的活性位点。如果是,那就属于竞争性抑制剂;如果抑制剂通过结合其它位点抑制底物,那就属于非竞争性抑制剂)。
总结
在超过 90 种获批的抗病毒药物中,HIV 和 HCV 药物占所有获批药物的三分之二 。[15] 抗病毒药物以小分子为主,占批准的抗病毒药物的 87%。尽管对宿主靶标及其在抗病毒生命周期中的相关性进行了广泛研究,但针对宿主蛋白的获批抗病毒药物(HDAs)的数量仍显著滞后。所有批准的抗病毒药物中只有约 10% 是针对宿主蛋白的,其中一半是干扰素相关的生物制剂。[16]
抗病毒药物的临床开发和应用,需要仔细考虑其假定的益处及其潜在的副作用。当靶向宿主蛋白时,药物相关不良事件(DAE,drug-related adverse events) 和毒性的话题几乎是不可避免的。DAE 的来源包括化学相关毒性或途径相关毒性。潜在药物的化学毒性主要是不稳定官能团导致的。
另一方面,途径相关毒性则是与药物的生物活性相关的。直接作用抗病毒药物(DAAs) 的一个优势在于它们攻击的是病毒蛋白而不是宿主蛋白,从而减少理论上对脱靶效应的担忧。然而,即使使用 DAA,脱靶效应也是不可避免的,因为已知的宿主蛋白有数万种。
对于宿主定向抗病毒药物 HDA,安全性问题是一个核心考虑的内容,因为应避免靶向对细胞发育和体内平衡很重要的蛋白质或途径。HCQ(羟氯喹, hydroxychloroquine)在治疗 COVID-19 过程中暴露出来的心脏毒性就有效地说明了这一点。[17] 在 HDA 的开发中,途径相关毒性需要在药物开发的临床前和转化阶段进行更严格的研究。
呼吸道病毒感染,例如由流感和冠状病毒引起的感染,或由具有大流行潜力的登革热或寨卡病毒引发的出血热,都是可以在几周内消退的急性感染。因此,治疗策略的特点是短期使用,允许更高的阈值来接受非致命的副作用。值得注意的是,FDA 和数据安全监测委员会在批准抗 SARS-CoV-2 药物中奉行了这样的风险管理。
SARS-CoV-2 大流行凸显了抗病毒药物库中对 DAA 和 HDA 的需求,同时也暴露了我们在广谱抗病毒药物开发领域的缺陷。以史为鉴,广谱抗病毒药物的研发不可再次延误。
参考文献:
[1] Ory, E. M. et al. The use and abuse of the broad spectrum antibiotics. JAMA. 1963, 185 (4): 273–279.
[2] Clayton L. Thomas, ed. (1993). Taber's Cyclopedic Medical Dictionary (17th ed.). F. A. Davis Co.
[3] Hopkins, S. J. (1997). Drugs and Pharmacology for Nurses (12th ed.). Churchill Livingstone.
[4] Ampicillin. The American Society of Health-System Pharmacists.
[5] Bekerman, E. et al. Infectious disease. Combating emerging viral threats. Science. 2015, 348 (6232): 282–283.
[6] drugvirus.info.
[7] García-Serradilla, M. et al. Drug repurposing for new, efficient, broad spectrum antivirals. Virus Research. 2019, 264: 22–31.
[8] Monk, P. The Need — And Opportunity — To Develop Broad-Spectrum Antivirals. Pharmaceutical Online. 03, 01, 2023.
[9] Vipul C. Chitalia, V. C. et al. A painful lesson from the COVID-19 pandemic: the need for broad-spectrum, host-directed antivirals. J Transl Med. 2020, 18, 390.
[10] Hoffmann, M. et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell. 2020;181:271–80.
[11] Kim, T. S. et al. Phenotypic analysis of mice lacking the Tmprss2-encoded protease. Mol Cell Biol. 2006;26:965–75.
[12] Laporte, M. et al. Airway proteases: an emerging drug target for influenza and other respiratory virus infections. Curr Opin Virol. 2017;24:16–24.
[13] Braun, E. et al. Furin-mediated protein processing in infectious diseases and cancer. Clin Transl Immunology. 2019;8:e1073.
[14] Markland, W. et al. Broad-spectrum antiviral activity of the IMP dehydrogenase inhibitor VX-497: a comparison with ribavirin and demonstration of antiviral additivity with alpha interferon. Antimicrob Agents Chemother. 2000; 44: 859–866.
[15] Chaudhuri, S. et al. Innovation and trends in the development and approval of antiviral medicines: 1987–2017 and beyond. Antiviral Res. 2018; 155: 76–88.
[16] De Clercq, E. et al. Approved antiviral drugs over the past 50 years. Clin Microbiol Rev. 2016; 29: 695–747.
[17] Mercuro, N. J. et al. Risk of QT interval prolongation associated with use of hydroxychloroquine with or without concomitant azithromycin among hospitalized patients testing positive for coronavirus disease 2019 (COVID-19). JAMA Cardiol. 2019.
本文来自微信公众号:同写意(ID:tongxieyi),作者:杨翼

