本文来自微信公众号:菠萝因子(ID:checkpoint_1),作者:80后菠萝博士,原文标题:《T-DXd终于在中国获批上市!它如何改变了癌症治疗?》,题图来自:视觉中国
一
最近,千呼万唤的T-DXd(注射用德曲妥珠单抗)在中国大陆获批上市,用于HER2阳性晚期乳腺癌的治疗。中国患者终于等到了这个新药,这两天也有读者留言希望能讲讲。
上市的抗癌药不少,但疗效突出的“革命性药物”屈指可数。如果说18年以前,抗癌领域最亮眼的新药是PD-1免疫疗法,那最近几年应该就是T-DXd了。
T-DXd全称是Trastuzumab Deruxtecan,但更多人熟悉的是它在临床试验中用的小名:DS-8201。因为在多项研究中展现的惊艳数据,让它成为备受期待的新药。
比如在代号为DESTINY-Breast01的临床研究中,已经用过多个HER2靶向药但依然耐药的患者,尝试DS-8201,有60.9%的患者肿瘤再次缩小。下图就展示了168位耐药患者,在尝试DS-8201以后,多数人的肿瘤都显著缩小。这是前所未有的效果。
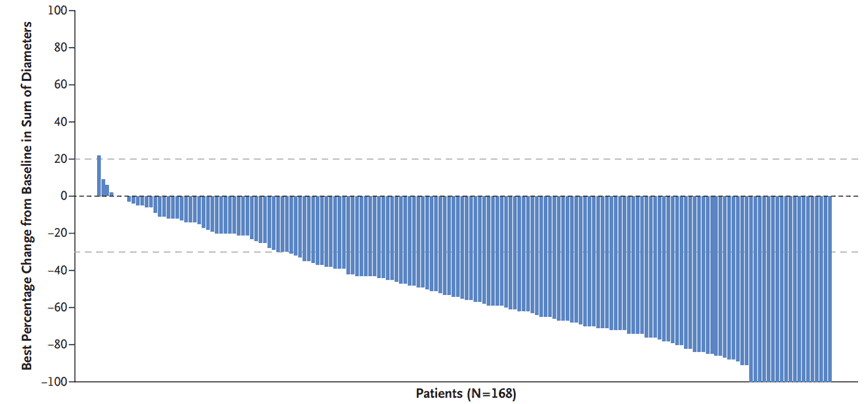
HER2阳性乳腺癌患者是幸运的。从1998年曲妥珠单抗上市,到20多年以后德曲妥珠单抗上市,同一个靶点,诞生了两个“革命性药物”。
真的很难想象,仅仅20年前,这些患者唯一的选择就是化疗。随着一代又一代针对HER2靶点的抗癌药上市,不断改变着HER2阳性乳腺癌患者的命运,刷新着晚期患者生存的极限。这就是科技进步的力量。现在,发达地区的HER2阳性乳腺癌患者的5年整体生存率已经接近90%。
同是身在中国的HER2阳性癌症患者,一个在2003年诊断,另一个在2023年诊断,命运将截然不同。
二
那什么是HER2阳性晚期乳腺癌呢?
它是指癌细胞高表达HER2蛋白的乳腺癌亚型。
HER2蛋白对应的基因,是人体最重要的致癌基因之一。HER2蛋白在很多肿瘤(一些乳腺癌、胃癌、肺癌、肠癌等)表达量特别高。一旦高表达,就经常能刺激癌细胞的生长和恶化。
HER2阳性的乳腺癌研究最多。在临床上,乳腺癌患者可以被分为HER2阳性、HER2低表达和HER2阴性三大类,其中阳性患者占了约20%。
以前HER2阳性乳腺癌也只能化疗,生存率不好,但20多年前曲妥珠单抗横空出世,成为第一个针对HER2的靶向药,能抑制这个致癌信号通路和癌细胞生长,从而让患者命运发生了质的飞跃,不仅生存率大幅提升,而且副作用也减少了。直到现在,对HER2阳性乳腺癌患者,曲妥珠单抗为基石的组合疗法依然是首选的一线标准治疗。
但曲妥珠单抗并不能解决所有的问题。
和其它靶向药一样,曲妥珠单抗效果虽好,但依然有不少患者会发生耐药。因此科学家一直在开发新一代的HER2靶向药,也陆续上市了更多药物,比如帕妥珠单抗、吡咯替尼、奈拉替尼等,这些药都把HER2阳性乳腺癌的整体治疗效果进一步提升。
但到目前为止,对疗效和生存期提升最明显,也是给耐药患者最大希望的,是德曲妥珠单抗。
和前面提到的各种HER2靶向药不同,德曲妥珠单抗属于一类全新的抗癌药物,叫“抗体偶联药物”,英文缩写是ADC。
抗体偶联药物,不同于化疗,也不同于传统靶向药。这类药物像乐高积木一样,由多个关键部分拼接而成。其中(A)是能识别癌细胞的抗体,(D)是能杀死癌细胞的毒素,而(C)则是把抗体和毒素绑定在一起的连接子。
A+D+C,组成了ADC药物。它就像一个精密的抗癌导弹系统:抗体是导航系统,毒素是炸药。进入体内后,抗体能特异地识别肿瘤细胞,然后再把毒素释放到肿瘤细胞附近,实现定向爆破,从而杀死肿瘤细胞。
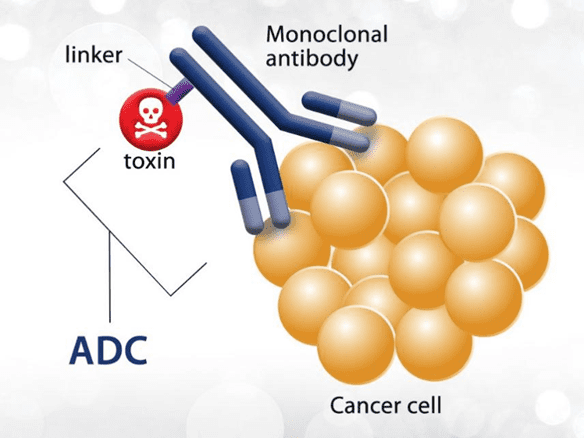
和化疗相比,抗体偶联药物代表了开发抗肿瘤新药的一个重要趋势,那就是“肿瘤富集”,或者叫“精准投放”。
我经常说,杀死癌细胞其实是很容易的,化疗药就特别擅长。但困难的是什么?是在杀死肿瘤细胞的同时,不杀死正常的细胞。
药物进入体内后,如果随机到处跑,那往往肿瘤细胞还没有杀干净,正常细胞就不行了,患者就承受不住了。这就是为什么化疗很难根治癌症,因为总有些肿瘤细胞比正常细胞更能扛。一旦因为副作用太强而停药,肿瘤就死灰复燃了。
怎么办呢?
科学家想到一种办法,就是把毒药特异地送到肿瘤那里,让药物在肿瘤细胞那里多,而在正常细胞那里少,从而产生更好的选择性。这就是开发“抗体偶联药物”的逻辑。
T-DXd就是利用针对HER2的抗体,来把大量化疗药定向投放到肿瘤细胞,实现精准杀伤。它本质上联合了两个抗肿瘤的药物,分别是一个HER2抗体靶向药,和一个化疗药。
很有趣的是,它使用的HER2抗体,正是前面提到的曲妥珠单抗。T-DXd全称是Trastuzumab Deruxtecan,而Trastuzumab就是曲妥珠单抗的英文名字,所以它真的是“站在了巨人的肩膀上”。
T-DXd(德曲妥珠单抗)不是第一个针对HER2的抗体偶联药物。在它之前,T-DM1(恩美曲妥珠单抗)已经上市,用于对一线HER2治疗耐药的患者。它的3期临床研究中,把患者中位生存期从25.1个月显著延长到了30.9个月。
T-DM1的成功证明了HER2抗体偶联药物的可行性,但它的效果依然有提高空间,所以探索更好抗体偶联药物的研究,在世界各地如火如荼地开展起来了。
在众多竞争者中,T-DXd脱颖而出。
三
到目前为止,几乎在每个关键临床研究中,T-DXd的效果都比以往治疗方案好了一大截,甚至可以说是碾压。
最开始说了,针对HER2阳性且多线耐药的晚期乳腺癌,60%以上患者的肿瘤都被再度缩小。也是因为如此,在2019年,它首次在美国加速获批上市,用于3线的晚期HER2阳性乳腺癌的治疗。
随后的好消息越来越多。
比如,在针对2线晚期乳腺癌患者的研究中,T-DXd更是直接头对头战胜了T-DM1,肿瘤显著缩小的患者比例更高(79.7%对34.2%),一年的无进展生存率也更高(75.8%对34.1%)。
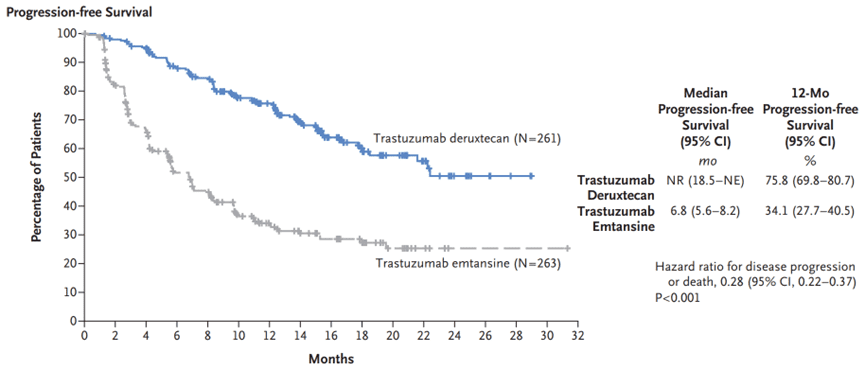
再比如,在针对HER2低表达的乳腺癌患者中,使用T-DXd后,治疗效果也显著优于以往的标准疗法:化疗。整体的中位总生存期从16.8个月,提高到了23.4个月。
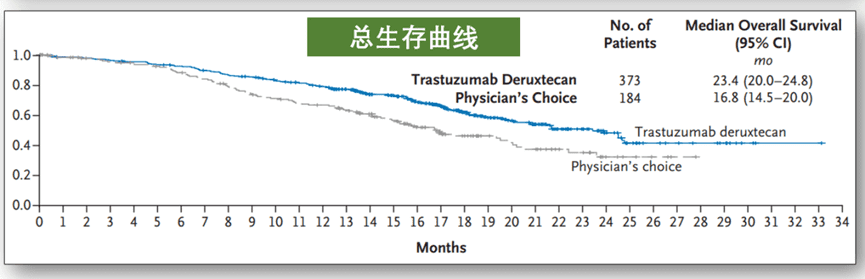
这个优秀的数据还在去年的美国临床肿瘤学会(ASCO)年会上带来了有趣的一幕,在美国教授分享了研究结果后,听众(主要是医生和制药专业人士)主动站起来长时间鼓掌,这在专业会议上是极为少见的。
大家肯定会问,为什么T-DXd会有这样的效果呢?
来自对药物的优化。
T-DXd最早来自日本的制药公司第一三共,2016年科学家首次公布了它的新型设计。虽然和T-DM1本质一样都是抗体偶联药物,但它做了一些重要的优化,包括下面两个:
(1)增加了每个抗体携带的毒素数量。T-DM1每个抗体平均携带3.5个毒素,而T-DXd携带了8个毒素。毒素多了,对肿瘤细胞的杀伤自然更猛了。
(2)使用了不同特性的毒素。T-DXd使用的毒素具有膜通透性,所以它不仅能杀死一个癌细胞,还能从细胞里扩散到周围,杀死别的癌细胞,这种被称为“旁观者杀伤效应”。它正在认真杀一个癌细胞呢,突然发现还围了一圈看热闹的癌细胞,于是大喊了一声“你瞅啥”,就把这些癌细胞也一起弄死了。
简单的说,T-DXd是T-DM1的一种升级版。导弹的导航系统没变,但是导弹上携带的炸药类型变了,而且挂的数量也更多了。正是这些改变,让T-DXd突破了治疗的天花板。
由于T-DXd优秀的数据,在还没正式上市之前,很多大药企就积极联系第一三共,希望能合作一起开发和推广这个药。最终在2019年,第一三共和阿斯利康达成全球合作协议,金额高达69亿美元,在除日本以外的市场共同开发和商业化。T-DXd的价值可见一斑。
自从2019年首次上市,T-DXd一路高歌猛进,伴随着公布的积极数据越来越多,目前在美国已经获批了五个适应证,横跨了HER2阳性晚期乳腺癌、HER2低表达晚期乳腺癌、HER2阳性晚期胃癌,以及HER2突变的晚期非小细胞肺癌。T-DXd的出现,已经改变了这些癌症的标准治疗指南。
四
T-DXd的成功对癌症患者的意义远不止如此。
在过去很多年,由于技术不成熟,很多抗体偶联药物都失败了,许多公司心灰意冷,砍掉了相关的部门和科研人员。现在,不仅T-DXd横空出世,还有让大家又燃起了希望。一夜之间,做抗体偶联药物的公司就成了炙手可热的香饽饽。新型抗体偶联药物一个接一个进入临床。
因为抗体偶联药物是一种技术平台。换一个靶点,换一个抗体,就可能产生针对其它癌症类型的新药。所以T-DXd的成功,带给了大家无限的想象力。比如和T-DXd使用相同技术的抗体偶联药物HER3-DXd和Dato-DXd也正在临床研究中 ,早期结果也很不错,有望给对靶向药/化疗已经耐药的一些肺癌患者带来全新选择。
德曲妥珠单抗并不是最近唯一上市的抗体偶联药物。同样在乳腺癌领域,抗体偶联药物戈沙妥珠单抗最近也获批,只不过针对的乳腺癌亚型不同,是用于治疗TROP2蛋白阳性的三阴乳腺癌。
相信未来一段时间,癌症患者会等来更多全新的药物。
每一个革命性的抗癌药都凝聚着无数科研工作者的心血,代表着人类对于抗癌认知的突破。好消息总是越来越多,我们距离把更多的癌症变成慢性病,总是越来越近了。
致敬生命!
参考文献:
HER2-targeted therapies - a role beyond breast cancer. Nat Rev Clin Oncol. 2020 Jan;17(1):33-48.
DS-8201a, A Novel HER2-Targeting ADC with a Novel DNA Topoisomerase I Inhibitor, Demonstrates a Promising Antitumor Efficacy with Differentiation from T-DM1. Clin Cancer Res. 2016 Oct 15;22(20):5097-5108.
Trastuzumab Deruxtecan in Previously Treated HER2-Positive Breast Cancer. N Engl J Med 2020; 382:610-621
Trastuzumab Deruxtecan in Previously Treated HER2-Positive Gastric Cancer. N Engl J Med 2020; 382:2419-2430
Trastuzumab Deruxtecan versus Trastuzumab Emtansine for Breast Cancer. N Engl J Med 2022; 386:1143-1154
Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. NEJM June 5,2022
本文来自微信公众号:菠萝因子(ID:checkpoint_1),作者:80后菠萝博士

