本文来自微信公众号:奇点网 (ID:geekheal_com),作者:谭硕,原文标题:《屡登顶刊,参与多种癌症,热门靶点IDH1到底有什么奥妙?丨全力纳“罕”》,头图来自:视觉中国
2022年2月9日,国家药品监督管理局(NMPA)正式批准又一种抗癌新药——IDH1抑制剂艾伏尼布(Ivosidenib)上市,用于治疗采用经充分验证的检测方法,诊断携带IDH1突变的复发或难治性成人急性髓系白血病(AML)患者。

AML是成年人发病率最高、预后最差的白血病类型[1],艾伏尼布的获批无疑是携带IDH1突变患者的及时雨。而事实上,IDH1突变的靶向治疗仅用十余年就发展成熟,这既反映了精准医学的迅速发展,也体现了它重要的治疗价值。
所以这一次,奇点糕就要从IDH1突变的发现开始,讲述又一个精彩的故事了。
一朝成名天下知
IDH的全称是异柠檬酸脱氢酶(Isocitrate dehydrogenase),参与细胞有氧代谢过程中的三羧酸循环,生理意义颇为重要。而第一篇提示IDH1突变与疾病有关的论文,就登上了大名鼎鼎的《科学》(Science)[2]。
然而看论文标题,却看不出与IDH或是白血病有关的迹象……没错,这是一项利用当时快速发展的基因组测序技术,对人类乳腺癌和结直肠癌进行的测序研究,而IDH1突变只出现在1例结直肠癌患者中,所以也就在论文附录露了个脸[2]。
不过两年之后,IDH1突变就真正走到了舞台中央:开展上一项测序研究的美国约翰·霍普金斯大学团队,把目标转向胶质母细胞瘤(GBM),利用全外显子组测序技术,在149例肿瘤样本中检出18例(12%)IDH1-R132位点突变[3]。

研究中检出的IDH1突变,多见于年轻、肿瘤为继发性的患者,且携带突变患者的中位总生存期(OS)达到3.8年,比IDH1野生型患者1.1年的中位OS好得多(HR=3.7, P<0.001)。这也就意味着,IDH1突变可能影响了癌症的疾病进程。
接下来的2009年,又有三项与IDH突变有关的重磅研究登上顶级期刊:继续钻研的约翰·霍普金斯大学团队发现,编码IDH1的同功异构酶——IDH2的基因,在部分癌症中也会突变;另一支美国团队则首次在AML中检出IDH1突变[4-5]。
(图片来源:NEJM)
而最后一项发表于《自然》的研究,则初步明确了IDH1/IDH2突变的促癌机制,明确了开发靶向治疗的必要性。从发现IDH突变到靶向治疗启动研发,不过用了短短三年,“一朝成名天下知”大概就是如此。
从供能到促癌,只是代谢的“一念之差”
前面奇点糕也提到,IDH1/IDH2酶正常情况下会参与人体能量代谢的核心途径——三羧酸循环。具体来说,这两种酶是三羧酸循环中的限速酶,参与异柠檬酸氧化脱羧产生α-酮戊二酸(α-KG),并将NADP+转化为NADPH的过程。
为了不让大家回忆起生化这门课程相关的痛苦记忆,奇点糕就用下面这张图取代冗长的文字说明吧……要说IDH1和IDH2的区别,主要就是前者位于细胞质内和过氧化物酶体中,而后者是在线粒体内,但它们的生理作用基本相同[6]。
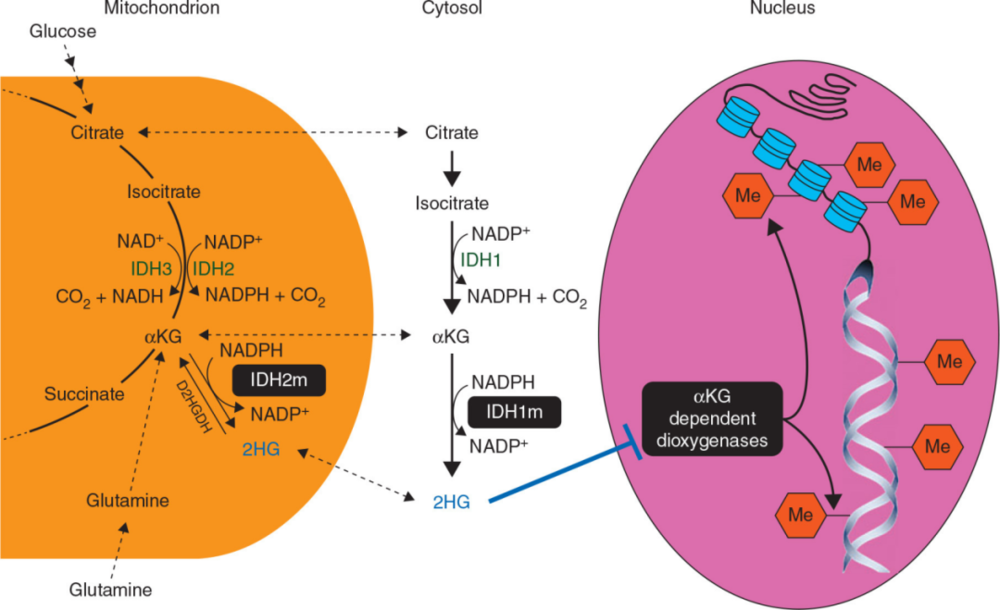
(图片来源:Annals of Oncology)
不过一旦发生功能获得性(Gain-of-Function)突变,例如IDH1典型的R132位点突变,那情况就完全不同了。如上图所示,IDH1/IDH2会进一步以α-KG为底物,催化生成大量的促癌代谢物(Oncometabolite)D-2-羟基戊二酸(D-2-HG)[7]。
D-2-HG在结构上与α-KG高度相似,因此二者之间存在“竞争性抑制”关系,当D-2-HG大量生成并累积时,它就会结合并抑制多种α-KG依赖性酶,从而介导组蛋白/DNA异常超甲基化、染色质重构等细胞表观遗传层面的显著异常。
此外,D-2-HG还可能通过阻断细胞分化,导致代谢重编程及线粒体功能异常,参与癌症的发生发展,其整体促癌机制非常复杂,至今仍未完全阐明[8]。近年来还有研究显示,D-2-HG可能导致了GBM等肿瘤的免疫微环境整体“偏冷”[9]。
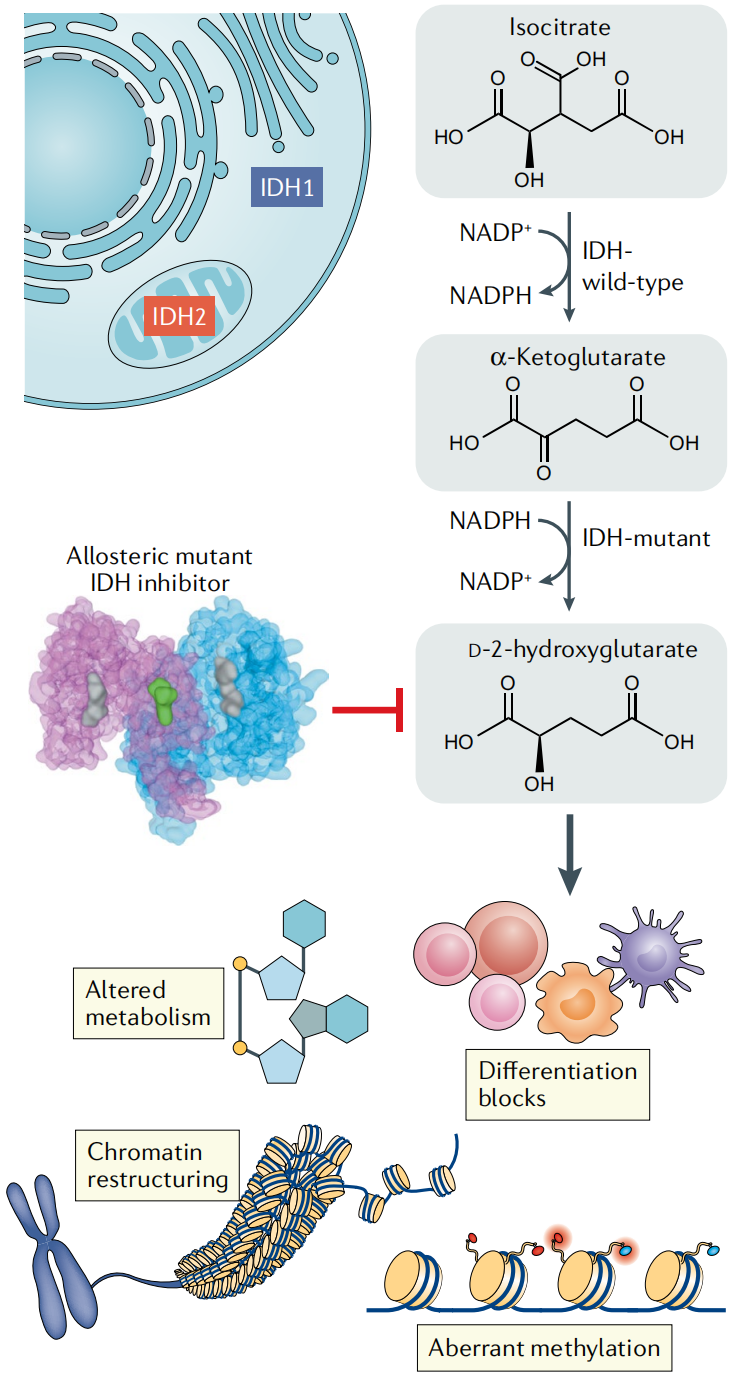
(图片来源:Nature Reviews Clinical Oncology)
总之,D-2-HG这个促癌代谢物不是什么好东西,往死里打就是了,而从源头针对因基因突变而功能异常的IDH1/2酶,理论上就能阻断D-2-HG的产生,也算是对着“病根”直接出招了。
而不断深入的研究发现,针对IDH突变开展靶向治疗,能够惠及的癌症类型还不止前面提到的GBM、AML两种,甚至可以说是专打“罕见癌症”了。
罕见癌症治疗的“破局利器”
自从IDH1/2突变的意义被明确后,全球各地就有大量研究,分析了它们在不同癌种中的突变频率,二代测序(NGS)技术更是大大推动了研究进度。但时至今日,各项研究的结论基本一致:IDH1/2突变及其集中出现的癌症,都不算常见。
例如2021年南京医科大学团队汇总了20种常见实体肿瘤、共2.8万余名患者的NGS测序结果,发现IDH1/2突变加在一起的发生率也只有1.3%,在肺癌、结直肠癌、肝癌、胃癌等实体肿瘤中的突变频率都只有0.5%-3%[10]。
在这项分析中,IDH1/2唯一突变频率超过5%的实体肿瘤,则是发病率较低的胆管癌,这也是较早被确认存在IDH1/2突变的瘤种,不同研究报告的突变频率约为3%-22%,突变多见于肝内胆管癌患者[11-12]。
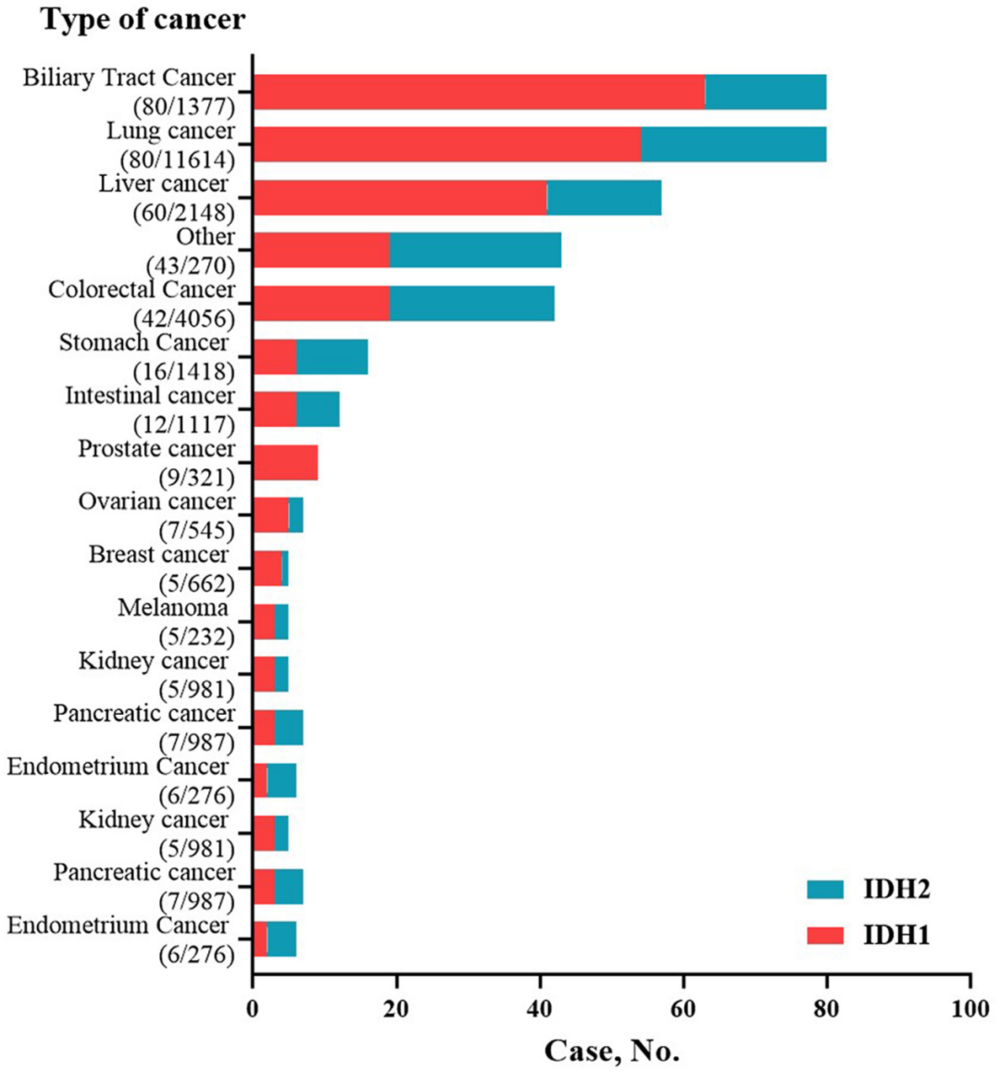
(图片来源:Molecular Genetics & Genomic Medicine)
在较早检出IDH1/2突变的AML中,IDH1/2的突变频率约为20%[13],且两种突变一般不会同时出现;而在胶质瘤方面,IDH1/2突变主要见于继发性GBM,以及少突胶质细胞瘤/星形细胞瘤等低级别恶性胶质瘤[14]。
此外在软骨肉瘤(38%-86%)、鼻窦未分化癌(SNUC, 49%-82%)、血管免疫母细胞性T细胞淋巴瘤(AITL, 20%-30%)等罕见肿瘤中,IDH1/2的突变频率也较高[8]。而且AML、胶质瘤、胆管癌及后面几种罕见小众肿瘤,都非常缺乏精准治疗手段。
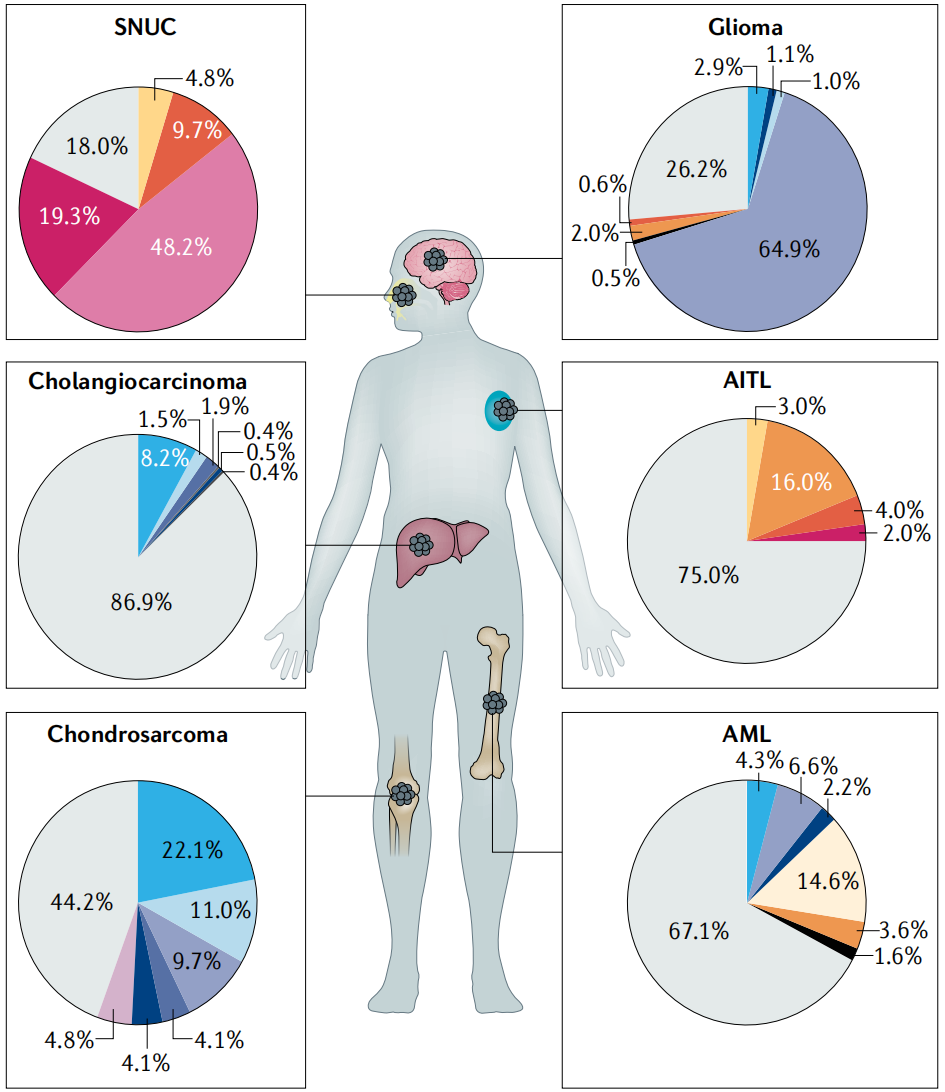
(图片来源:Nature Reviews Clinical Oncology)
进入21世纪第二个十年的癌症精准治疗,当然不能对这些患者迫切的治疗需求视而不见。已有多种靶向IDH1、IDH2的小分子抑制剂药物在国外获批,治疗AML和胆管癌,填补了多种癌症精准治疗手段的空白。
像奇点糕此前提到的艾伏尼布,作为全球首个获批的IDH1小分子抑制剂,最早于2018年7月获美国FDA批准,治疗复发或难治性AML;随后在2019年5月获批一线治疗≥75岁,或因合并共病无法耐受强化诱导治疗的AML患者。
中华医学会/中国临床肿瘤学会(CSCO)等国内AML相关指南也已推荐,对AML患者检测IDH1突变,提供靶向治疗机会。此外,艾伏尼布还在2021年8月获美国FDA批准治疗局部晚期或转移性胆管细胞癌,因此它已有胆管癌和AML两个瘤种的三项适应证。
艾伏尼布在不同瘤种、不同应用场景的临床研究还在不断推进之中,近期报告阳性结果的临床III期AGILE研究,就是它在治疗AML当中的又一次重要成功。
参考文献:
1.Khwaja A, Bjorkholm M, Gale R E, et al. Acute myeloid leukaemia[J]. Nature Reviews Disease Rrimers, 2016, 2(1): 1-22.
2.Sjöblom T, Jones S, Wood L D, et al. The consensus coding sequences of human breast and colorectal cancers[J]. Science, 2006, 314(5797): 268-274.
3.Parsons D W, Jones S, Zhang X, et al. An integrated genomic analysis of human glioblastoma multiforme[J]. Science, 2008, 321(5897): 1807-1812.
4.Yan H, Parsons D W, Jin G, et al. IDH1 and IDH2 mutations in gliomas[J]. The New England Journal of Medicine, 2009, 360(8): 765-773.
5.Mardis E R, Ding L, Dooling D J, et al. Recurring mutations found by sequencing an acute myeloid leukemia genome[J]. The New England Journal of Medicine, 2009, 361(11): 1058-1066.
6.Dang L, Yen K, Attar E C. IDH mutations in cancer and progress toward development of targeted therapeutics[J]. Annals of Oncology, 2016, 27(4): 599-608.
7.Dang L, White D W, Gross S, et al. Cancer-associated IDH1 mutations produce 2-hydroxyglutarate[J]. Nature, 2009, 462(7274): 739-744.
8.Pirozzi C J, Yan H. The implications of IDH mutations for cancer development and therapy[J]. Nature Reviews Clinical Oncology, 2021, 18: 645-661.
9.Du X, Hu H. The Roles of 2-Hydroxyglutarate[J]. Frontiers in Cell and Developmental Biology, 2021, 9: 486.
10.Shen D, Zhang J, Yuan K, et al. Landscape of IDH1/2 mutations in Chinese patients with solid tumors: A pan‐cancer analysis[J]. Molecular Genetics & Genomic Medicine, 2021: e1697.
11.Kipp B R, Voss J S, Kerr S E, et al. Isocitrate dehydrogenase 1 and 2 mutations in cholangiocarcinoma[J]. Human Pathology, 2012, 43(10): 1552-1558.
12.Kim N I, Noh M G, Kim J H, et al. Frequency and prognostic value of IDH mutations in Korean patients with cholangiocarcinoma[J]. Frontiers in Oncology, 2020, 10: 1514.
13.Duchmann M, Micol J B, Duployez N, et al. Prognostic significance of concurrent gene mutations in intensively treated patients with IDH-mutated AML: an ALFA study[J]. Blood, 2021, 137(20): 2827-2837.
14.Han S, Liu Y, Cai S J, et al. IDH mutation in glioma: molecular mechanisms and potential therapeutic targets[J]. British Journal of Cancer, 2020, 122(11): 1580-1589.
本文来自微信公众号:奇点网 (ID:geekheal_com),作者:谭硕

