本文来自微信公众号:奇点网(ID:geekheal_com),作者:李慢慢(中科院上海药物研究所药理学博士在读),原文标题:《〈科学〉:阿尔茨海默病重大突破!科学家首次看清人脑Aβ42结构,并发现体内结构与体外存在差异,实验室工作需革新丨科学大发现》,头图来自:视觉中国
阿尔茨海默病(AD)的药物研发一直十分困难,特别是以β淀粉样蛋白(Aβ)为靶点开发的药物,成功率极低。
那么原因是什么呢?药物研发使用的分子及动物模型与真实病理状态的差异可能是关键。
近期, Aβ的研究取得了新的进展,为AD药物研发带来了新的希望。
英国剑桥大学的Michel Goedert教授、Sjors Scheres教授、Benjamin Falcon教授联合美国印第安纳大学Bernardino Ghetti教授在《科学》杂志上发表了他们关于Aβ结构的最新研究结果[1]。
研究人员展示了人脑中Aβ42纤维的冷冻电镜(cryo-EM)结构。两种结构相关的S形原丝褶皱产生了两种类型的细丝。I型细丝主要在散发性阿尔茨海默病患者的大脑中发现,II型细丝则在家族性阿尔茨海默病患者和其他情况下发现。大脑中的Aβ42细丝的结构与体外组装的细丝不同。
这意味着,Aβ聚集抑制剂以及Aβ诊断试剂的研发出现了新的机遇。

阿尔茨海默病(AD)是一种常见的神经退行性疾病,主要表现为认知障碍和记忆损伤,可以分为家族型和散发型。AD患者脑内同时存在两种丝状淀粉样沉淀物,分别是Aβ蛋白斑块以及神经纤维缠结[2],其中Aβ的产生对AD的发病至关重要[3]。
在家族型AD患者体内,存在着Aβ前体蛋白APP基因和早老素PSEN1和PSEN2基因的突变。APP经过β分泌酶和γ分泌酶两步剪切形成Aβ,其中早老素与γ分泌酶有关。Aβ存在不同氨基酸数目的单体,主要包括Aβ40和Aβ42[4,5]。
不论是Aβ40还是Aβ42,都会发生进一步的聚集。由于疏水氨基酸的存在,Aβ单体互相聚集形成富含β-片层结构的寡聚体。Aβ寡聚体包括小的低聚物(二聚体和三聚体),中等大小的寡聚体(9聚体, 12聚体, Aβ衍生的可扩散配体等)和高分子量的寡聚体(原丝)[6]。淀粉样斑块中原丝或寡聚体间的疏水氨基酸进一步作用形成纤维(细丝),纤维堆叠在一起形成斑块。
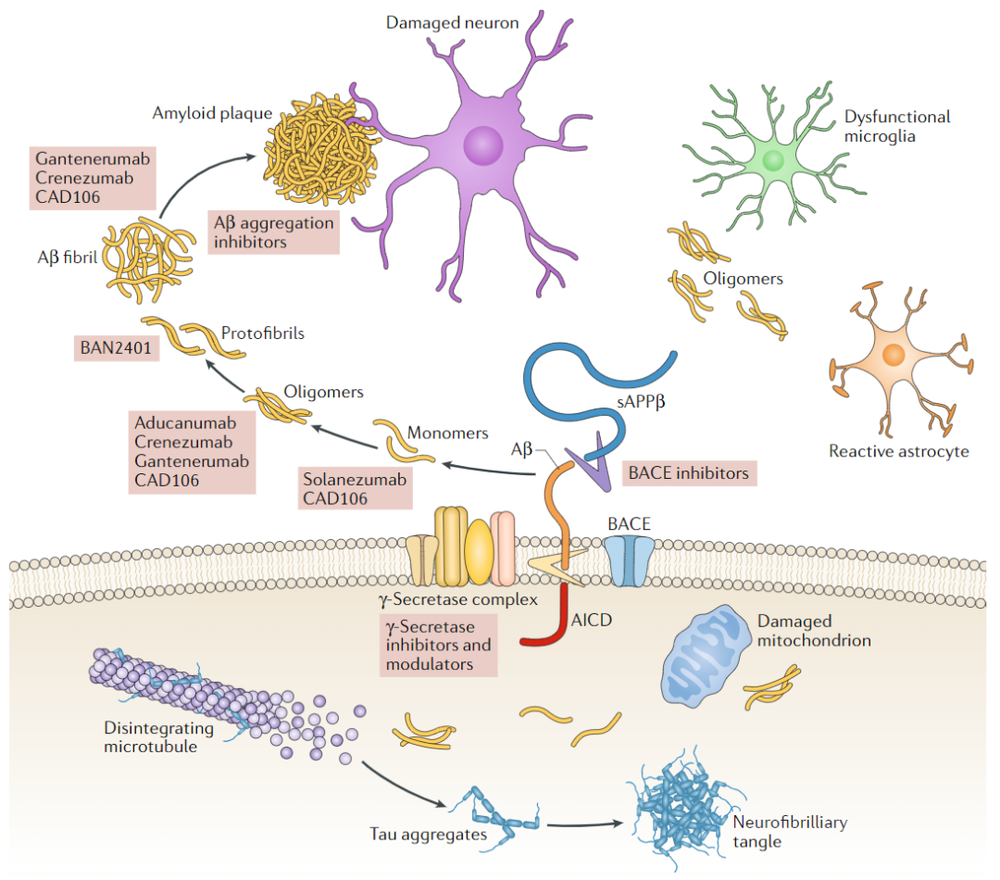
由于Aβ42C末端两个疏水氨基酸的存在,使得Aβ42比Aβ40更易聚集,而且更易形成寡聚体[7]。在AD的相关研究中,Aβ寡聚体与神经毒性更为相关[8],因此Aβ42相比Aβ40具有更大的神经毒性。
AD患者脑内Aβ的沉积主要可以分为三类,实质中的弥漫性沉积、局灶性沉积以及血管沉积。实质的沉积发生在不同的脑区,而冷冻电镜技术已经提供了来自AD患者淋巴管中Aβ40聚集体的结构[9],然而分散的斑块和致密核外部的细丝主要是Aβ42(尽管Aβ40产生的更多),但其结构仍未被阐明。
研究人员从10例尸检样本中提取Aβ42的细丝结构。10例样本中,有5名AD患者,其中3例散发型2例家族型;5名其他患者为1例Tau星形胶质细胞病变(ARTAG)、1例帕金森痴呆(PDD)、1例路易体痴呆(DLB)、1例额颞叶痴呆(FTD)以及1例病理衰老患者(PA)。
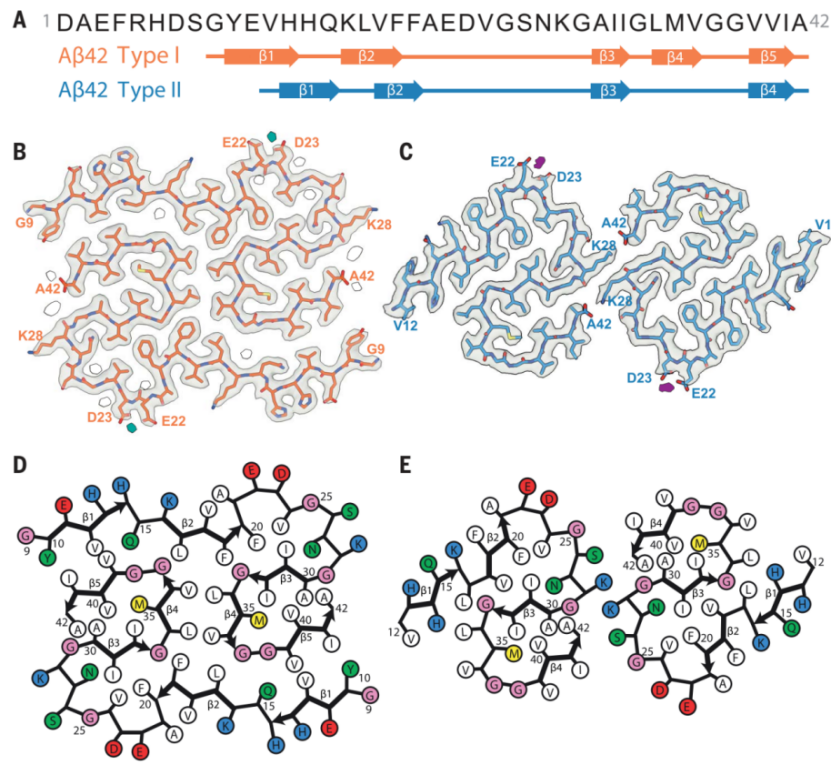
研究人员在散发型AD患者中观察到了I型丝,这种细丝由两条相同的S形原丝通过延伸的臂面对面拥抱组成,原丝的二级结构由5条β链组成,S形区域围绕两个疏水簇折叠。在家族性AD患者中,观察到了II型丝,其原丝界面较小,原丝界面主要由静电相互作用稳定。与AD患者淋巴管内Aβ的结构不同,不论是I型还是II型都具有左旋扭曲。
而与体外组装的Aβ42相比,尽管它们都含有一个或两个与I型或II型相似的S-形区域的原丝,但在侧链方向和原丝间组装上却不尽相同。
体外聚集对于研究淀粉样蛋白形成的分子机制至关重要。然而,现有的重组tau和α-突触核蛋白的组装方法产生的细丝结构与从人脑中提取的细丝不同。Aβ42细丝的情况似乎也是如此,它只部分地再现了人脑内的结构,与真实结构存在一定差异。
动物模型为研究阿尔茨海默病的分子机制提供了另一种工具。AppNL-F基因敲入小鼠表达人源化Aβ、携带瑞典双突变(KM670/671NL)以及App中的Beyreuther/Iberian突变(I716F)。该小鼠脑内会出现人类Aβ42的大量沉积、神经炎症和记忆障碍,而不需要过量表达APP。
为了进一步研究这种小鼠模型与人类疾病的相关性,研究人员从18个月大的同型AppNL-F小鼠的大脑中测定了Aβ42丝的低温电镜结构,该结构与家族型AD患者脑内Aβ细丝结构类似。构建和家族型AD类似的小鼠模型可以产生与家族型AD患者类似的细丝,但都与体外组装的结构不同,说明体外组装的蛋白可能缺少了体内组装的某个条件。
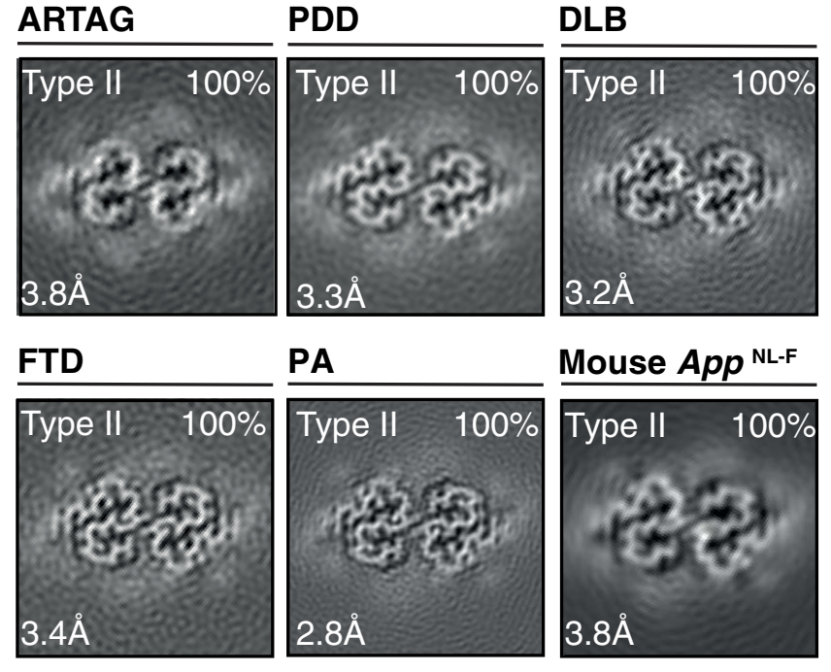
Aβ42的组装对AD的发生发展十分重要。研究人员发现,I型细丝主要在散发性阿尔茨海默病患者的大脑中发现,II型细丝则在家族性阿尔茨海默病患者和其他情况下发现。大脑中的Aβ42细丝的结构与体外组装的细丝不同。相比之下,在AppNL-F基因敲入的小鼠中,Aβ42沉积物是由II型细丝构成的。
通过上述研究可以发现:
1. 体外组装无法模拟体内环境,可能缺少体内组装所必需的某些条件;
2. 家族型,也就是出现APP或PS突变的类型会出现II型细丝,不论在AD患者还是在AD转基因小鼠中都是如此;
3. 散发型AD患者脑内的大部分I型丝会不会也对应着目前我们尚未发现的散发型AD的共性特征呢?仍然需要科学家们进一步研究。
参考资料:
[1] Yang Y, Arseni D, Zhang W, et al. Cryo-EM structures of amyloid-β 42 filaments from human brains. Science. 2022;375(6577):167-172. doi:10.1126/science.abm7285
[2] Long JM, Holtzman DM. Alzheimer Disease: An Update on Pathobiology and Treatment Strategies. Cell. 2019;179(2):312-339. doi:10.1016/j.cell.2019.09.001
[3] Hardy JA, Higgins GA. Alzheimer's disease: the amyloid cascade hypothesis. Science. 1992;256(5054):184-185. doi:10.1126/science.1566067
[4] Suzuki N, Cheung TT, Cai XD, et al. An increased percentage of long amyloid beta protein secreted by familial amyloid beta protein precursor (beta APP717) mutants. Science. 1994;264(5163):1336-1340. doi:10.1126/science.8191290
[5] Scheuner D, Eckman C, Jensen M, et al. Secreted amyloid beta-protein similar to that in the senile plaques of Alzheimer's disease is increased in vivo by the presenilin 1 and 2 and APP mutations linked to familial Alzheimer's disease. Nat Med. 1996;2(8):864-870. doi:10.1038/nm0896-864
[6] Yang T, Li S, Xu H, Walsh DM, Selkoe DJ. Large Soluble Oligomers of Amyloid β-Protein from Alzheimer Brain Are Far Less Neuroactive Than the Smaller Oligomers to Which They Dissociate. J Neurosci. 2017;37(1):152-163.
[7] Roher AE, Lowenson JD, Clarke S, et al. beta-Amyloid-(1-42) is a major component of cerebrovascular amyloid deposits: implications for the pathology of Alzheimer disease. Proc Natl Acad Sci U S A. 1993;90(22):10836-10840. doi:10.1073/pnas.90.22.10836
[8] Mc Donald JM, Savva GM, Brayne C, et al. The presence of sodium dodecyl sulphate-stable Abeta dimers is strongly associated with Alzheimer-type dementia. Brain. 2010;133(Pt 5):1328-1341. doi:10.1093/brain/awq065
[9] Kollmer M, Close W, Funk L, et al. Cryo-EM structure and polymorphism of Aβ amyloid fibrils purified from Alzheimer's brain tissue. Nat Commun. 2019;10(1):4760. Published 2019 Oct 29. doi:10.1038/s41467-019-12683-8
本文来自微信公众号:奇点网(ID:geekheal_com),作者:李慢慢(中科院上海药物研究所药理学博士在读),编辑:代丝雨

