本文来自微信公众号:奇点网(ID:geekheal_com),作者:奇点糕,编辑:BioTalker,原文标题:《《自然》子刊:让白色脂肪“弃暗投明”的关键找到了!科学家首次发现,线粒体蛋白OPA1能促进白色脂肪细胞自主褐化丨科学大发现》,头图来自:unsplash
脂肪组织代谢障碍与世界上流行的许多疾病相关,比如肥胖症、2型糖尿病、心血管疾病,还有某些肿瘤。作为内分泌系统的重要组成部分,脂肪组织能分泌许多关键激素,它的功能障碍也影响着远处的细胞和组织[1]。
在哺乳动物中,白色脂肪组织(WAT)储存能量,而棕色脂肪组织(BAT)通过解偶联蛋白1(Ucp1)介导的产热作用,将能量转化为热量。对于成年人来说,棕色脂肪可以抵抗肥胖和糖尿病。由于在人体中,BAT是稀缺的,科学家们就想到了将白色脂肪“褐化”,这成为了解决肥胖症和代谢疾病的一种可能的治疗策略。
线粒体是参与脂肪代谢的一个关键细胞器,在棕色脂肪能量消耗中起关键作用。电子传递链活性、脂肪酸氧化(FAO)缺陷、线粒体形态异常都与肥胖和代谢疾病有关,而线粒体内膜的线粒体融合蛋白OPA1在脂肪组织的作用尚不清楚[2]。
12月6日,来自意大利帕多瓦大学生物系的Luca Scorrano领衔团队在著名期刊《自然·代谢》发表重要研究成果。他们发现线粒体内膜的OPA1蛋白能促进脂肪细胞自主进行褐化,且这种促进作用是通过影响尿素循环产生的[3]。

在过去的工作中,研究人员通过遗传分析,发现在肥胖的发展中脂肪组织出现线粒体功能障碍[4]。然而,线粒体功能障碍是一个很广泛的概念,并不能仅由此就给体型偏瘦者与肥胖症患者脂肪组织的差异下定论。虽然一些研究发现了线粒体在脂肪组织中的重要性,但是并没有确切表明线粒体在肥胖中发挥了怎样的作用。
由于肥胖是由多种遗传因素和环境因素共同决定的,Luca Scorrano团队将同卵双胞胎作为研究对象,采取统一的方法测定肥胖症患者线粒体蛋白水平,来探究肥胖与脂肪组织OPA1表达的联系。他们研究了体重指数不一致的同卵双胞胎,观察调控线粒体形态学的关键因子是否存在差异,发现在体重较重双胞胎的皮下脂肪组织中,OPA1表达明显下调。
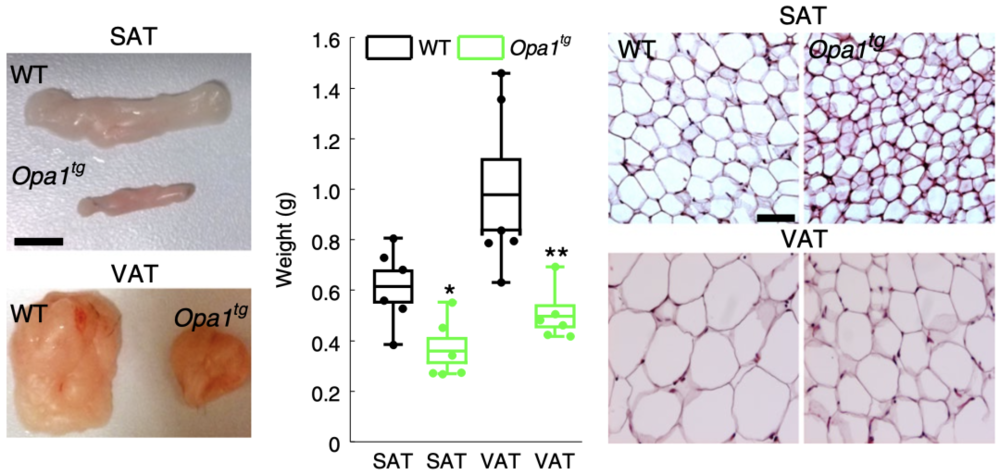
为了了解脂肪组织OPA1水平对脂肪组织的代谢有何影响,他们通过靶向转基因(Opa1tg)产生轻度OPA1过表达的小鼠模型,并分析其脂肪组织的代谢。他们发现,与WT小鼠相比,Opa1tg小鼠的皮下脂肪组织(SAT)、内脏脂肪组织(VAT)的大小和重量显著降低,脂肪细胞的大小也减小了;Opa1tg小鼠的糖耐量增高、胰岛素敏感性增加,且这种现象在高脂饮食喂养(HFD)小鼠中也能观察到。
那么是什么导致了Opa1tg小鼠脂肪组织代谢的改变呢?
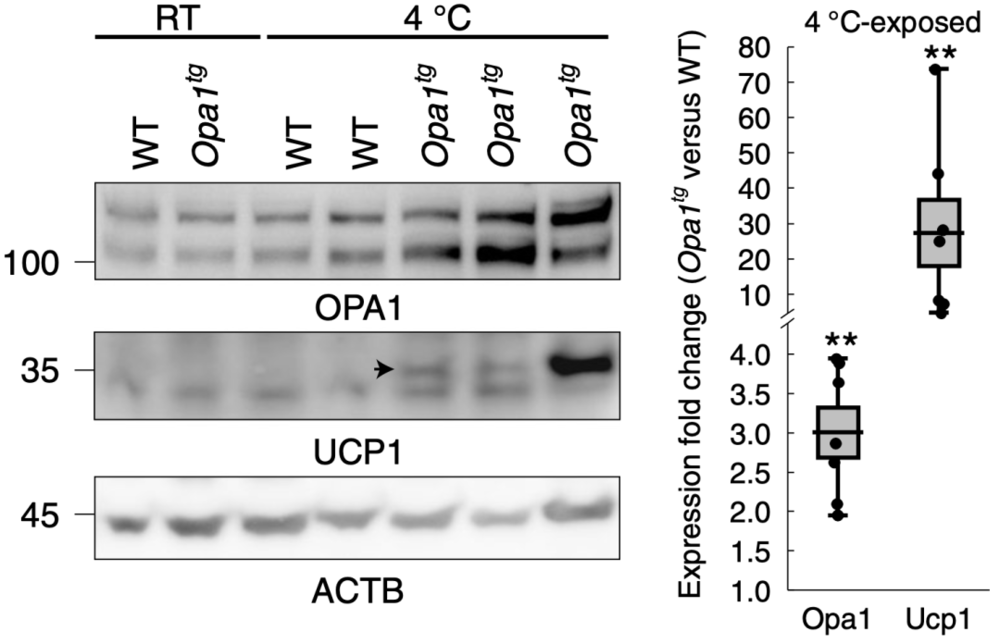
Luca Scorrano团队认为这归因于WAT的改变。他们观察到,HFD的Opa1tg小鼠皮下脂肪中Ucp1的表达高于同窝WT小鼠;而Ucp1是介导BAT产热的关键蛋白,这表明OPA1可能促进WAT褐化。
更深入的研究发现,与内脏脂肪组织相比,皮下脂肪组织中棕色脂肪组织标记基因和OPA1的表达更多;暴露于寒冷环境的小鼠皮下脂肪组织中检测到Ucp1的转录,且Opa1tg中Ucp1的转录量比WT小鼠增加了28倍。这些发现进一步表明OPA1促进WAT褐化,且OPA1水平与WAT褐化呈正相关。
为了了解OPA1促进WAT褐化的复杂机制,Luca Scorrano团队通过研究初级OPA1白色前脂肪细胞的分化,发现了Jumanji家族组去甲基化蛋白酶Kdm3a介导Ucp1转录的褐化途径。
随后的转录组学、代谢组学和前脂肪细胞中的代谢通量分析(MFA)表明,线粒体融合蛋白Opa1通过影响尿素循环和Kdm3a,进而促进WAT自主褐化。因此,Luca Scorrano团队提出:可以将脂肪组织的尿毒循环再激活,作为治疗肥胖症的一种策略。
不过,OPA1的这种功能是否基于线粒体融合还有待探索,但Luca Scorrano团队倾向于认为,OPA1功能是独立于其促线粒体融合功能的。因为其他线粒体融合基因未观察到与代谢健康相关,所以他们认为OPA1除了促进线粒体融合外,在线粒体生物学和代谢中还有独立的作用。
总的来说,这项研究首次探明了线粒体蛋白OPA1在白色脂肪褐化中的作用,并阐释了作用的机制。基于这一进展,也许能开发针对肥胖症和代谢疾病的新疗法,让我们拭目以待。
参考文献:
[1]Kershaw EE, Flier JS. Adipose tissue as an endocrine organ. J Clin Endocrinol Metab. 2004 Jun;89(6):2548-56. doi: 10.1210/jc.2004-0395. PMID: 15181022.
[2]Giacomello M, Pyakurel A, Glytsou C, Scorrano L. The cell biology of mitochondrial membrane dynamics. Nat Rev Mol Cell Biol. 2020 Apr;21(4):204-224. doi: 10.1038/s41580-020-0210-7. Epub 2020 Feb 18. PMID: 32071438.
[3]Bean C, Audano M, Varanita T, Favaretto F, Medaglia M, Gerdol M, Pernas L, Stasi F, Giacomello M, Herkenne S, Muniandy M, Heinonen S, Cazaly E, Ollikainen M, Milan G, Pallavicini A, Pietiläinen KH, Vettor R, Mitro N, Scorrano L. The mitochondrial protein Opa1 promotes adipocyte browning that is dependent on urea cycle metabolites. Nat Metab. 2021 Dec 6. doi: 10.1038/s42255-021-00497-2. Epub ahead of print. PMID: 34873337.
[4]Pietiläinen KH, Naukkarinen J, Rissanen A, Saharinen J, Ellonen P, Keränen H, Suomalainen A, Götz A, Suortti T, Yki-Järvinen H, Oresic M, Kaprio J, Peltonen L. Global transcript profiles of fat in monozygotic twins discordant for BMI: pathways behind acquired obesity. PLoS Med. 2008 Mar 11;5(3):e51. doi: 10.1371/journal.pmed.0050051. PMID: 18336063; PMCID: PMC2265758.
本文来自微信公众号:奇点网(ID:geekheal_com),作者:奇点糕

