本文来自微信公众号:奇点网(ID:geekheal_com),作者:颜轶群(浙江大学神经病学博士),原文标题:《〈自然〉子刊:抗衰老疫苗诞生!日本科学家开发可靶向清除衰老细胞的疫苗,能有效延缓小鼠的衰老过程丨科学大发现》,题图来自:视觉中国
人们对于生命短暂的叹息和对于长生不老的追求一直伴随在几千年的文明之中,由此应运而生的炼仙丹,炼金术,吸血鬼传说等都成为了传奇故事中无法被忘记的经典。随着我们对这个世界了解的不断深入,科学家又把目光转向了如何依靠科学延长寿命。
近日,《自然·衰老》杂志刊登了Tohru Minamino等人的最新力作,该研究发现了一种新的抗衰老疫苗,可以通过靶向清除体内的衰老细胞,可以更长效,更安全地改善衰老带来的代谢异常,减小动脉粥样硬化斑块,延缓正常衰老过程,将早衰小鼠平均寿命延长4周[1]。

打开文章之前,相信很多人都和我一样,不了解现在的抗衰老治疗领域发展到了什么阶段,咱们先花时间唠唠现在研究得如火如荼的Senolytic治疗。
Senolytic,是衰老seno和摧毁lytic两个词根的组合,起源于一种清除衰老细胞的思维。通过对衰老过程的研究,人们发现衰老是由于各个系统中出现了衰老细胞,这些细胞不光没有健康细胞的生理功能,还会传递“坏”的信息,带动整个器官走向下坡路,那我们选择性地清除掉这部分细胞,或许就可以阻止衰老的发生了。
这一概念的产生,最开始是由于科学家发现白血病化疗药达沙替尼,和一种植物提取物槲皮素可以选择性地清除体内的衰老细胞,于是把这两种药物联合口服用来延缓衰老,这就是大名鼎鼎的“D+Q”疗法[2],目前已进入二期临床阶段。
虽然药已经找到了,但其实人们还不是很了解衰老细胞的清除机制,知其然而不知其所以然,就很容易出问题。更何况,了解化疗药的朋友们都知道,化疗药物对正常细胞和器官功能是有损伤的,所以我们需要找到更安全更特异的药物。如果你是研究者,你会怎么思考呢?
首先,衰老细胞之所以能被特异性清除,一定是因为它们有自己特殊的标记。于是科学家们通过GEO数据库和KEGG数据库筛选出了10个在衰老细胞中高表达的跨细胞膜蛋白,并最终将目光锁定在了一个叫Gpnmb的蛋白上。
为什么要选择跨膜蛋白呢?因为他们的下一步计划,就是研发这个蛋白的疫苗,让免疫细胞替我们把表达Gpnmb蛋白的细胞都干掉。而免疫细胞发挥ADCC作用的关键,就是要识别异常细胞表面的抗原,所以需要选择跨膜蛋白来激活免疫反应。
作为我们忠诚可靠的打手,我们身体里的免疫细胞特异又高效,一下子就解决了靶向清除衰老细胞时特异性低和清除效率不高这两个问题。
为了证明疫苗的普适性,研究者们选择了四种不同的模型:动脉粥样硬化、高脂饮食、早衰症和自然衰老小鼠。并且使用这些模型证明了,衰老细胞中Gpnmb蛋白表达显著增高,而敲除GPNMB基因可以减轻疾病模型小鼠的疾病负担——有了这些证据,就可以研发疫苗啦~
研究人员选取了Gpnmb蛋白的胞外段一部分作为抗原制成疫苗,皮下注射到小鼠体内,成功在体内诱导出了针对衰老细胞的ADCC(抗体依赖的细胞介导的细胞毒作用)作用。疫苗的第一步已经成功了。接下来,就要验证这种靶向作用能不能减轻衰老。
研究者们选取了三个切入点:
第一,代谢异常。衰老细胞的显著特征之一,就是β-半乳糖苷酶表达升高,这一特征在高脂饮食小鼠中更加明显。
通过荧光素酶报告系统,研究者们发现90%的Gpnmb蛋白高表达细胞也会高表达β-半乳糖苷酶,而疫苗注射可以显著地清除这种细胞,而对低表达Gpnmb蛋白但高表达β-半乳糖苷酶的细胞没有清除效果。当抑制掉NK细胞和CD8+T细胞时,这种疫苗清除效果也消失了,说明疫苗的清除作用对这两种细胞的依赖性。
第二,老年性疾病。动脉粥样硬化是广为人知的老年疾病,发病率随年龄升高而增加。
研究者使用APOE敲除的小鼠,辅以高脂饮食作为动脉粥样硬化小鼠模型,发现Gpnmb疫苗治疗过后,小鼠粥样硬化斑块面积明显减小,细胞流式结果也显示体内β-半乳糖苷酶阳性细胞数量降低了。
第三,自然衰老。自然衰老是生命不可避免的终点,即使没有疾病,我们的身体机能也不可避免的降低。那么衰老疫苗能否改变这一自然规律呢?
研究者们对50周大的中年野生型小鼠进行了疫苗注射,并在70周时进行了运动能力评估,发现与对照组相比,疫苗注射小鼠平均运动速度和总运动距离都有明显提高。另外对Zmpste24敲除的早衰小鼠进行疫苗注射可以显著延长早衰小鼠的生存寿命。
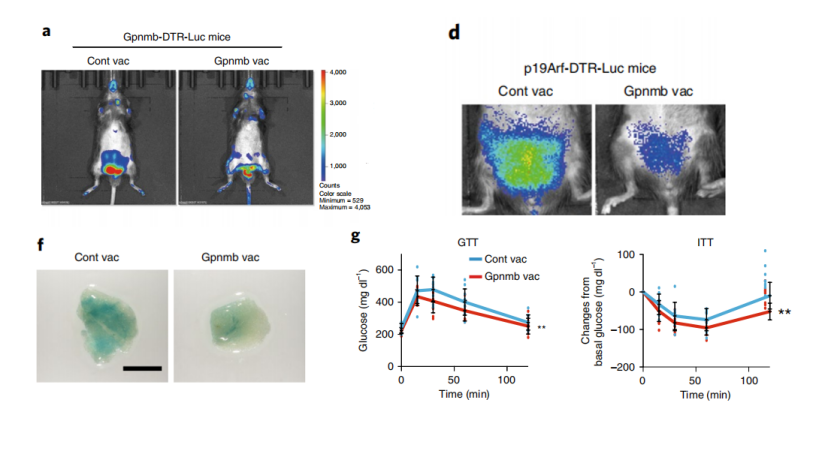
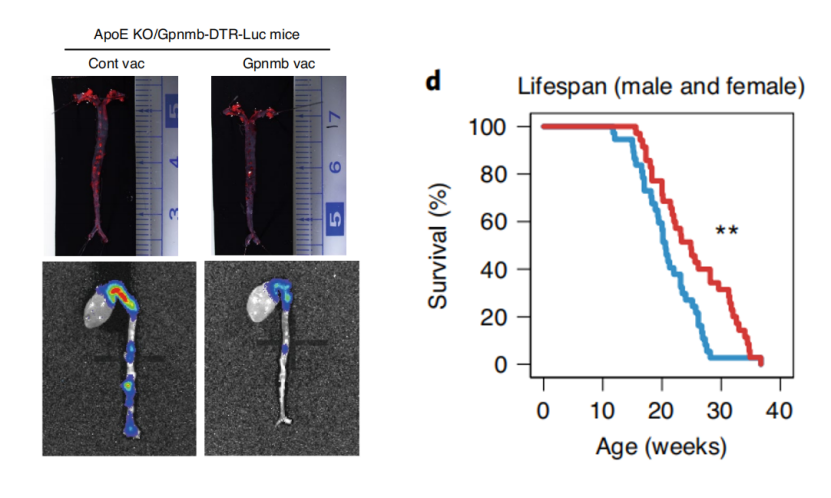
图示Gpnmb疫苗改善动脉粥样硬化(左),延长早衰小鼠寿命(右)
最后,研究者们向我们展示了他们的疫苗与其他药物对比的疗效。
前面提到了,“D+Q”是目前最普遍接受的抗衰老疗法,还有一种研究比较多的药物是Navitoclax(Bcl-2抑制剂)。本研究将Gpnmb疫苗与这两种药物都做了对比,发现Gpnmb疫苗药效更持久,且造成的贫血等副作用也更少。
与重大突破伴随而至的,常常是更多的未解之谜。目前已发现Gpnmb在成骨过程中发挥作用,且可以介导树突细胞的粘附作用,它在体内还有没有其他功能?衰老细胞为什么要高表达Gpnmb,有没有什么保护和传递信息的作用?疫苗除了能清除Gpnmb高表达细胞之外,难免也会清除掉一部分低表达Gpnmb的细胞,会不会有我们尚未发现的副作用?
总的来说,本篇研究在衰老的拼图中拼上了重要的一环。也为延缓衰老的研究打开了新的天地。与既往研究相比,针对衰老细胞的疫苗不仅更稳定,也更安全,很可能是未来Senolytic治疗的主流方向。
就我个人而言,每次感叹于抗衰老药物的神奇的同时,都还会保守的抱有怀疑。人类在漫长的进化中,摒弃了很多不适合生存的基因,留下了更有益于发展的基因,才构成了我们精妙协调的机体,真的会在基因组中留下“无用”的基因吗?我们身体里真的有可以清除不要的细胞种类吗?
长生不老,是人类长期的追求和美好的愿望,但我们离它还很遥远。我们目前还是要在有限的生命里绽放最大的价值,至于衰老疫苗将会走向何方,时间会给我们答案。
参考资料:
[1] Suda, M., Shimizu, I., Katsuumi, G. et al. Senolytic vaccination improves normal and pathological age-related phenotypes and increases lifespan in progeroid mice. Nat Aging (2021). https://doi.org/10.1038/s43587-021-00151-2
[2] Roos CM, Zhang B, Palmer AK, et al. Chronic senolytic treatment alleviates established vasomotor dysfunction in aged or atherosclerotic mice. Aging Cell. 2016;15(5):973-977. doi:10.1111/acel.12458
本文来自微信公众号:奇点网(ID:geekheal_com),作者:颜轶群(浙江大学神经病学博士)

