本文来自微信公众号:奇点网(ID:geekheal_com),作者:奇点糕,原文标题:《〈自然〉子刊:癌细胞转移前就把“黑手”伸进了淋巴管!科学家发现,黑色素瘤细胞会释放外泌体改造淋巴管,促进肿瘤转移丨科学大发现》,题图来自:视觉中国
随着认知拓展,科学家们发现肿瘤在我们体内根本不把自己当外人,就连免疫细胞也能策反过来给自己打造安乐窝。因此,大量研究将关注点转向肿瘤微环境,不再把思维局限于肿瘤细胞本身。
在2012年时,来自西班牙国家癌症研究中心(CNIO)的Héctor Peinado和他的团队发现,肿瘤细胞能够通过外泌体来传递信息给周围的微环境[1]。
7年后,Peinado和他的团队在《自然》子刊上发表的一篇文章提出,黑色素瘤细胞释放的外泌体到达淋巴结后,主要被淋巴管内皮细胞(LECs)吸收。这些外泌体通过分泌一种神经生长因子受体——NGFR来改变LECs的表型,增加淋巴管的分支,并加强对肿瘤细胞的粘附作用,从而促进肿瘤转移[2]。
并提出,NGFR可以作为黑色素瘤进展和早期诊断的重要生物标志物。

有“痣”者云:若色素痣长得不对称,边缘还参差不齐、界限不明,直径较大,颜色不均,那就要警惕黑色素瘤的可能性了!
我国黑色素瘤发病率为0.6/10万,主要危害中青年人,患者在确诊时大多已是中晚期。其中,晚期患者的5年生存率仅有4.6%。而且,美国人的黑色素瘤90%位于身体躯干部位,与紫外线照射密切相关;但咱们的黑色素瘤“有点自己想法”,41.8%的黑色素瘤原发部位为足底、足趾、手掌及甲下等肢端,这些位置紫外线都照不到,诱因尚不明确。
![黑色素瘤[3]<br>](https://i.aiapi.me/h/2021/12/11/Dec_11_2021_23_16_39_26266769418982960.png)
黑色素瘤早期“跑路”非常快,扩散的第一站就是淋巴结。已有研究证实,黑色素瘤可以诱导淋巴结组织改变,比如增强淋巴管生成、诱导免疫抑制环境等,从而在淋巴结形成转移前生态位(PMN)[4]。
这次Peinado和他的团队发现,外泌体就是那个黑色素瘤派到淋巴结的先遣兵。
他们选用了三种不同转移程度的黑色素瘤细胞系,构建小鼠模型,分别为:B16-F1(低转移水平)细胞系,B16-F10(高转移水平)细胞系,B16-F1R2(已发生淋巴结转移的B16-F1)细胞系。
结果发现,黑色素瘤转移水平高的小鼠,黑色素瘤细胞释放的外泌体分布更广泛,主要集中于腘窝淋巴结处,外泌体的聚集水平更高,积累速度也更快。而且,转移水平高的黑色素瘤细胞释放的外泌体能够增强肿瘤定植能力,促进黑色素瘤的自发转移。
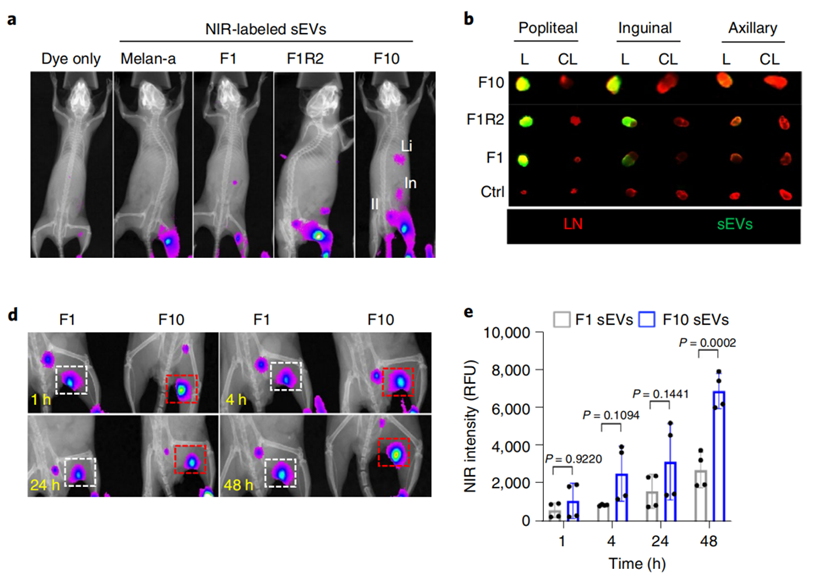
那么,这个先行一步到达淋巴结的先遣兵,为帮助黑色素瘤实现开疆扩土大计,都在淋巴结做了哪些准备呢?
研究者们发现,黑色素瘤细胞释放的外泌体主要是被淋巴结中的巨噬细胞和LECs所吸收。其中,和巨噬细胞相比,LECs的吸收速度更快,在短时间(4h)内就已经有89%的LECs吸收外泌体,而且吸收的数量也更多。
进一步对人源转移性黑色素瘤(SK-MEL-147)细胞系的分析结果表明,外泌体是对LECs的表型进行了一顿大改造。
一方面,外泌体会增强LECs对黑色素瘤细胞的粘附作用。
LECs在吸收外泌体后,ICAM-1表达上调。而ICAM-1已被证明有助于黑色素瘤细胞穿过LECs单层,发生肿瘤转移[5]。研究者们发现,一旦去除LECs中的ICAM-1,外泌体对LECs粘附作用的影响也就被消除。另外,其它一些与细胞粘附、细胞外基质重组等有关的蛋白和基因表达水平也发生上调,比如HLA-DRB1、TNC、EDIL3等。
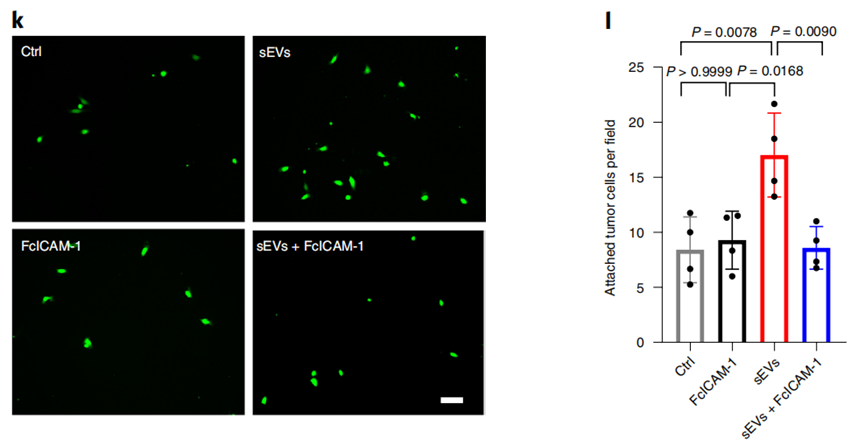
另一方面,外泌体还会促进LECs增殖,导致淋巴管分支增多,而淋巴管生成也正是肿瘤在转移到淋巴结前诱导免疫抑制环境的重要环节。
研究者们观察到, LECs在吸收外泌体的48h后,淋巴管生成和血管生成相关信号(LYVE1,VEGFC,VEGFR3等)发生富集。当用B16-F1R2细胞释放的外泌体处理LECs时,24h后LECs便可增殖达3.5倍。
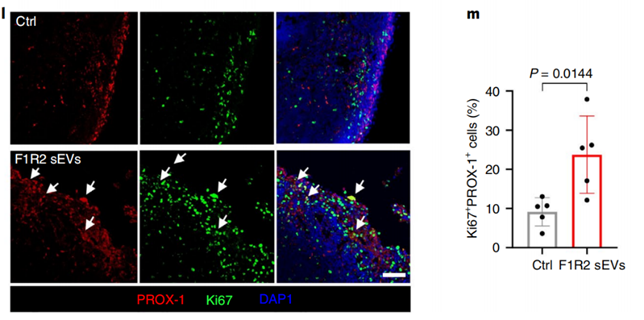
值得注意的是,已有研究证明淋巴结处的巨噬细胞会分泌淋巴管生成因子[6]。但在这里,并没有观察到巨噬细胞在吸收外泌体后,淋巴管生成因子水平有任何变化。反倒是发现,这些巨噬细胞有抑制淋巴管异常生长的作用。
也就是说,黑色素瘤细胞释放的外泌体会先行到达淋巴结处,在那里被LECs吸收后,便开始指挥LECs卖苦力,为黑色素瘤的转移打造适宜的微环境。
那么,外泌体又是如何“威胁”LECs为自己所用呢?
Peinado和他的团队首先想到NGFR。这是一种神经生长因子受体,已有研究发现,NGFR与黑色素瘤转移、角膜炎症过程中的淋巴管生成相关,而且NGFR在黑色素瘤细胞中的表达水平高于其他类型的肿瘤细胞[7-9]。
巧的是,一系列研究发现,外泌体不仅能够诱导LECs中Ngfr转录水平上调,还会在LECs中释放自己的NGFR,最终导致LECs内的NGFR总体水平上调。而且,只有高转移水平的黑色素瘤细胞释放的外泌体才含有NGFR,而在低转移水平的黑色素瘤细胞释放的外泌体中几乎没有NGFR。
通过CRISPR技术、蛋白质组学分析等技术,研究者们发现,黑色素瘤细胞中的NGFR水平降低后,所释放的外泌体中蛋白组分也发生变化,包括NGFR在内的126种蛋白质水平显著下调, 281种蛋白质水平显著上调。
进一步研究结果显示,由外泌体分泌的NGFR会诱导LECs中的MAPK和NF-κB通路,从而促进肿瘤细胞黏附和淋巴管生成。当用NFGR抑制剂 (THX-B)来治疗黑色素瘤小鼠时,小鼠的黑色素瘤转移情况得到缓解。
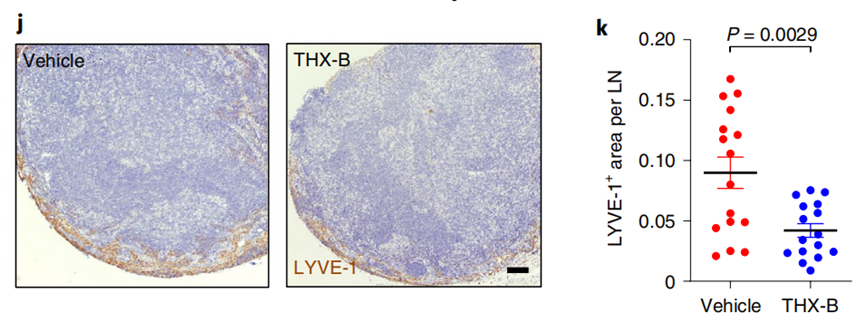
既然在小鼠中确定,外泌体中NGFR的表达和活性是关键一环,那对我们人类来说呢?
Peinado和他的团队通过对人类癌症基因组图谱(The Cancer Genome Atlas)的数据进行分析发现,与原发性黑色素瘤相比,NGFR表达水平在转移性黑色素瘤中显著增加。
这一点在III/IV期黑色素瘤患者的组织学分析中也得到了证实。组织活检结果显示,与原发肿瘤相比,已发生黑色素瘤转移的淋巴结组织中,NGFR表达水平更高。
研究者们还证实,淋巴结组织活检中NGFR+细胞的数量能够用来预测黑色素瘤患者的生存情况。
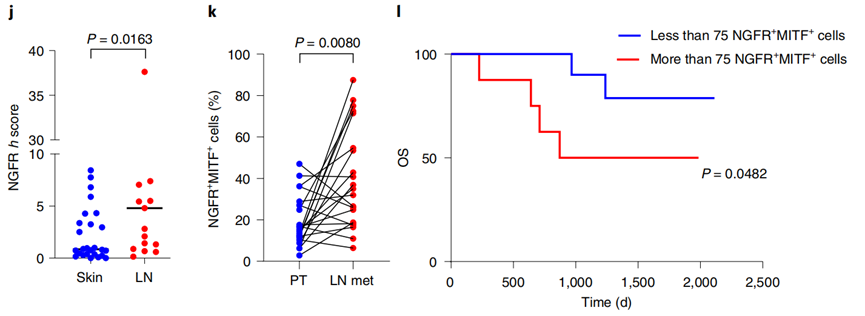
总的来说,Peinado和他的团队发现,黑色素瘤细胞能够释放携带有NGFR的外泌体到淋巴结,诱导淋巴管分支生成、增强淋巴管内皮细胞与黑色素瘤细胞的粘附作用,从而促进黑色素瘤的转移。
在本次研究中,研究者们不仅用NGFR 抑制剂 (THX-B)成功缓解了黑色素瘤小鼠的肿瘤转移情况,还在黑色素瘤患者中证实,NGFR可以作为黑色素瘤转移的有效预测靶点。这为对抗黑色素瘤转移的治疗提供了新策略。
参考文献:
[1]Peinado, H. et al. Melanoma exosomes educate bone marrow progenitor cells toward a pro-metastatic phenotype through MET. Nat. Med. 18, 883–891 (2012).
[2]García-Silva, S., Benito-Martín, A., Nogués, L. et al. Melanoma-derived small extracellular vesicles induce lymphangiogenesis and metastasis through an NGFR-dependent mechanism. Nat Cancer (2021). https://doi.org/10.1038/s43018-021-00272-y
[3]https://www.mayoclinic.org/diseases-conditions/melanoma/symptoms-causes/syc-20374884
[4]Sleeman, J. P. Te lymph node pre-metastatic niche. J. Mol. Med. 93, 1173–1184 (2015).
[5]Ghislin, S. et al. LFA-1 and ICAM-1 expression induced during melanoma–endothelial cell co-culture favors the transendothelial migration of melanoma cell lines in vitro. BMC Cancer 12, 455 (2012).
[6]Sun, B. et al. Colorectal cancer exosomes induce lymphatic network remodeling in lymph nodes. Int. J. Cancer 145, 1648–1659 (2019).
[7]Boiko, A. D. et al. Human melanoma-initiating cells express neural crest nerve growth factor receptor CD271. Nature 466, 133–137 (2010).
[8]Restivo, G. et al. Te low neurotrophin receptor CD271 regulates phenotype
switching in melanoma. Nat. Commun. 8, 1988 (2017).
[9]Civenni, G. et al. Human CD271-positive melanoma stem cells associated with metastasis establish tumor heterogeneity and long-term growth. Cancer Res. 71, 3098–3109 (2011).
本文来自微信公众号:奇点网(ID:geekheal_com),作者:奇点糕

