本文来自微信公众号:奇点网(ID:geekheal_com),作者:代丝雨,原文标题:《〈细胞〉子刊:饿了肚子,强了药效!科学家发现模拟禁食可抑制三阴性乳腺癌干细胞,并可增强靶向药疗效丨科学大发现》,头图来源:视觉中国
对抗癌细胞的大路四通八达,其中一条就是“饿死”癌细胞。
不过,这里的“饿死”指的其实是特异性阻断癌细胞获取营养物质,让它们无法茁壮生长。而近些年来的一些研究表明,在饮食上做出一些限制,真的“饿肚子”,也能够发挥协助抗癌的效果。
尤其值得一提的,就是限制热量为标准饮食50%以下,以低水平碳水化合物和蛋白质、相对较高脂肪为特征的模拟禁食饮食(FMD)了。在之前的研究中,科学家们已经发现FMD诱导的细胞因子水平变化,可以参与调节细胞保护相关基因,起到延缓肿瘤进展的效果[1]。
近期,一项发表在《细胞代谢》杂志上的新成果说明了FMD限制肿瘤进展的详细机制[2]。原来,FMD可通过降低葡萄糖水平和蛋白激酶A(PKA)信号传导抑制三阴性乳腺癌(TNBC)干细胞,且能够在分化癌细胞中激活多种可被药物靶向的通路,也就是说FMD可以有效增强相关靶向药物的疗效。

研究者分别在体外和小鼠体内进行了实验,体外使用低血清、低葡萄糖(STS)来模拟FMD;而小鼠采用特殊的FMD饮食,每周执行4天,第1天卡路里为正常饮食的50%,2~4天为正常饮食的10%。
实验结果发现,STS能够减少TNBC SUM159癌细胞球的形成;在体内,FMD也能够减少TNBC的细胞更新频率,延缓癌症进展。进一步分析发现,FMD增加了肿瘤内Caspase3的表达,这意味着癌细胞凋亡增加了。
这种作用可以说和FMD带来的血糖降低是密不可分的。当研究者向FMD小鼠的饮用水中增加3%的葡萄糖,就可以部分逆转FMD诱导的肿瘤抑制作用,这和体外实验的结果也是一致的。进一步分析则发现,背后的机制是葡萄糖减少导致的PKA途径抑制。
也就是说,FMD通过降低葡萄糖水平和抑制PKA减少了TNBC干细胞。
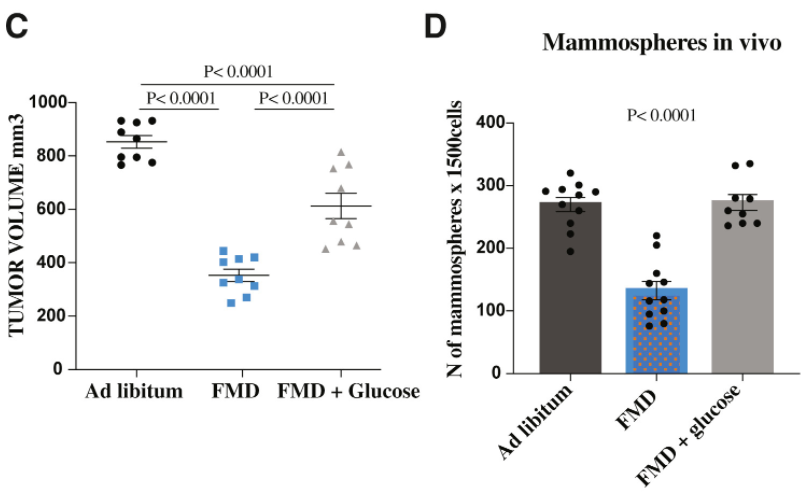 补充葡萄糖可部分逆转FMD的抗肿瘤效果
补充葡萄糖可部分逆转FMD的抗肿瘤效果
转移是TNBC患者死亡的主要原因,所以研究者还观察了FMD对转移是否有效。实验结果显示,FMD以及糖酵解酶己糖激酶抑制剂2DG,都能够有效减少小鼠中TNBC的转移,FMD+2DG的抗转移效果甚至更好。
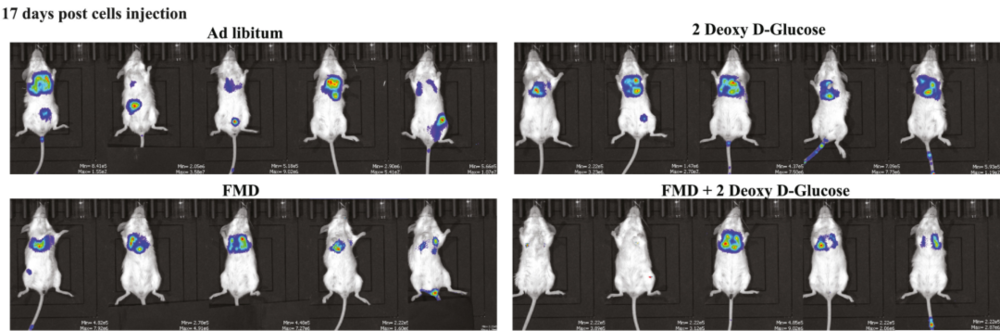
这种效果在人类患者的数据集中也能够得到一定的验证。
研究者们分析了一组接受铂类化疗的晚期TNBC患者的回顾性队列,发现与基线血糖水平低于100mg/dL的正常血糖患者相比,高血糖患者的总生存期(OS)显著更短。以110mg/dL作为分组标准,相关性依旧存在。
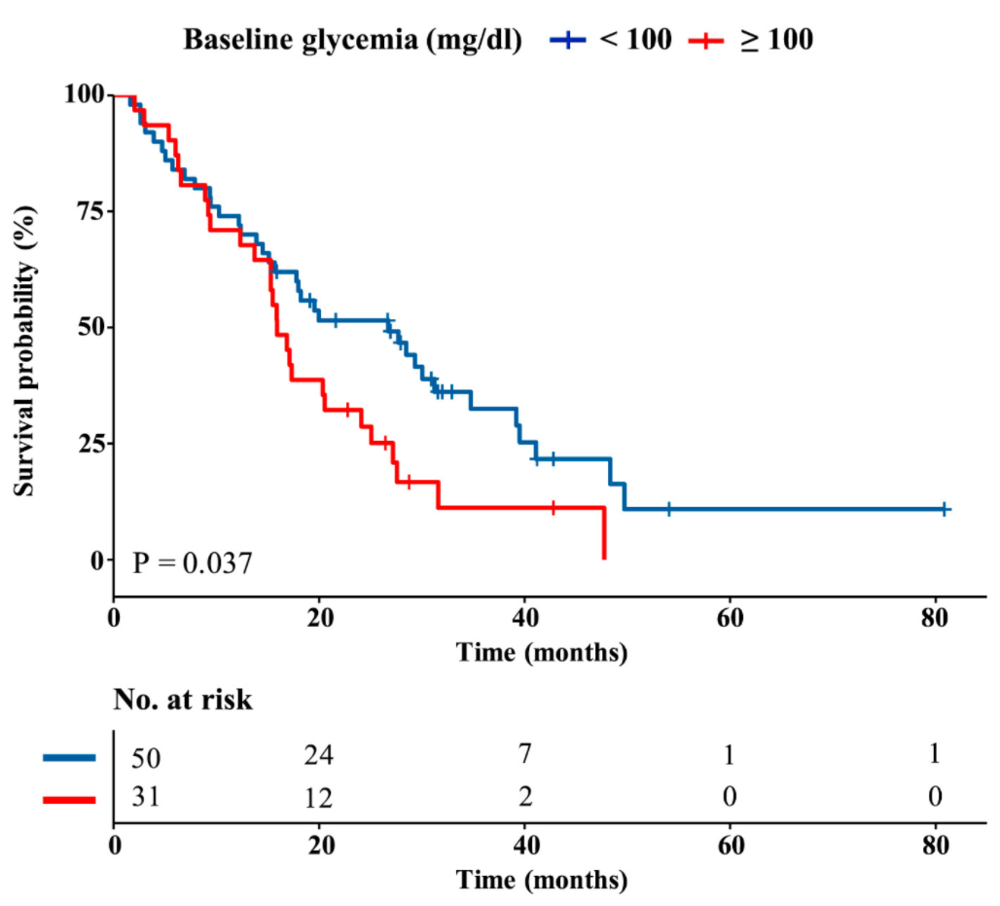
不过,在之前的研究中,单独的FMD虽然能够消耗癌干细胞,但只能延缓肿瘤生长,对无进展生存期的改善却很有限。是不是还有些可以改进的地方呢?
研究者们对FMD动物的癌细胞进行了RNA测序,有了一些有趣的发现。除了一些促凋亡分子水平的变化,FMD还上调了PI3K-AKT途径和mTOR途径,而且这些现象只发生在分化的细胞中,而不发生在癌干细胞中。
这可是个绝妙的发现,因为PI3K、AKT、mTOR,咱们都有现成的药呀!
研究者在小鼠中测试了PI3K抑制剂pictilisib、AKT抑制剂ipatasertib和mTOR抑制剂雷帕霉素的效果,发现FMD能够显著改善这些抑制剂的抗肿瘤活性,而且将三种药物联用再加FMD,能够得到最好的效果,有85%的小鼠PFS超过了150天。
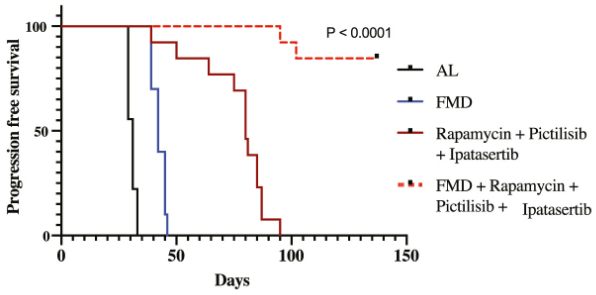
另外,由于这些途径的上调只发生在分化细胞中,而FMD能够对癌干细胞产生抑制,因此研究者们还尝试了FMD与FMD+靶向药的序贯治疗,发现FMD能够显著减少后期出现耐药性的可能,可以更好地实现肿瘤抑制。
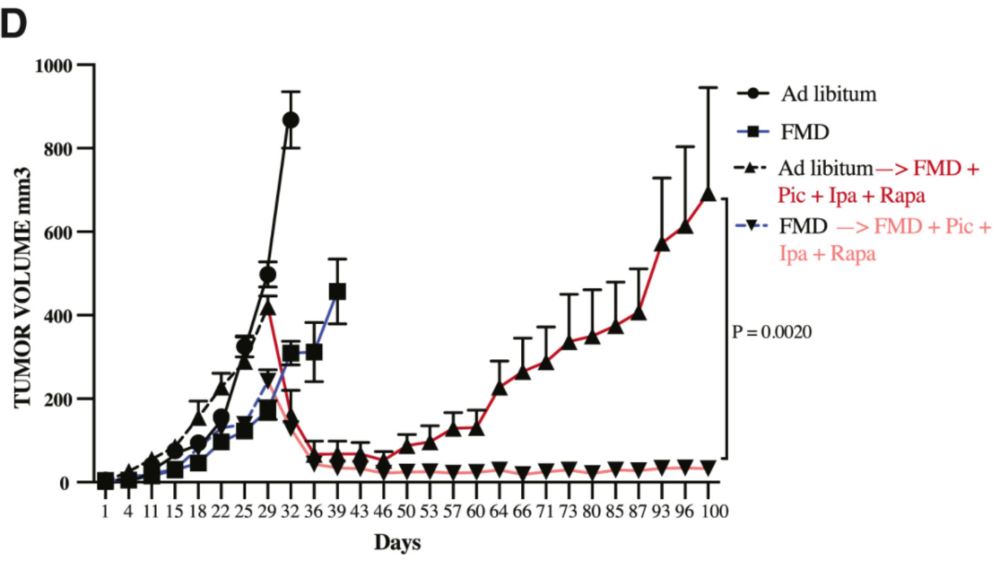
不过这毕竟还只是临床前研究,至少FMD给小鼠和人类带来的血糖降低效果就有很大差异。对临床研究的分析显示,人类执行5天FMD,血糖可下降大约15%,而在小鼠中则会降低40%左右。而癌症患者是否能够承受得住“饿肚子”,也是需要考虑的问题。
希望对机制的探索,能够找到更好的治疗方法吧。
参考资料:
[1]Di Biase, Stefano, et al. "Fasting-mimicking diet reduces HO-1 to promote T cell-mediated tumor cytotoxicity." Cancer cell 30.1 (2016): 136-146.
[2]https://www.cell.com/cell-metabolism/fulltext/S1550-4131(21)00486-1?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS1550413121004861%3Fshowall%3Dtrue#%20
本文来自微信公众号:奇点网(ID:geekheal_com),作者:代丝雨

