本文来自微信公众号:奇点网(ID:geekheal_com),作者:奇点糕,原文标题:《《柳叶刀·肿瘤学》:HPV疫苗,一针或许就行!科学研究发现,一针四价HPV疫苗,10年内抗高危HPV感染效力媲美两针和三针》,题图来自:视觉中国
前一阵,奇点糕朋友的亲戚因为宫颈癌去世了,与上次听到确诊噩耗不过几个月的时间。奇点糕不禁感概,阿姨年轻时要是有人乳头瘤病毒(HPV)疫苗这种防癌神器该多好。
为了减少类似悲剧的发生,奇点糕呼吁所有符合条件的朋友们尽早接种HPV疫苗!当前市面上有二价、四价和九价HPV疫苗,价数越高,针对的HPV基因型越多,保护越全面。

这些疫苗常规都要打三针,对宫颈癌的保护效力高达70%-90%。但有大量女性因为负担不起接种费用而得不到这样高效的保护。据WHO估计,2019年全球HPV疫苗覆盖率仅为15%[1]。中低收入国家的疫苗供需矛盾尤为突出,其中约三分之二的国家无法将HPV疫苗纳入其国家免疫计划[2]。
令人欣慰的是,近日,柳叶刀子刊Lancet Oncology刊出了一篇有望缓解HPV疫苗供应危机的研究。国际癌症研究机构Partha Basu教授领衔的研究团队指出,接种后近10年内,单剂四价HPV疫苗对高危型HPV16和HPV18(近70%宫颈癌由其所致)持续感染提供的保护效果与两或三剂四价苗相当,效力分别为95.4%、93.1%和93.3%[3]。
也就是说,无法负担三针或两针HPV疫苗费用的女性退而求其次,只打一针四价苗,或许也能得到很好的保护。

通常很少有人会在应该打三针疫苗的情况下只打一针。之所以能够进行这项研究,还要从一份叫停接种的通知说起。
2009年9月1日,研究人员开始在印度的9个地区募集10-18岁未婚女性参加一项旨在比较两剂和三剂四价HPV疫苗(美国默沙东公司生产)保护效力的整群随机对照试验。
研究原计划募集两万名女性,但在募集、接种进入尾声的时候,另一项HPV疫苗试验报告了7例与疫苗无关的死亡[4]。出于安全考虑,印度政府叫停了所有相关研究。此时,一部分受试者只打了一针,还有一部分受试者本该打三针但只打了两针。
暂停接种后,这项临床试验自动转化为纵向队列研究,并按照实际接种情况重新分为4组:三针组(4348人;第0天,60天,180+天接种),原两针组(4980人;第0天,180+天接种),三针转两针组(3452人;第0天,60+天接种)和一针组(4949人)。
为研究疫苗的保护效力,研究人员还分别在2013-2015年(1541人)和2017-2019年(3631人)募集了两批年龄、居住地与上述研究对象匹配,但没有打过HPV疫苗的已婚女性作为对照。
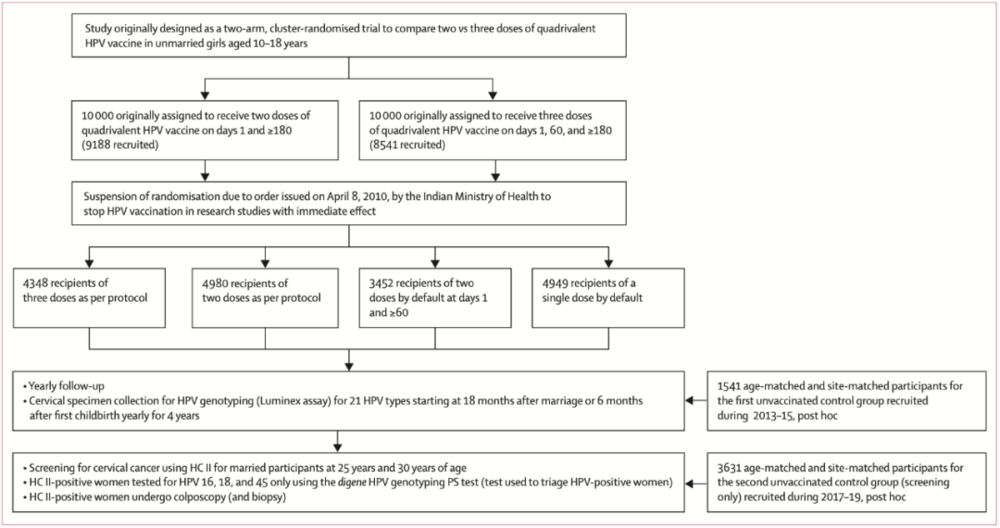
每年跟踪调查研究对象的HPV疫苗再接种情况和患病情况,随访将一直持续到2026年8月。此外,在研究对象婚后18个月或首次分娩后6个月(以较早者为准)采集第1份宫颈标本,之后3年每年采集1份,用Luminex检测21种HPV基因型(高危型HPV16,18,26,31,33,35,39,45,51,52,53,56,58,59,66,68a,68b,70,73,82;低危型HPV6和HPV11),以评估HPV感染情况。其中第4年新发感染HPV的研究对象下一年需复查一次。
对年满25岁的已婚研究对象用HC2技术进行宫颈癌筛查。筛查阳性者进一步采用digene PS检测确定感染分型(HPV16,18,45),同时进行阴道镜检查,评分≥5分的做活检,<5分的下一年复查HC2。
2013-2015年的对照人群既进行HPV感染检查又进行宫颈癌筛查,2017-2019年的对照人群只进行宫颈癌筛查。为保证结果的客观性,所有参与检测和检查的医务人员都不知道研究对象的疫苗接种状态。
研究的主要终点是HPV16,HPV18或这两者(以下简写为HPV16/18)的持续感染(连续两次检查均为阳性且两次检查至少间隔10个月),次要终点是HPV16/18的单次感染和HPV16/18相关的二级及以上宫颈上皮内瘤变(CIN2+)。其他探索性结局指标包括HPV6/ HPV11,HPV31/HPV33/HPV45或其他基因型的单次或持续感染。
根据感染情况可以计算出HPV疫苗的保护效力(1-接种者HPV感染率/未接种者HPV感染率)。
总的来看,共有17729名女性接种了HPV疫苗,其中61.6%的人进行了HPV基因型检测。平均随访9.0年后,接种者的HPV16/18单次感染率为3.1%(95% CI: 2.8%-3.5%),显著低于未接种者(9.4% [95% CI: 7.9%-11.0%])。一针组的单次感染率(3.2%)与三针组(3.0%)和两针组(2.7%和3.6%)相近。
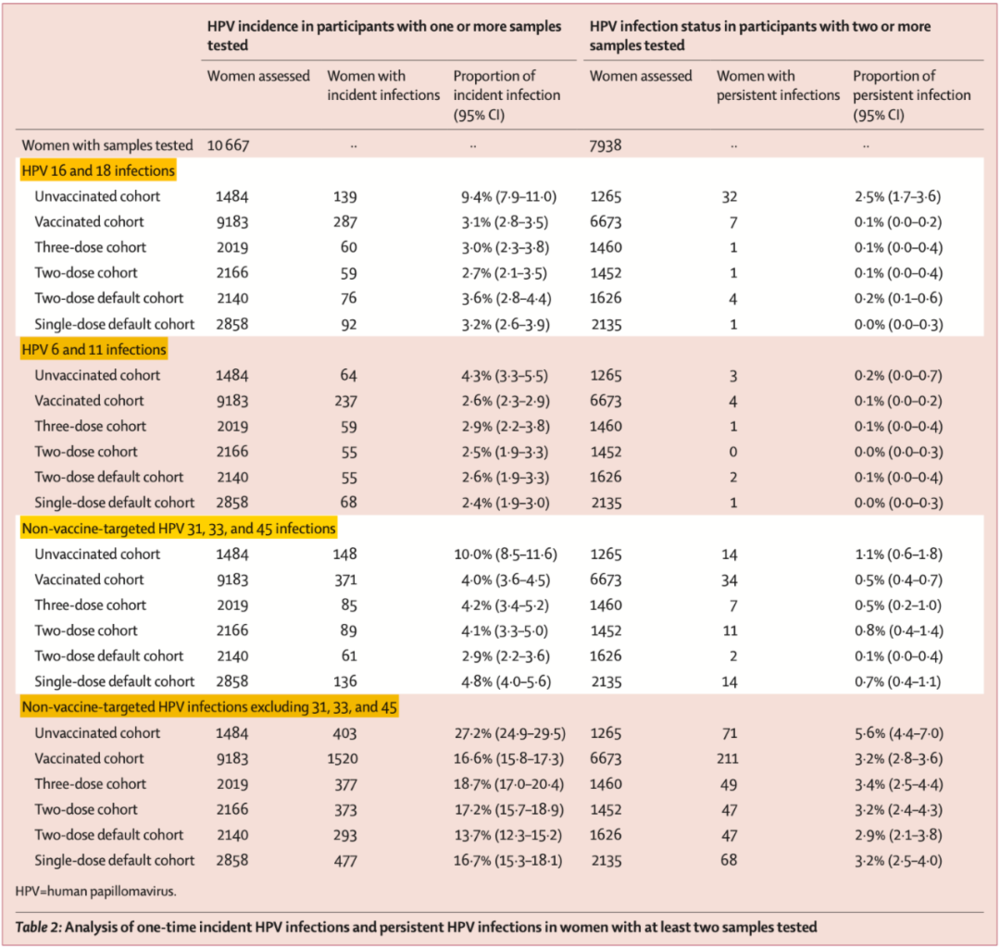
约72.7%(6673)的研究对象至少提供了2次感染评估结果,可判定HPV的持续感染情况。接种者的HPV16/18持续感染率为0.1%(95% CI: 0.0%-0.2%),显著低于未接种者(2.5% [95% CI: 1.7%-3.6%])。一针组的持续感染率(0.0%)与三针组(0.1%)和两针组(0.1%和0.2%)相近。
四价苗虽不覆盖HPV31,33和45,但对这三种基因型有一定的交叉保护作用。研究结果显示,疫苗接种者(4.0%)中这三种基因型的单次感染率低于未接种者(10.0%),不同针剂组的单次感染率没有显著差异,持续感染结果亦然。对于四价苗靶向基因型(HPV6,11,16,18)和交叉保护基因型(HPV31,33,45)以外的基因型,规律相同。
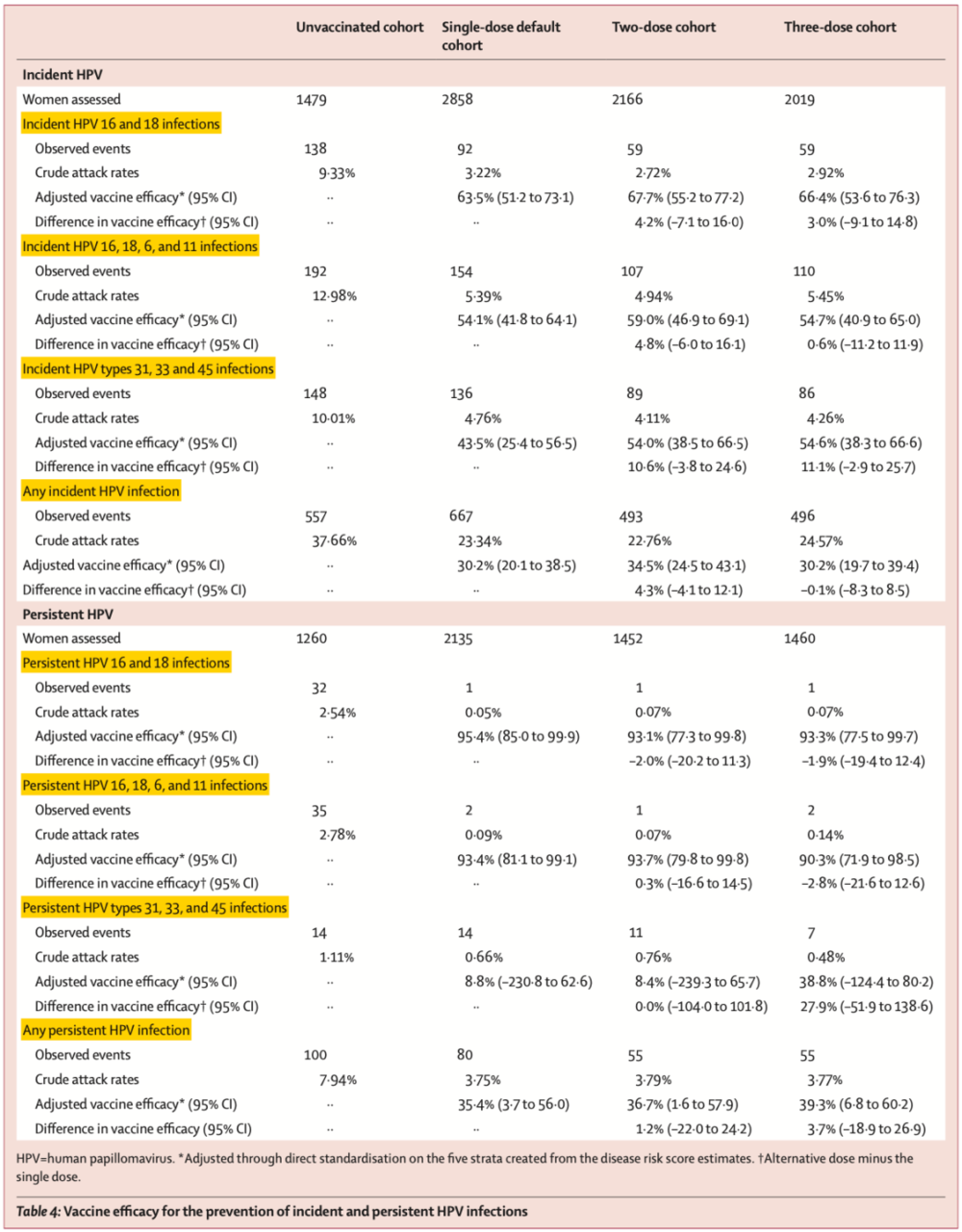
除了感染率,研究人员还比较了各组的疫苗保护效力,结果发现只打一针时预防HPV16/18单次感染的效力为63.5%,和打两针(67.7%)、三针(66.4%)的效力没有显著差异。各针剂组对交叉保护基因型和21种基因型单次感染的保护效力也没有显著差异。
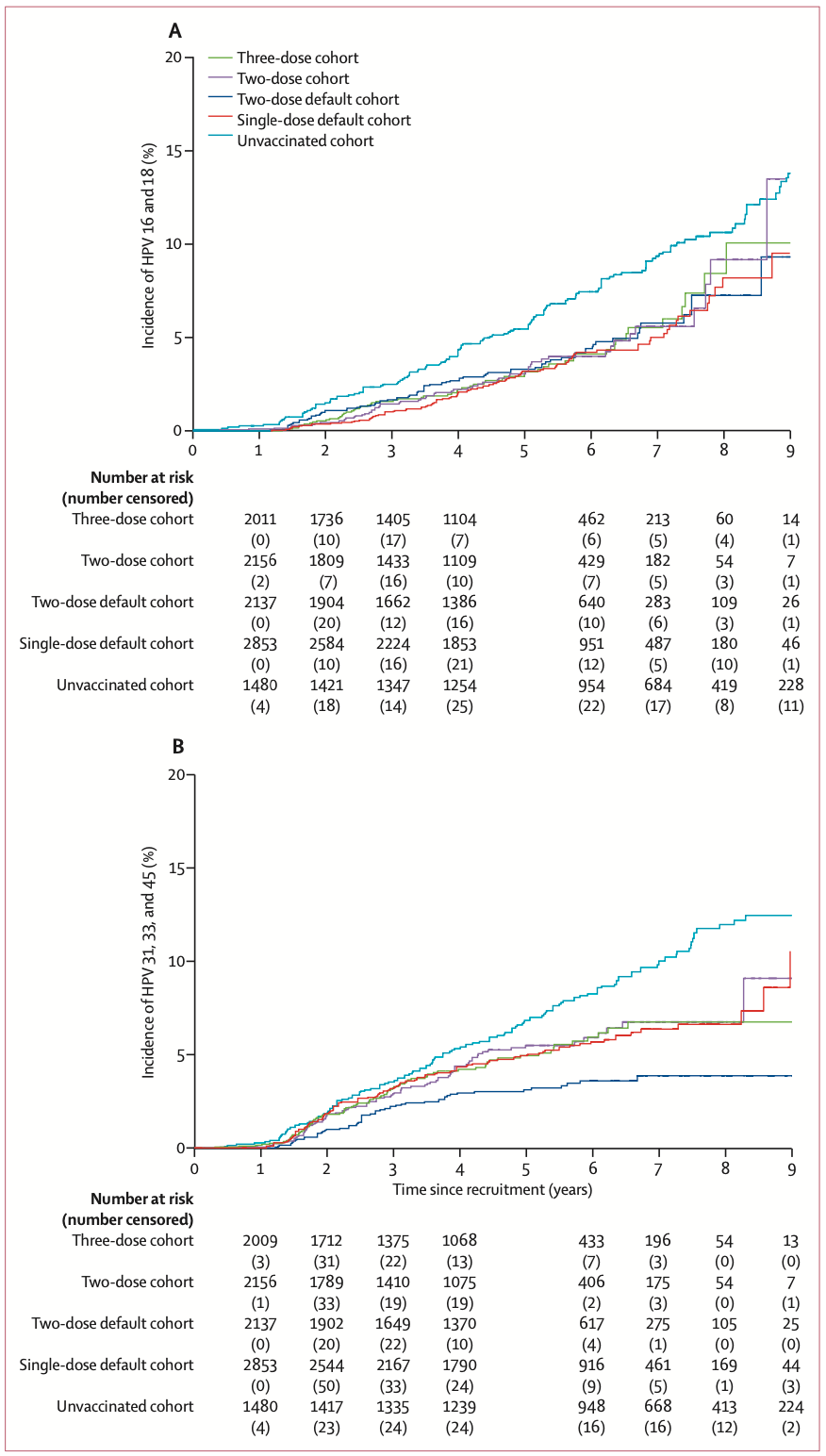
打一针、两针、三针预防HPV16/18持续感染的效力分别为95.4%、93.1%和93.3%,对预防21种基因型持续感染的效力分别为35.4%、36.7%和39.3%。
疫苗接种者和未接种者中宫颈癌筛查阳性的比例分别为4.1%和6.0%。研究只在接种一针的研究对象中发现1例CIN3患者,她的Luminex和digene PS检测结果均为阴性。接种者中未发现CIN2或浸润癌,未接种者中发现5例CIN2或CIN3患者,其中3例与HPV16/18感染有关,1例浸润癌与HPV16/18感染无关。
除了疫苗保护效力,另一个大家比较关心的问题是疫苗提供保护的持久性。虽然该研究没有相关数据,但是另一项研究显示,单剂接种者的抗体浓度在接种后的18-24个月内趋于稳定,并在至少10年内保持高于自然感染后的抗体水平[5,6]。
在一些把HPV疫苗纳入免疫计划的国家,单剂疫苗在预防HPV感染、肛门-生殖器疣、CIN2+病变方面表现出了和多剂疫苗相当的效力,与该研究结论一致[7-11]。
当然,该研究不可避免存在一些局限,例如,失去临床试验随机分组的特性后,各组不一定完全可比;对于非四价苗靶向非交叉保护的基因型,理想情况下,接种组和未接种组的感染率应该差不多才对,现在前者低于后者,提示未接种组的选择可能不是那么完美,未能和接种组完全匹配。
在中低收入国家,仍有非常多女性打不起HPV疫苗,加上新冠导致的医疗资源倾斜,HPV疫苗覆盖问题更是雪上加霜[12]。一项预印本模型研究结果表明,即使单剂HPV疫苗效力稍差,只要覆盖率高,也能在人群层面上产生比两剂疫苗更高的健康收益[13]。通过高覆盖率产生的群体免疫有可能弥补一些个人层面上单剂疫苗保护力随时间减弱的不足[14]。因此,合理引入单剂HPV疫苗、提高疫苗覆盖率或有望以更经济的形式减少宫颈癌的发生。
参考文献:
[1] WHO. Immunization coverage. July 15, 2021. https://www.who.int/news-room/fact-sheets/detail/immunization-coverage
[2] WHO. Immunization, vaccines and biologicals. https://www.who.int/teams/immunization-vaccines-and-biologicals/immunization-analysis-and-insights/global-monitoring/data-statistics-and-graphics
[3] Basu P, Malvi SG, Joshi S, et al. Vaccine efficacy against persistent human papillomavirus (HPV) 16/18 infection at 10 years after one, two, and three doses of quadrivalent HPV vaccine in girls in India: a multicentre, prospective, cohort study [published online ahead of print, 2021 Oct 8]. Lancet Oncol. 2021;S1470-2045(21)00453-8. doi:10.1016/S1470-2045(21)00453-8
[4] Sankaranarayanan R, Basu P, Kaur P, et al. Current status of human papillomavirus vaccination in India's cervical cancer prevention efforts. Lancet Oncol. 2019;20(11):e637-e644. doi:10.1016/S1470-2045(19)30531-5
[5] Basu P, Muwonge R, Bhatla N, et al. Two-dose recommendation for Human Papillomavirus vaccine can be extended up to 18 years - updated evidence from Indian follow-up cohort study. Papillomavirus Res. 2019;7:75-81. doi:10.1016/j.pvr.2019.01.004
[6] Kreimer AR, Sampson JN, Porras C, et al. Evaluation of Durability of a Single Dose of the Bivalent HPV Vaccine: The CVT Trial. J Natl Cancer Inst. 2020;112(10):1038-1046. doi:10.1093/jnci/djaa011
[7] Rodriguez AM, Zeybek B, Vaughn M, et al. Comparison of the long-term impact and clinical outcomes of fewer doses and standard doses of human papillomavirus vaccine in the United States: A database study. Cancer. 2020;126(8):1656-1667. doi:10.1002/cncr.32700
[8] Brotherton JM, Budd A, Rompotis C, et al. Is one dose of human papillomavirus vaccine as effective as three?: A national cohort analysis. Papillomavirus Res. 2019;8:100177. doi:10.1016/j.pvr.2019.100177
[9] Verdoodt F, Dehlendorff C, Kjaer SK. Dose-related Effectiveness of Quadrivalent Human Papillomavirus Vaccine Against Cervical Intraepithelial Neoplasia: A Danish Nationwide Cohort Study. Clin Infect Dis. 2020;70(4):608-614. doi:10.1093/cid/ciz239
[10] Markowitz LE, Naleway AL, Klein NP, et al. Human Papillomavirus Vaccine Effectiveness Against HPV Infection: Evaluation of One, Two, and Three Doses. J Infect Dis. 2020;221(6):910-918. doi:10.1093/infdis/jiz555
[11] Zeybek B, Lin YL, Kuo YF, Rodriguez AM. The Impact of Varying Numbers of Quadrivalent Human Papillomavirus Vaccine Doses on Anogenital Warts in the United States: A Database Study. J Low Genit Tract Dis. 2018;22(3):189-194. doi:10.1097/LGT.0000000000000401
[12] Ginsburg O, Basu P, Kapambwe S, Canfell K. Eliminating cervical cancer in the COVID-19 era. Nat Can 2021; 2: 133–34.
[13] Prem K, Choi YH, Bénard E, et al. Global impact and cost-effectiveness of one-dose versus two-dose human papillomavirus vaccination schedules: a comparative modelling analysis. medRxiv 2021; published online Feb 8. https://doi. org/10.1101/2021.02.08.21251186 (preprint).
[14] International Agency for Research on Cancer/WHO. Primary end-points for prophylactic HPV vaccine trials. IARC Working Group report, vol 7. Lyon: IARC, 2014.
本文来自微信公众号:奇点网(ID:geekheal_com),作者:奇点糕

