本文来自微信公众号:财经大健康 (ID:CaijingHealth),作者:凌馨、辛颖、夏雨欣,编辑:王小,题图来自:视觉中国
想打四价和九价人乳头瘤病毒(HPV)疫苗,要等一两年。
“九价疫苗有200多人在排队,四价的略少一些,即便是二价疫苗,进口的也需等上几个月,最快的是国产二价疫苗,疾控两个月发一次,每次十几人,快的话这几天,慢的话要等到九月。”这是安徽省芜湖市一家疫苗接种门诊部人员给出的排期。
其他地区或快或慢,也都需一段漫长的等候时间,尤其是为了一剂九价疫苗,很多人不得不去香港排队。
2023年7月,一项新政策落地,有望让新的九价疫苗加快上市。
7月11日,国家药监局发布《人乳头瘤病毒疫苗临床试验技术指导原则(试行)》(下称《指导原则》)。其中,对于迭代疫苗上市终点做出了优化。企业基于第一代疫苗研发平台开发的疫苗,可接受以病毒学终点12个月高危型持续感染(PI12)申报上市。
也就是说,已有二价或四价HPV疫苗在售的厂商,可以缩短在研九价苗的临床试验时间。目前两家国产厂商万泰生物和沃森生物的二价疫苗已获批,均有九价疫苗在研。至6月,万泰生物的九价HPV疫苗进入III期临床关键阶段。沃森生物在2022年9月已启动III期临床试验。
“财经∙大健康”从万泰生物相关人士处了解到,去年受惠于国家对于迭代疫苗的相关政策,公司的九价HPV疫苗III期临床方案可以以12个月持续感染为终点来进行申报。一名接近相关临床研究人士曾透露,“我们期待明年(2024年)年终能把注册申请提交上去。”这也是目前已知的国产在研九价HPV预期进展最快的。万泰生物相关人士强调,对申报时间的预期,只是企业和研究者的希望,“具体时间以上市公司公开披露为准”。
当国产HPV疫苗迭代加速,能尽快打破默沙东独占九价疫苗的局面,更早拥有“九价自由”吗?
政策放宽,国产九价HPV可能扎堆上市?
按《指导原则》,企业基于第一代疫苗研发平台开发的疫苗,可接受以病毒学终点12个月高危型持续感染(PI12)申报上市。
这是因为从HPV感染进展为宫颈癌一般需要10年—20年,导致以宫颈癌作为临床终点的临床试验难以实施,PI又是导致组织病理学改变的发病和进展机制。因此按新规,对只是增加覆盖病毒亚型的迭代疫苗,调整了临床终点以缩短获批上市时间。
也就是说,企业在研发迭代疫苗时,选择自行研发的生产工艺可比,价次、型别、抗原含量和配方等方面最为接近的上一代疫苗作为对照,无需再独立设置安慰剂组。
不过,新规也指出,若较第一代疫苗发生了重大药学变更,则需根据变更的具体情况以及第一代疫苗数据的支持程度,具体问题具体分析。同时,药审中心要求,在HPV疫苗上市后应继续开展保护/免疫持久性研究,受试者的随访应至少持续至全程免后72个月。
根据公开信息不完全统计,目前至少有五家国内企业正在开发九价HPV疫苗,除万泰生物和沃森生物,还有北京康乐卫士生物技术股份有限公司(下称“康乐卫士”)、上海博唯生物科技有限公司、江苏瑞科生物技术股份有限公司(下称“瑞科生物”),且都正在进入或已进入到临床III期研发阶段。
也有部分九价疫苗研发进程快于二价疫苗的厂商,或难以从此次指导原则的落地中直接获益。瑞科生物在2022年中九价疫苗已进入III期临床试验时,二价疫苗的进展仅为I期临床试验。
有国产企业已明确对外公布了规划申请上市时间。
瑞科生物在2022年的中报业绩中计划,于2025年向国家药监局提交九价HPV疫苗REC603的上市申请。公司已于2022年8月完成REC603的小年龄组免疫桥接、及与Gardasil9(默沙东九价HPV疫苗)免疫原性比较两项研究的全部受试者入组和首剂接种工作。
康乐卫士2023年3月在北交所发布的招股书中预计,于2026年底提交九价HPV疫苗(女性适应症)上市申请。该公司九价HPV疫苗(女性适应症)III期临床试验后续需进行9次病例监测阶段随访,每次随访时间间隔为6个月。公司计划于2025年完成第6次病例监测随访后,进行III期临床试验期中分析。
华西证券研报中曾预估,2025 年万泰生物公司九价 HPV 疫苗有望上市销售,与公司现有二价 HPV疫苗形成梯队化产品,去抢占进口高端市场。
如果一切能按几家生产商的预计顺利进展,国产九价疫苗面世估计在两年后。
二价苗已现“国产替代”,竞争重点在九价
国内二价疫苗有三家供货商葛兰素史克、万泰生物和沃森生物,默沙东握有四价和九价。从2022年的批签发数量看,二价疫苗万泰生物占了优势,沃森生物是当年才获首次签发。
HPV四价和九价疫苗的批签发量呈现逐年递增的状态,HPV二价疫苗的批签发量变化较为平稳。
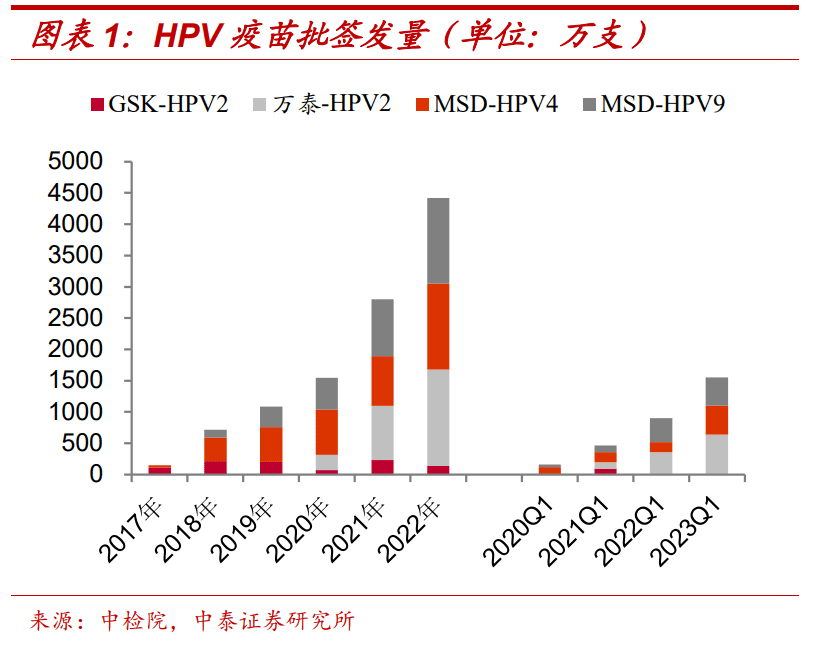
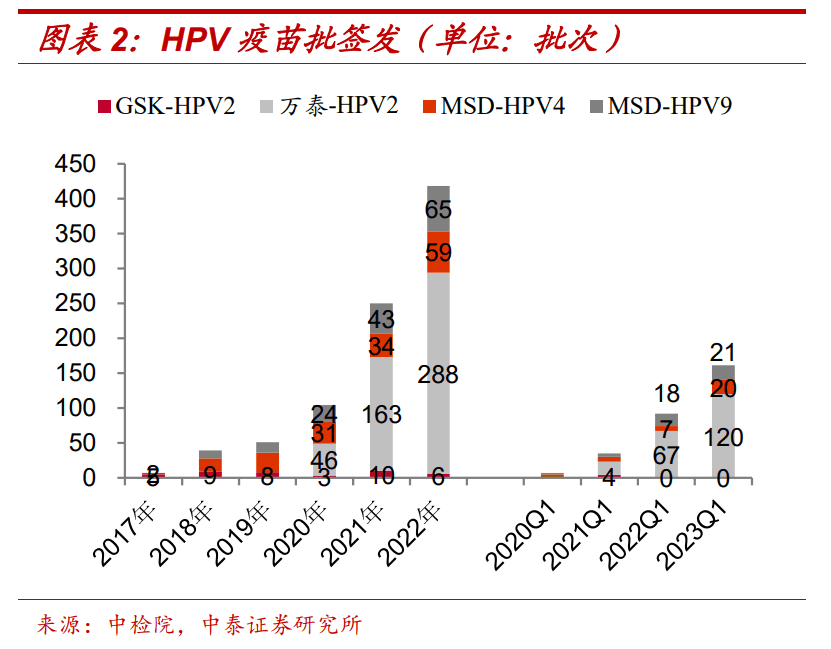
图/中泰证券研报
一位国产HPV疫苗生产负责人告诉《财经∙大健康》,疫苗的制造周期实际不是特别长,真正比较花时间的,是检定。“从投料开始到第一波产品出来,可能要一周左右能拿到一个成品。但要一个月左右的内部检定期,还有一个月在北京的检定,才能发这批产品的合格证。”
2018年,国家药监局有条件批准九价HPV疫苗在中国上市。生产商默沙东中国总裁田安娜曾公开表示,公司每一剂HPV疫苗从开始生产到应用,最长需要近四年时间。
“疫苗生产过程中,一个微小的变更都需要向药监局报备,不能随意调整,像扩产能、工艺改变等重大调整,监管审批更为严格。”上述疫苗生产负责人介绍。
瑞科生物计划在2022年底建成的HPV疫苗生产基地一期项目,计划实现每年500万剂HPV九价疫苗或3000万剂HPV二价疫苗的设计产能。
7月18日,万泰生物在投资者互动平台表示,公司九价HPV疫苗分两阶段建设六条原液生产线,设计产能为6000万支/年,这是二价苗的两倍。万泰生物目前已完成第一阶段两条原液生产线的建设,暂无将九价疫苗生产线用于二价疫苗生产的计划。
这是一个受到高度监管行业,任何重大的或者微小的一些变更都要向监管部门报备,北京一家制药企业的质量控制负责人估算,普通的片剂药品,扩产能采购设备一两个月,设备调试+验证约10天到15天,生产三批样品要有六个月研究时间,国家药品审评中心(CDE)审批时限90个工作日,算下来大概需要10个月的时间。
两家国产厂商,目前二价HPV疫苗设计产能均为3000万支。现在,它们正逐渐成为这一细分领域的“主角”。
中泰证券2023年4月发布的一份研报显示,2022 年HPV 批签发 448 批次(+79.20%),其中 GSK 二价苗6批次(-40%),默沙东 4四价苗59批次(+73.53%),默沙东九价苗65批次(+51.16%),万泰沧海2价苗288批次(+76.69%),沃森生物2价苗批签发30批次。
2023年一季度,二价苗均来自国产,其中万泰生物163批次(同从+79.10%),沃森生物13批次。
中银医药分析认为,目前二价HPV疫苗批签发份额已基本为国产产品占据,原因是“国产产品价格优势明显。”
然而,未来的竞争重点,在九价疫苗上。
天风证券数据显示,默沙东九价疫苗的国内独家代理商智飞生物,在2022年批签发量1547.72万支(同比+51.65%),四价HPV疫苗1402.84万支(同比+59.37%)。
尽管批签发数量增长,但九价HPV疫苗仍然供不应求。
2023年初,智飞生物与默沙东再次续约,约定将向默沙东持续采购HPV疫苗、五价轮状病毒疫苗等产品,基础采购金额合计超过1000亿元,其中HPV疫苗采购金额达到979.57亿元,协议期至2026年年底。
从2018年至今,智飞生物先后3次与默沙东签订关于九价HPV疫苗的合作协议,每次续约的约定采购量都比上一个协议周期大增。据时代财经统计,2019—2020年,智飞生物与默沙东的约定HPV疫苗采购金额为180.02亿元;2021—2023年上半年,双方的约定采购金额为281.06亿元,较上一个协议周期增加了56%;而最新合作协议签署金额更是大增约248%至约1000亿元。
而这三年,智飞生物的营收也是逐年提升,财报数据显示,2019、2020年、2021分别为105.87亿元、151.90亿元和306.52亿元,仅用3年时间便实现营收翻倍增长,九价HPV疫苗的提振效应由此可见一斑。
在沃森生物7月初举办的投资者交流活动上,投资者在追问及九价苗是否有“加速”可能。和以往的错位竞争不同,随着国产九价疫苗陆续上市,HPV疫苗市场的竞争即将展开正面对决。
本文来自微信公众号:财经大健康 (ID:CaijingHealth),作者:凌馨、辛颖、夏雨欣,编辑:王小

