本文来自微信公众号:瞻云(ID:zhanyun2028),作者:瞻云,题图来自:视觉中国
不仅仅是新冠,大多数病原体感染引起的发烧,都会呈现周期变化。
这与病原体特征,以及人体自身的体温调节机制有关。
作为恒温动物,我们体内拥有专门的体温调节机制:通过下丘脑的体温调定点来调节体温。
体温调定点就像一把尺:
当人体面临高温威胁时,下丘脑通过促使汗腺分泌增多、毛细血管舒张、肌肉肝脏产热减少,来促使人体降温;
当人体面临低温威胁时,下丘脑通过促使汗腺分泌减少、毛细血管收缩、肌肉肝脏产热增多,来促使人体升温;
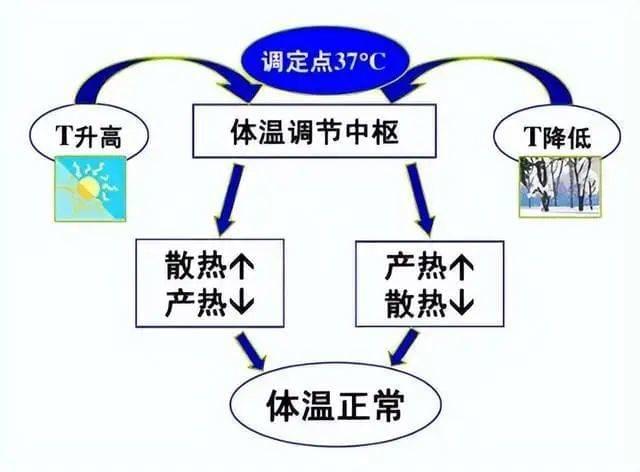
虽然体温调定点通常在37℃附近,但也并非一成不变:
例如,病原体感染、炎症反应、内分泌失常、代谢失常、体温调节中枢功能失常、自主神经功能紊乱,其它疾病等等,都可能导致体温调定点升高,从而引起发热。
日常生活中,普通人遇到的发烧情况,主要都是病原体感染(体液途径)和炎症反应(皮肤感觉神经途径)引起的。
体温调定点的改变,主要通过前列腺素E2 (PGE2)来实现[1]。
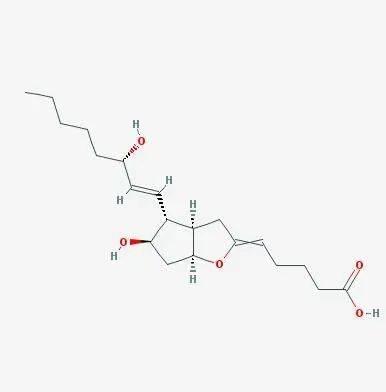
前列腺素E2 (PGE2)
体液途径
当病原体入侵人体,引起人体免疫反应后,便会促使免疫细胞(单核细胞、巨噬细胞、内皮细胞、淋巴细胞等等)释放一系列细胞因子。
细胞因子中的一些致热因子(如白介素1、2、6,干扰素、肿瘤坏死因子等等),可以通过直接或间接途径,促进PGE2释放[2]。
当PGE2与下丘脑中的PGE2受体结合,便可以激活下丘脑前部的神经元,升高体温调定点。
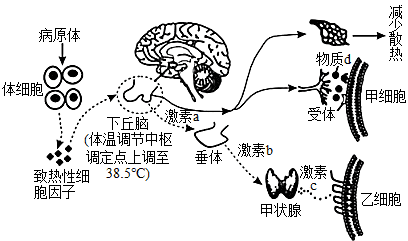
神经途径
当出现局部炎症,PGE2便会在炎症部位形成,通过激活皮肤中的冷敏神经元,把发射信号传递给大脑,从而进行升温[3]。
除了皮肤感觉神经途径外,还可以通过迷走神经(肝脏为主)来升高体温。迷走神经途径,可以不依赖PGE2,单纯通过肾上腺素发挥作用[4]。
病原体导致体温调定点的升高,主要原因在于高温可以抑制病原体(增强免疫、削弱病原体),这是一种适应性进化。
随着病原体被清除,免疫反应结束,炎症反应结束,PGE2水平便会降低到正常水平。再加上相应体温负调节机制发挥作用,体温调定点就会恢复到正常水平。
可以看出,体温的高低,反映了PGE2水平的高低,而PGE2水平的高低反映了免疫反应的强度。而个体免疫反应的强度,往往和病毒量的多少有关。
当然,人体感染不同病原体的发热状况,与病原体本身的感染能力、载毒量,以及人体免疫系统的强弱,都具有直接关系。
不同病原体感染不同人群后,体温表现多种多样[5][6][7]:
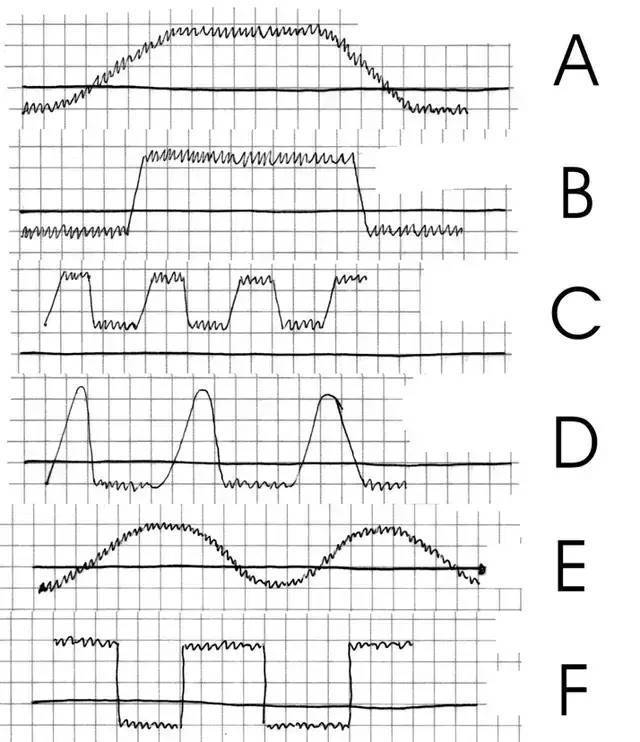
关于体热表现的描述,如与其它一些资料存在细微差异,在于选取资料和文献的不同
A:稽留热,体温39~40℃以上,表现为全天24小时高体温,最高和最低温差小于1°C,主要见于大叶性和革兰氏阴性肺炎、伤寒、急性细菌性脑膜炎、尿路感染、肺结核、真菌性感染等[8]。病毒性感染也可见此种类型。
B:短期持续的急性发热,表现为急性发热但一般会在24小时内会消退。急性感染和一些常见疾病,都可能出现。
C:驰张热,体温39℃以上,波动大,24小时内温度波动超过2℃。多见于细菌感染,例如败血症、感染性心内膜炎、立克次体感染、布鲁氏菌病等。病毒性感染多出现驰张热,表现为自限性。
D:间歇热,体温往往骤升39℃以上,数小时后消退,高热和无热期反复交替出现,无热期最长可达1天到数天(主要分为24小时、48小时、72小时)。多见于疟疾、化脓性感染、结核病、血吸虫病、败血症、淋巴瘤、螺旋体感染、黑热病、急性肾盂肾炎[9],其它一些细菌性、病毒性感染也可能存在间歇热。
E:波状热,多见于布鲁氏菌病[10],羊为主要传染源,其次为猪牛。
F:回归热[11],这是一种由回归热螺旋体感染引起的典型症状,多由虱子和蜱虫叮咬传染,一般不见于其它情况。(每个周期的发热,其实没有图中那么规则,可以表现出稽留热、弛张热、间歇热等波形)。但也见于疟疾、淋巴瘤、螺旋体病、周期性中性粒细胞减少症和鼠咬热等等[12]。
不同的病原体,感染不同的人群后,具有不同的发展情况,大多呈现昼夜变化[13]。
但其实可以看出,由于一些细菌、真菌在人体内具有更加典型的生命周期,它们导致的体温波动也更加的典型。相对来说,病毒的周期性,很难具有典型表现,个体差异更大。
新冠病毒作为一种病毒,一种病原体,也主要通过免疫反应引起PGE2升高,导致人体发烧[14][15]。新冠症状的严重程度,也与PGE2水平表现出正相关性[16]。
新冠住院患者中,出现发热症状的多达88.7%[17]。
它的发热表现,间歇性也是常见症状之一[18]。
新冠病毒在人体内的发展,与体温有着这样的关系:
当新冠病毒在人体内复制,随着病毒量增加,免疫反应增强,便会导致体温调定点逐渐升高。
当体温升高后,新冠病毒被抑制,随着病毒量的减少,免疫反应减弱。顽固的新冠病毒,又可能再次入侵细胞,进行不断复制。
发展到足够规模后,又再次引起强烈的免疫反应,引起体温升高。
……
就这样,发热与病毒量此起彼伏,不断循环。
虽然大多数人的免疫系统最终会消灭新冠病毒,但也有部分人群(10~20%)的免疫系统无法彻底清除它们,从而表现出长新冠,处在长期症状的痛苦折磨中。
对于无症状来说,一般是因为,感染的病毒足够少,或者免疫系统足够强大。引起免疫反应后,新冠病毒直接被消灭,产生的细胞因子尚未引起体温升高,就已经恢复到正常水平。
对于短病程的一次性发热的轻症来说,则可能在第一次发热周期时,体内的病毒就已经清除。
当然,大多数轻症来说,一般在数个周期内清除病毒。
除了典型病程来说,一些反复发热可能涉及到更复杂的原因,例如深部感染形成脓肿,因为其它各种原因抗原反复暴露,药物过敏,组织坏死,甚至一些不明原因等等[19]。
新冠的发烧并不高吗?
由于奥密克戎的毒性已经远远低于德尔塔,对于大多数人来说,并不会产生重症那样的细胞因子风暴。因此主要都是轻症,所以一些人群的发热程度的确不高。
但这还是和毒株支系的毒性、病毒感染量,以及自身免疫系统息息相关,具有很大的个体差异。
有人可能急性超高烧后,迅速抑制病毒然后恢复;但也有人可能长期低烧,反反复复,无法彻底清除病毒。
为什么发热周期往往和昼夜周期有关?主要体现在两点:
1. 人体本身体温周期就是随着昼夜变化的。
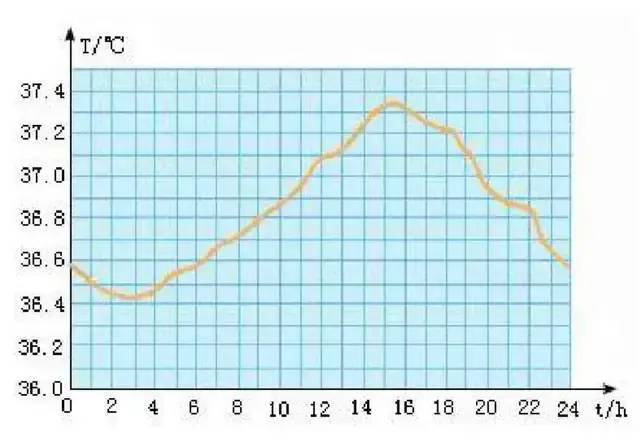
白天的体温更高,晚上的体温更低,通常温差在1℃之内。受到生物钟的调节,与新陈代谢、内分泌有关。
当病毒感染量足够低的时候,本身发热增幅并不明显,体温周期自然和昼夜节律相同。例如,平均升温0.6℃时,白天便会呈现发烧状态,而夜晚看起来正常。
2. 病毒活性受到温度影响,免疫反应受到昼夜节律的调控[20]。
晚上睡觉时,随着新陈代谢降低,相关生理功能的减弱,同时随着体温降低,病原体可能表现得更为活跃。
关于免疫力方面,我原回答提到睡觉时,免疫力更低。其实这个说法有一定的问题。确切地说,是睡觉之前免疫力最低,睡觉之后,免疫力会逐渐增强,后半夜和清晨免疫力最强。
免疫系统,是靠抗炎因子和促炎因子的平衡制约发挥作用的。简而言之,促炎因子让免疫系统更加的活跃,从而形成炎症反应,清除病原体,但也更易造成细胞因子风暴,对自体细胞组织造成破坏。而抗炎因子抑制免疫系统,可以对自体细胞组织进行保护,但同时也可能让病原体更容易入侵和繁殖。也就是说,无论抗炎因子还是促炎因子过强对人体都不好,需要处在一个动态平衡的状态。
夜间正是促炎因子和抗炎因子发生平衡转变的关键过程[21][22]。
入睡之前,抗炎因子持续一天的活动,炎症因子达到最低,免疫反应也最弱。入睡后,随着促炎因子的逐渐增加,人体免疫反应则会逐渐增强,到后半夜之后免疫反应最为激烈。
过强的免疫反应,更容易对机体造成威胁。人类出现急性炎症症状和死亡风险,也主要发生在这个时间段。
尤其是在病毒感染期间,病毒趁着傍晚免疫减弱时迅速发展,等到后半夜免疫反应最强时,便更容易出现严重的免疫反应,导致PGE2水平迅速增加,引起体温的急性升高。
因此急性发烧,或周期性高烧大多出现在夜晚。
虽然急性升高的体温,有助于抑制病毒的发展,但往往也更加的危险。
晚上的急性高烧,尤其需要注意降温处理。
高烧一般比正常体温高2~4℃,远超出正常昼夜体温差。相比起第一种情况,此时体温周期与病毒量的周期变化、免疫节律,呈现出更强的相关性。
当然,也正是因为免疫节律存在这样的周期,所以多睡觉,有利于流感和新冠感染后的恢复。
由于大多数人对高烧印象深刻,所以对深晚上发烧的印象也会更深。
总之,新冠感染后引起的发烧,整体上的确会呈现昼夜周期的变化,但具体的发烧程度,以及波动特征,则会具有明显的个体差异。
由于体温升高有利于抑制病原体,再加上退烧药一般具有一定副作用,所以一般建议38.5℃以下不用退烧药,38.5℃以上可以考虑使用,超过40℃需要配合物理手段进行退烧。
值得说明的是,每个人的体质有所差异,高烧耐受不同。是否降温处理,可以依据难受程度进行自我判断。
随着奥密克戎变体XBB的流行,近期二阳的越来越多,希望大家能做好个人防护,保重人体。
参考文献
[1] Blatteis C M. The onset of fever: new insights into its mechanism[J]. Progress in brain research, 2007, 162: 3-14.
[2] Roth J, De Souza G E P. Fever induction pathways: evidence from responses to systemic or local cytokine formation[J]. Brazilian journal of medical and biological research, 2001, 34: 301-314.
[3] Rummel C, Barth S W, Voss T, et al. Localized vs. systemic inflammation in guinea pigs: a role for prostaglandins at distinct points of the fever induction pathways?[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2005, 289(2): R340-R347.
[4] Fever and the thermal regulation of immunity: the immune system feels the heat
[5] El-Radhi, A. Sahib. "Fever in common infectious diseases." Clinical Manual of Fever in Children. Springer, Cham, 2018. 85-140.
[6] Ogoina D. Fever, fever patterns and diseases called ‘fever’–a review[J]. Journal of infection and public health, 2011, 4(3): 108-124.
[7] Fever : Definition, Mechanism and Types. Nov 9, 2017
[8] Clark V L, Kruse J A. Clinical methods: the history, physical, and laboratory examinations[J]. Jama, 1990, 264(21): 2808-2809.
[9] Le Moing V, Leport C. Intermittent fever of infectious origin[J]. La Revue du Praticien, 2002, 52(2): 139-144.
[10] Corbel M J. Brucellosis: an overview[J]. Emerging infectious diseases, 1997, 3(2): 213.
[11] von Both U, Alberer M. Borrelia recurrentis infection[J]. New England Journal of Medicine, 2016, 375(5): e5.
[12] Tolia J, Smith L G. Fever of unknown origin: historical and physical clues to making the diagnosis[J]. Infectious disease clinics of North America, 2007, 21(4): 917-936.
[13] Musher D M, Fainstein V, Young E J, et al. Fever patterns: their lack of clinical significance[J]. Archives of internal medicine, 1979, 139(11): 1225-1228.
[14] Ricke-Hoch M, Stelling E, Lasswitz L, et al. Impaired immune response mediated by prostaglandin E2 promotes severe COVID-19 disease[J]. PloS one, 2021, 16(8): e0255335.
[15] Stella A, Lamkanfi M, Portincasa P. Familial Mediterranean fever and COVID-19: friends or foes?[J]. Frontiers in immunology, 2020, 11: 574593.
[16] Aliabadi F, Ajami M, Pazoki–Toroudi H. Why does COVID‐19 pathology have several clinical forms?[J]. Bioessays, 2020, 42(12): 2000198.
[17] Gul M H, Htun Z M, Inayat A. Role of fever and ambient temperature in COVID-19[J]. Expert Review of Respiratory Medicine, 2021, 15(2): 171-173.
[18] Arita Y, Yamamoto S, Nagata M, et al. Long COVID presenting with intermittent fever after COVID-19 pneumonia[J]. Radiology case reports, 2021, 16(9): 2478-2481.
[19] Knockaert D C. Recurrent fevers of unknown origin[J]. Infectious disease clinics of North America, 2007, 21(4): 1189-1211.
[20] Born J, Lange T, Hansen K, et al. Effects of sleep and circadian rhythm on human circulating immune cells[J]. The Journal of Immunology, 1997, 158(9): 4454-4464.
[21] Comas M, Gordon C J, Oliver B G, et al. A circadian based inflammatory response–implications for respiratory disease and treatment[J]. Sleep Science and Practice, 2017, 1(1): 1-19.
[22] Garbarino S, Lanteri P, Bragazzi N L, et al. Role of sleep deprivation in immune-related disease risk and outcomes[J]. Communications biology, 2021, 4(1): 1-17.
本文来自微信公众号:瞻云(ID:zhanyun2028),作者:瞻云