本文来自微信公众号:财经大健康 (ID:CaijingHealth),作者:凌馨、辛颖,编辑:王小,头图来自:视觉中国
尽管2023年2月7日,国家医保局公开表示,刚获批上市的两款国产新冠治疗用药已全部被临时性纳入医保支付范围,国产口服新冠药的高光时刻,还是暂停在了申请上市那一天。
先声药业的新冠药申请上市当天,股价涨到14.7元,不及一个月,股价降至11.18港元;君实生物A股价格2月7日为55.55元,比新冠药申请上市当天的62.57元也降了不少,主力资金持续流出。两家公司的首款新冠药都在1月29日获批附条件上市。
“都炒过一波了。”一位二级市场投资者对《财经·大健康》说,市场预期已经推高了两家企业的股价,不批才是“非预期”,现在虽然批了,以后能卖得怎么样,却“不好说”。
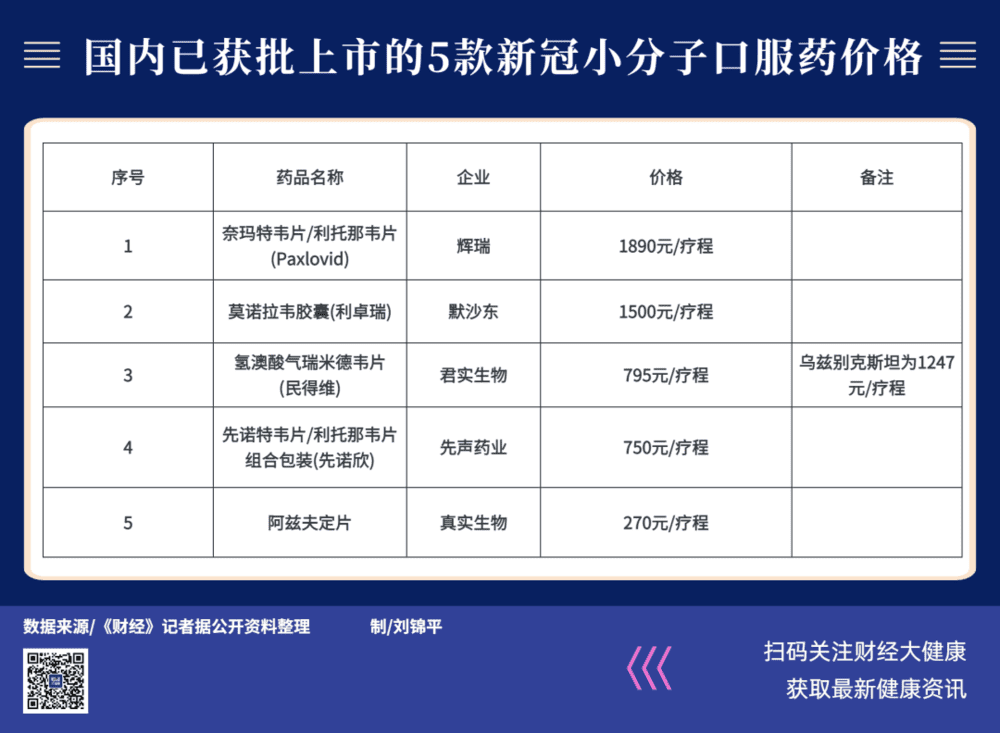
两款口服新冠药最终的定价分别为每疗程750元和795元,远低于辉瑞Paxlovid。就在两个月前,Paxlovid的黑市价,一度被炒到3万—4万元/疗程。
1月31日,辉瑞公布的2022年财报显示,全年总营收创历史新高,达到1003.3亿美元。比起辉瑞抓住的先机,后来的国产新冠药将如何求生。
两款药,14亿元研发费
每卖一瓶口服新冠药,先声药业最多可赚222.75元,君实生物为116.2936元。
听起来不少,利润率30%和15%。两家加起来,得卖约1000万份(疗程)才能收回研发成本。
这是一道简单的算术题。按照国家医保局要求,两家企业的口服新冠药在首次挂网公示时,披露了价格构成信息。成本分别包括直接研发费用、期间费用和原料药成本,含税出厂价也同步公示。其中,期间费用包括管理、销售和财务成本。
两款的原料药成本差别不大,都是300多元。主要差异在于研发成本。
根据两家公司的首发报价显示,先声药业直接研发花了5.02亿元,君实生物达8.79亿元。二者启动研发新冠相关药物时间仅相差1个月,但君实生物启动了多项国际多中心临床研究阶段,比仅在国内做临床贵很多。
期间费用率也是君实生物报得更高,设定为33.69%,比先声药业高10个百分点。
这与两家公司所处阶段有关。君实药业是一家创新药企,此前仅三款产品在售,2022年上半年营收不足10亿元,期间费用率将近六成;先声药业则有至少40款产品进入医保,2022年上半年营收27亿元,整体期间费用率比前者低15个百分点。
无论30%还是15%,在最早赚到新冠用药钱的跨国药企面前,都有点不够看。即便和新兴的生物公司相比,美国莫德纳(Moderna)、拜恩泰可(BioNTech),前者2021年的净利率为66%,后者为61%。
不到15%的利润空间,也就和过得不错的老牌仿制药企差不多。在2022年底的退烧药抢购潮中,宣布受托生产布洛芬蹭了一波热度的石四药集团,2021年的净利率是14.7%。
光看两家企业给口服新冠药设定的利润率,想在这两款药上赚大钱,已经不可能了。想回本,按现在两家的新冠药定价,先声药业得卖225.44万盒,君实生物得卖756.61万盒。
可作参考的是,经历了2022年末的大规模疫情,当时真实生物唯一获批上市的国产口服新冠药,累计卖了850万份。这是在售价相当于两款刚刚获批新药定价一半的情况下。
据《财经·大健康》了解,目前,差不多的医疗机构已备有口服新冠药,即便是部分居民手中也有存货。
“不再买了,之前的也没用上。”曾因担忧变异株到处找药的一位上海居民告诉《财经·大健康》,他托人从海外买到一盒Paxlovid仿制药,春节前拿到时,全家都已经感染了一遍,现在手里有一盒药备着,万一真有长辈二次感染,再买也来得及。
包括Paxlovid在内的三款已上市口服新冠药在线上问诊平台及线下连锁医疗机构等自费渠道“放量”。多名受访者已收到药物,并表示“完全不用抢,某东、某团我都配到了”。
没有热销的机会了?
岁末年初的一波疫情,使全国约80%的人经历了感染。短期内,新冠用药大规模需求的可能性也很小。
二次感染常常是由于新冠病毒变异导致的。北京大学第一医院感染科主任王贵强称,经历过感染的人,再次感染一般有一段间隔期,而且,同一毒株的再次感染概率是极低的。“比如说现在我们是BF.7,那么下一部分可能是XBB或者是BQ.1.1这类的毒株,那可能再次感染”。
对新冠药研发企业来说,XBB或者是BQ.1.1等新的毒株若在中国流行,才有可能带来一波新的需求。
BQ.1、BQ.1.1、XBB和XBB.1等亚型,可能是迄今为止最具抗性的新冠变异株。科学期刊《细胞》在线发表的一篇论文曾指出,新冠疫苗接种者和康复者血清针对BQ和XBB亚变体的滴度分别降低了13至81倍、66至155倍。
中国疾控中心数据显示,截至1月23日,全国报送的本土病例基因序列中,未见XBB、BQ.1.1等在列。
即使XBB或其他变异株真在中国引发新一轮疫情,新冠药也未必都能大卖。
阿斯利康就碰到了这个问题。1月26日,美国食品和药品监督管理局(FDA)撤回了其研发的抗体药物Evusheld紧急使用授权,因为,“数据显示Evusheld不太可能对某些新冠变异株有效”。
在中国,一位三甲医院新冠治疗一线医生也对《财经·大健康》表示,据他观察,抗体的疗效正因病毒频繁的变异慢慢有所下降。
对于毒株变异可能带来的疗效降低风险,先声药业称,其研发的先诺欣针对3CL靶点,具有广谱抗冠状病毒活性,即使未来新冠病毒从奥密克戎继续发生变异,这种靶点药物依旧有效。辉瑞Paxlovid也是针对这一靶点。
不过,目前先声药业并未披露有关最新变异株的研究信息。君实生物截至1月3日仍有多项国际多中心临床研究正在开展。
改善症状和预防,成兵家必争之地
治疗新冠的钱难挣,企业的发力点就选在“预防”和改善症状。
先声药业2022年5月宣布,获得临床批件,拟用于新冠阳性感染者密接人群暴露后的预防,这也是国内首个预防性用药试验。
此前,君实生物曾在国外赚过一波“预防”钱。两年多前,君实生物将其研发的埃特司韦单抗(JS016)海外权益授权给礼来,首付款加里程碑款2.55亿美元,已于2021年达成并确认收入。在美国,该药可同时用于新冠治疗和暴露后预防。
根据约定,君实生物还可持续获得JS016销售净额两位数百分比的分成。但是,在2022年二季度,礼来新冠抗体产品收入锐减至1.29亿美元,较一季度下滑超过90%。
这是因为,当年1月底,FDA限制了JS016的使用范围,仅用于对中和抗体有敏感的突变株。
不过,从全球看,目前还没有出现对变异株无效而撤销小分子口服药授权或限制使用的先例。
这是一个时间窗口。先声药业首先要解决的,还是如何完成临床试验。毕竟,就在先声药业获得预防性试验批件前两周,Paxlovid的同类试验刚刚失败。虽然口服5天Paxlovid和10天分别把密接者的感染风险降低了32%和37%,但两项结果均无统计学意义。
先声药业相关负责人彼时对媒体介绍,其临床方案对入组对象的要求限定为可能感染的48小时以内,而非辉瑞选择的96小时。这样做,“有可能提前缩短病毒载量下降时间,可以达到遏制病毒进一步传播效果”。
在流感用药奥司他韦的相关临床试验中,对预防用药的入组要求,也是48小时以内。该药2019年销售额60亿元,开单量最多能达到1亿人次。
“先声是比较擅长临床试验设计的。”一位一级市场医疗投资负责人对《财经·大健康》说,扩大适应症范围是做大新冠用药市场的必然选择,既然重症和死亡越来越少,改善症状和预防就成为两大主要方向。
不少国产新冠药研发厂商在往预防方向走。
1月8日,真实生物投资方倚锋资本发布招募信息,继2022年末在菲律宾获得临床批件后,阿兹夫定也将在国内进行针对有症状新冠感染者的家庭密切接触者的预防感染临床研究。
君实生物未见相关信息披露。不过,同样针对3CL靶点开发新冠药的众生制药,也获批开展预防感染的临床试验。
最终还是要看铺货情况,也就是看渠道。“你看疫苗,鼻喷之前上海很难找到打康希诺的。”前述二级市场投资者分析,国产新冠药市场,还是销售能力的比拼。
先声药业的销售能力颇受投资界认可。华泰证券在一份研报中称,公司拥有超4400人销售团队,有望全力投入先诺欣的销售工作。在创新药销售方面,2022年上半年,该公司创新药产品实现收入17.67亿元,同比增长44.8%,在总收入中占比65.44%,前两年,这一比例分别为45.1%和62.4%。
君实生物的销售数据也有提升。2022年上半年,主力产品特瑞普利单抗在国内市场销售额约2.98亿元,其中,一季度环比提升约212%,二季度又升70%。
前述一级市场医疗投资负责人也认为,“看销售能力方面,本土企业还真不一定输给外企,做好本地市场就有机会。”
至少,地方政府为防疫目的的药物储备,可能会带来一波销量。1月9日,安徽省经信厅介绍,累计向全省分配阿兹夫定片13.65万盒、Paxlovid2.07万盒。国家药监局宣布附条件批准相关药物上市后,君实生物所在地上海、先声药业所在地南京的政府官微,都发布了相关消息。
“要为后续的第二波、第三波感染高峰做好储备,有三个月用药量比较合适。”前述三甲医院新冠治疗一线医生说。
本文来自微信公众号:财经大健康 (ID:CaijingHealth),作者:凌馨、辛颖

