卡介苗,这一在中国几乎尽人皆知、每个新生儿都要接种的疫苗,正在成为科学家的研究新宠。他们想用它来攻克另一百年难治之症——阿尔茨海默症,近几年已经取得了多项进展。
淀粉样蛋白的新认知
凡是知道阿尔茨海默症的人,对“淀粉样蛋白假说”一定不陌生。尽管近年来该假说争议不断,它仍然是解释阿尔茨海默症致病机理的主流理论,研究人员也以其为靶点钻研各种治疗方法。该理论假定大脑中β-淀粉样蛋白的渐进累积斑块化,从而触发复杂的级联反应:神经元细胞死亡,神经元突触缺失,渐进性神经递质愈发不足,所有这些效应最终导致痴呆的临床症状。[1]
那么,如果我们再往前溯源:导致β-淀粉样蛋白斑块化开始出现的确切原因是什么?至今没有答案。
2022年,一篇发表在《公共科学图书馆:病原体》(PLoS Pathogens)上的论文[2]提出了一条新的致病通路,即病原体感染—免疫系统运作—β-淀粉样蛋白累积—神经退行性疾病发生。具体来说,当我们年轻时,自身防御系统可以抵御细菌、病毒或真菌进入大脑。然而,随着年龄的增长,免疫细胞能力式微,微生物趁机进入神经组织中。
而免疫系统生产β-淀粉样蛋白以杀死入侵微生物,发挥短期的保护作用。如果大脑的免疫细胞,即小胶质细胞能正常工作,它们就能在病原体危机解除之后,清除掉这些淀粉样蛋白。但是,在许多阿尔茨海默症患者病例中,小胶质细胞似乎出现了功能障碍,无法及时清理,淀粉样蛋白质由此不断沉积、斑块化,反过来开始损伤神经元。
实际上,上世纪90年代发表的相关尸检报告[3]就发现,阿尔茨海默症逝者大脑中寄生着常见的微生物,例如引发唇疱疹的1型单纯疱疹病毒,这些微生物通常被困于淀粉样蛋白中。
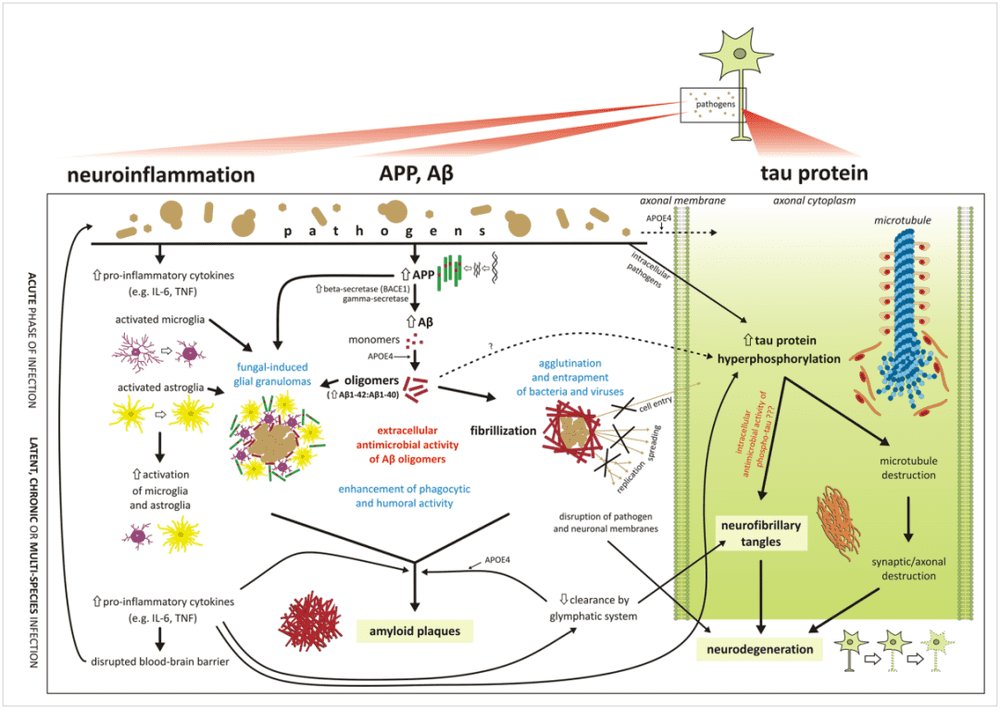
图1:图片展示了病原体感染中枢神经系统后,激活免疫反应,其中β-淀粉样蛋白累积便是消除病原体的手段之一,但随后也会形成淀粉样蛋白沉积斑块。来源:10.1371/journal.ppat.1010929
其实学界已有研究报告β-淀粉样蛋白质另一不为人知的特性:可抵抗微生物。2018年发表在《阿尔茨海默症期刊》(Journal of Alzheimer’s Disease)上的综述文章[4]提供了诸多研究证据,表明在人类和动物模型内,大脑感染后进一步刺激了β-淀粉样前体蛋白的加工,包括降解切割后由40-和42-氨基酸残基组成的蛋白的生成,这两种蛋白质也是阿尔茨海默症患者脑内β-淀粉样蛋白的主要存在形式,它们容易纤维化聚集起来,形成不同大小的可溶性聚集体。
β-淀粉样蛋白寡聚体便是其中一种[5],科学家通过体内和体外实验证明这些寡聚体具有强效的广谱抗菌特性,可捕获病原体,破坏其细胞壁,持续抵抗细菌和病毒的感染。而清除β-淀粉样蛋白的阿尔茨海默症临床试验,则观测到患者随后的感染程度有所增加。
同年,另一篇研究[6]则通过小鼠模型和人类神经元细胞培养感染模型,揭示了β-淀粉样蛋白寡聚体可结合疱疹病毒表面糖蛋白,一方面加速β-淀粉样蛋白沉积,另一方面对嗜神经性单纯疱疹病毒1(HSV1)和人类疱疹病毒6A和B展开捕获。再次支持β-淀粉样蛋白可能在中枢神经系统先天免疫过程发挥保护性作用的说法。
由此可见,β-淀粉样蛋白的短暂活动有助于大脑消灭入侵微生物,但随后却因免疫功能障碍从“得力助手”成为可能的“致病杀手”。
事实上,靶向β-淀粉样蛋白一直是多年来学界设计阿尔茨海默症治疗药物的策略之一,经过几十年的研究,美国食品药品监督管理局仅批准了两款治疗早期阿尔茨海默症的单克隆抗体药物:ADUHELM[7]和Leqembi[8],它们能选择性地结合患者大脑中β-淀粉样蛋白沉积斑块,将其中和并消除,这能缓解部分患者的疾病进展,但对整体生活质量的改善往往有限,还有一定的不良反应[9]。
而对β-淀粉样蛋白特性的新认识提供了另一对抗思路:如果能增强免疫系统的整体功能而不只为消除β-淀粉样蛋白沉积,或许就能让免疫细胞及时清除沉积的斑块,防止进一步病变的发生。
百年老药展现新用途
有时候,科学发现往往出现在最让人意想不到的地方。
让我们先回到20世纪初的法国,医生阿尔贝·卡尔梅特(Albert Calmette)和兽医卡米尔·介林(Camille Guérin)合力寻找牛结核病传播的途径。为实现这个目的,他们首先需要培养出牛结核病菌,俩人发现将切片的土豆和牛胆、甘油一起煮熟,能“熬制”出完美的病菌培养基。
不过在培养过程中,他们惊讶地发现,随着每一代细菌的生长,它们的毒力会越来越弱,一代不如一代。随后,动物即便感染了多代培养出来的细菌,也不会再生病,而且还不会再次受到野生结核病菌的感染。
到了1921年,两位医生在首个人类患者身上进行测试,受试对象是一名婴儿,他的母亲刚死于肺结核,结果奏效了。于是,在日后拯救了数百万生命的卡尔梅特-介林疫苗(亦称为卡介苗)由此诞生,并得到了广泛接种。
然而,卡尔梅特和介林生前可能从未想到,自己的研究可能启发一个多世纪后的科学家,将卡介苗用于研究另一种截然不同的疾病,而且还得出了令人意想不到的结论:卡介苗可能保护人们的大脑,以免发展出阿尔茨海默症。
这个说法听上去好像很离谱,但数十年来学界确实展开研究,表明卡介苗的保护范围出乎意料的广泛,远超其最初研发目的。例如,发表在《疫苗》(Vaccines)期刊上的一篇荟萃分析研究[10]揭示了卡介苗可降低呼吸道感染风险。而另一篇双盲随机临床实验[11]则表明,对于呼吸道感染风险,接种卡介苗可提供强劲的保护效力。
除了呼吸道感染,卡介苗还作为非肌层浸润性膀胱癌的标准治疗手段:将减毒细菌递送到器官中,能激活免疫系统去消灭肿瘤,由此可降低肿瘤复发的风险,降低癌症进一步发展成更具侵袭性疾病的可能性。[12]
甚至在新冠大流行期间,一些研究认为卡介苗可能对新冠病毒感染有保护作用。例如美国弗吉尼亚理工大学、国家过敏与传染病研究所等机构研究人员,就于2020年7月在《美国国家科学院院刊》(PNAS)上发表报告称[13],他们回顾了卡介苗预防新冠病毒感染的潜在生物学证据,在排除潜在干扰因素后,发现在国情相似的各欧洲国家,一个国家的卡介苗接种率与新冠病亡率之间存在显著相关性。卡介苗接种率每提高约10%,新冠病亡率就会降低10.4%。
具体到卡介苗治疗阿尔茨海默症,已有动物模型研究提供了一些初步证据。2017年,中国中山大学中山医学院团队发表论文[14],通过阿尔茨海默症小鼠模型实验,他们发现,接种卡介苗的小鼠大脑中发挥炎症消退作用的单核细胞募集得到了增强,聚集到大脑中斑块病变区域;与此同时,还生成了更多可增强免疫功能的循环干扰素-γ,抗炎细胞因子水平得到了上调,最终使模型小鼠脑部炎症得到缓解。
卡介苗之所以能在上述各研究中发挥免疫增强效果,得益于“免疫系统训练”这一过程。当个体接种卡介苗之后,与细胞因子生成相关的基因表达发生变化。细胞因子能够激活我们身体内的其他防御机制,包括白细胞在内的小分子,从而让身体更有效地应对威胁,包括外来入侵的病毒或细菌,或者生长不可控的细胞突变等。
如此一来,卡介苗的“免疫系统训练”便与前文提出的通过增强免疫系统来预防阿尔茨海默症的设想联系到了一起:通过训练,身体的防御能力得到了增强,将病原体阻挡在进入大脑之前。此外,增强的免疫系统还能及时有效地清除大脑中的β-淀粉样蛋白,且不伤害健康的神经组织。
好消息不断,但仍需保持谨慎
既然在小鼠模型实验中,卡介苗接种产生了积极效果,那么对人类来说是否也同样奏效呢?为回答这个问题,全球多个研究团队展开了探索。
耶路撒冷希伯来大学哈萨德医学中心(Hadassah Hebrew University Medical Center)的Ofer Gofrit团队收集了1371名平均年龄为68.1岁的膀胱癌患者相关数据,他们或接受过,或未接受过卡介苗治疗。在之后的随访期间,发现接受过卡介苗治疗的患者罹患阿尔茨海默症的风险要比未接受过卡介苗治疗的患者低4倍以上[15]。该结果于2019年发表在《公共科学图书馆:病原体》(PLOS ONE)期刊上,之后其他研究团队成功复现了这一结果。
2023年,美国波士顿麻省总医院(Massachusetts General Hospital)的Marc S. Weinberg团队在《JAMA开放网络》 (JAMA Network Open)上发表了队列研究结果[16],他们调查了马萨诸塞州约6500名非肌层浸润性膀胱癌老年患者,发现卡介苗治疗与更低的阿尔茨海默症以及相关痴呆症风险相关联。
不过,不同研究阐释出卡介苗降低阿尔茨海默症疾病风险的不同程度。2023年8月的一项荟萃分析同样以卡介苗治疗对膀胱癌患者痴呆症风险的影响为课题[17],搜寻了直到2023年5月20日的六大相关数据集,评估了4043份记录,最终分析了5篇包括45407名患者的研究论文,结果表明卡介苗与膀胱癌患者痴呆症发病率之间存在显著相关性,而接受卡介苗治疗可平均降低45%的痴呆症发病率。
45%这个数字,让人意外又欣喜。然而,这只是一项荟萃研究,仍需深入研究继续证实。如果情况确实如此,那将对预防阿尔茨海默症产生巨大影响。耶路撒冷希伯来大学的Charles Greenblatt教授对此评价说:“仅仅将阿尔茨海默症的发展延后几年,都将极大减轻人们的痛苦,节省大量金钱。”[18]
尽管好消息不断,但我们非常有必要始终保持谨慎。首先,现有的论文报告基本上都以膀胱癌患者为研究对象,对一般人群的数据少之又少。一条明显的研究策略是比较童年时期接种卡介苗与未接种卡介苗的人,但缺点也很突出:卡介苗的效果可能会随着几十年时间的流逝而变得微乎其微,甚至远早于大多数人患上阿尔茨海默症的危险期。
其次,这些研究都没有给出因果关系证明,均为相关性证明。“在流行病学研究中,可能潜伏着各种混淆因素,研究人员可能没有充分考虑这些潜伏因素。”宾夕法尼亚州德雷克塞尔大学医学院(Drexel University College of Medicine)的Jeffrey Lapides说,尽管他认同卡介苗对痴呆症的影响具有合理性,但仍需更多研究来证明。
确定性的证据要求展开随机对照试验,分配患者或接受治疗,或服用安慰剂。然而,痴呆症的发展是一个相当缓慢且漫长的过程,可能需要数年甚至更久的时间来收集更多数据,以证明卡介苗或其他疫苗能够提供理想的保护效力,预防阿尔茨海默症。
威斯康星大学麦迪逊分校(University of Wisconsin-Madison)的Coad Thomas Dow团队展开了一项试点研究,并于2022年将成果发表在Microorganisms期刊上[19],团队招募了49名受试者,发现卡介苗接种可有效降低血浆淀粉蛋白质水平,特别是在携带与更高阿尔茨海默症风险相关基因的受试者中。
另外,更年轻受试者、风险级别更高的受试者、未潜伏性感染巨细胞病毒的受试者,以及淋巴细胞免疫风险情况良好的受试者都表现出统计学意义上显著的有利变化。尽管该研究样本量很小,但增强了继续钻研通过免疫训练来预防阿尔茨海默症这一策略的信心。
受到卡介苗相关新研究的启发,有些科学家也盯上了其他疫苗。虽然卡介苗被认为可提供最强效的免疫训练,因为它包含减毒的活体细菌,但其他疫苗也有刺激身体免疫系统的作用,例如流感疫苗。已有队列分析研究表明[20],在控制了混杂因素后,与未接种过流感疫苗的受试者相比,接种过流感疫苗、平均年龄为75.5岁的受试者罹患痴呆症的可能性显著更低。
而意大利巴勒莫大学(UNIPA)的Nicola Veronese团队分析了9项研究结论[21],其中许多控制了生活方式因素,包括收入、教育程度、吸烟、饮酒和高血压,结果发现,流感疫苗与痴呆症风险降低29%之间相关联,而且疫苗接种剂量与痴呆症发病率之间也存在关联性。
致力于通过疫苗预防阿尔茨海默症的医学专家们持有乐观态度,Weinberg活跃在研究前沿,他与Steven Arnold博士和Denise Faustman博士合作研究,收集已接种过或未接种过疫苗的受试者中枢神经系统周围的脑脊液样本,他们的目的是检查疫苗触发的免疫训练效果是否能达到大脑。Weinberg说:“卡介苗接种后,这些免疫细胞对病原体的反应更加强烈了。”
根据世界卫生组织于2023年公布的统计数据,目前全世界有超过5500万人患有痴呆症,其中阿尔茨海默症是最常见的形式,可能占患病人数的60%至70%。[22]如果疫苗能够为治疗阿尔茨海默症发挥作用,那真是善莫大焉。
100多年前,卡尔梅特和介林在土豆片上的发现,让人类战胜了一种曾肆无忌惮夺取生命的可怕疾病;100多年后,卡介苗与阿尔茨海默症的意外联系是否会打赢另外一场战役,真实还是假象,科学终会给出答案。
参考文献:
[1] https://www.msdmanuals.cn/professional/neurologic-disorders/delirium-and-dementia/alzheimer-disease
[2] https://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1010929
[3] https://onlinelibrary.wiley.com/doi/10.1002/jmv.1890330403
[4] https://content.iospress.com/articles/journal-of-alzheimers-disease/jad171133
[5] https://www.alzcn.com/CN/10.3969/j.issn.2096-5516.2023.01.001
[6] https://www.sciencedirect.com/science/article/pii/S0896627318305269
[7] https://www.fda.gov/drugs/drug-approvals-and-databases/drug-trials-snapshots-aduhelm
[8] https://www.fda.gov/news-events/press-announcements/fda-converts-novel-alzheimers-disease-treatment-traditional-approval
[9] https://www.nejm.org/doi/full/10.1056/NEJMoa2212948
[10] https://www.mdpi.com/2076-393X/11/1/121
[11] https://www.cell.com/cell/fulltext/S0092-8674(20)31139-9?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS0092867420311399%3Fshowall%3Dtrue
[12] https://www.mdpi.com/2072-6694/14/13/3073
[13] https://www.pnas.org/doi/full/10.1073/pnas.2008410117
[14] https://www.sciencedirect.com/science/article/abs/pii/S096999611730030X?via%3Dihub
[15] https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0224433
[16] https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2805030
[17] https://www.frontiersin.org/articles/10.3389/fnagi.2023.1243588/full
[18] https://www.theguardian.com/society/2024/feb/25/is-the-100-year-old-tb-vaccine-a-new-secret-weapon-against-alzheimers-dementia-bcg
[19] https://www.mdpi.com/2076-2607/10/2/424
[20] https://www.sciencedirect.com/science/article/abs/pii/S0264410X21010793
[21] https://www.sciencedirect.com/science/article/abs/pii/S1568163721002816
[22] https://www.who.int/zh/news-room/fact-sheets/detail/dementia
[23] https://www.theguardian.com/society/2024/feb/25/is-the-100-year-old-tb-vaccine-a-new-secret-weapon-against-alzheimers-dementia-bcg
本文来自微信公众号:返朴 (ID:fanpu2019),编译:小叶,出品:中国科协科普部,监制:中国科学技术出版社有限公司、北京中科星河文化传媒有限公司,本文受科普中国·星空计划项目扶持

