流行性感冒病毒严重威胁着人类的健康,在历史上引起多次大流行。1918年流感大流行感染了约5亿人,造成了5000万人死亡(也有估计死亡1亿人)。2009年流行性感冒造成全球约五分之一人口感染,感染死亡人数在15到57万人,是世界卫生组织(WHO)认定的首个“国际关注的突发公共卫生事件”(PHEIC;该制度于《国际卫生条例(2005)》首次颁布)。更应当清楚的是,人类健康可能会永远笼罩在发生流感大流行的阴影之中。
流感病毒(Influenza viruses)是属于正黏病毒科的一类病毒,可以分为IAV(Influenza A viruses)、IBV、ICV、IDV四种(中文对应甲、乙、丙、丁)。甲型流感病毒具有广泛的宿主范围,乙型和丙型流感病毒的主要宿主是人类,而丁型流感病毒迄今已发现可感染牛、山羊和猪。人们一提起流感,一般指的是占少数高致病性的甲型流感病毒。其他种类的流感病毒,以及甲流中多数血清型的病毒不具有强致病性,仅可导致普通感冒;约10%~15%的普通感冒是由流感病毒造成的。
那是不是只要消灭那些高致病性的流感病毒,我们就一劳永逸,彻底安全了呢?抱歉,“甲型流感病毒圈儿”有一套“修炼成魔”的路子。
流感病毒好有“型”
流感病毒多样性很高,可分为多种型。
所谓的“甲型”流感的“型”,是物种的概念,由病毒基因序列决定。整个甲型流感病毒物种也分为不同的“型”;这里的“型”指的是流感病毒血凝素(Hemagglutinin,HA或H)和神经氨酸酶(Neuraminidase,NA或N)的血清型组合。
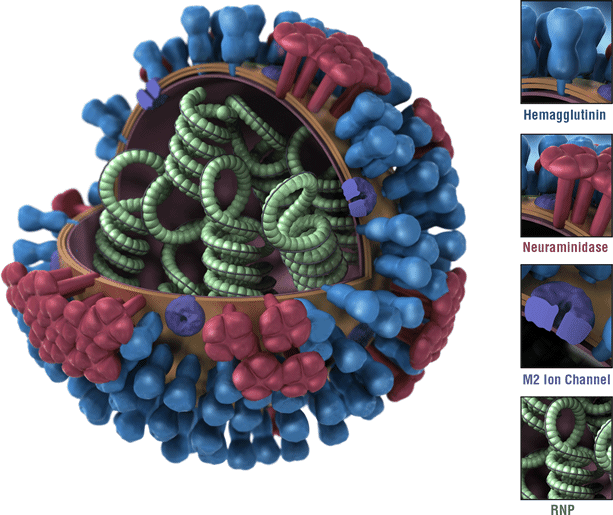
图1 流感病毒模式图。流感病毒是一种有包膜的、含分节段基因组的RNA病毒,其包膜上主要含有血凝素(蓝色)、神经氨酸酶(红色),其基因组由8个RNA片段组成(绿色)。图片来源:cdc.gov
流感病毒是包膜病毒,它的包膜蛋白主要是血凝素和神经氨酸酶,它们在病毒的侵染和释放中起到重要作用。这些蛋白位于病毒颗粒的表面,也是宿主体液免疫所产生抗体结合的重要靶位。不同流感病毒的血凝素和神经氨酸酶略有差异,因此诱发的抗体特异性也有所不同。若一群病原体具有相同的血清型,意味着这些病原体诱发的抗体(主要取自血清进行检测)具有相同的特异性。
目前发现甲型流感病毒有18种不同的血凝素血清亚型和11种不同的神经氨酸酶血清亚型。而两者血清型的组合,即“型”,例如H5N1型流感病毒的HA为5亚型,NA为1亚型。不难算出,理论上甲型流感病毒的可能有18×11=198个型。目前自然界中已鉴定出130多种甲型流感亚型组合,主要来自野生鸟类。[1]
流感病毒的“型”具有重要的生物学意义,其反映了病毒的宿主范围、疾病严重程度,是流行病学监控追踪病毒传播和变异的重要指标,也决定了疫苗设计生产、疾病治疗等重要问题。
流感病毒真能“行”
流感病毒的宿主范围很广,“天上飞的、水里游的、地上跑的”无所不染。天上飞的包括鸟类和蝙蝠,水里游的指海洋哺乳动物(不是鱼),地上跑的包括人类在内的哺乳动物、鸵鸟(好严谨)。甲型流感病毒借着宿主之便,全面占领陆海空。
对于甲型流感病毒,最值得关注的是存在于候鸟中的禽流感病毒(AIV)库,特别是野生水鸟群体体内存在大量且多样化的甲流病毒储存库。禽流感对鸟类的危害较小,大多感染通常无症状。但是,随着鸟类的活动和迁徙,可将禽流感传染给家禽和家畜等与人类密切接触的动物群体,进而造成人类的感染。
人的流感病毒也可以感染猪。以猪为中间宿主,各种来源的流感病毒共同感染同一只猪,造成混合感染,就有可能产生容易感染人类的流感突变株。这种候鸟→家禽→猪→人的病毒宿主迁移和突变网络,使消灭流感成为不可能完成的任务,让人类健康随时暴露在流感大流行的威胁之中。
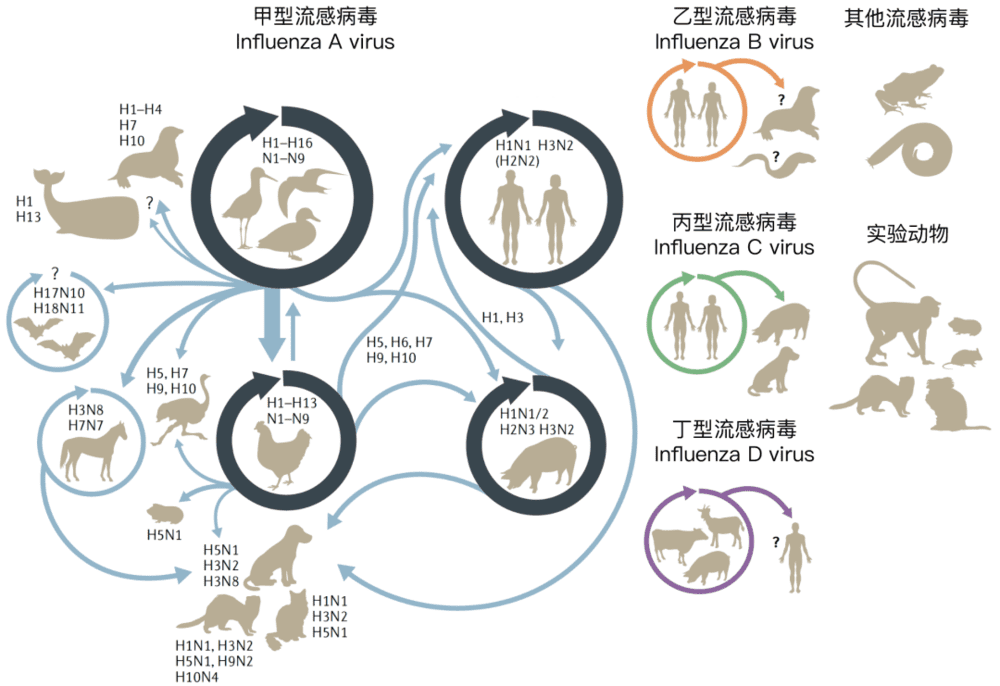
图2 不同流感病毒及其宿主。甲型流感病毒主要宿主群体是野生水鸟、家禽、猪和人类,不同宿主群体具有相对固定的流感病毒型持续传播(深色环状箭头)。通过宿主跃迁,这四个主要宿主群体所感染的甲型流感病毒可感染其他动物(浅色箭头)。图片来源:参考文献[2]
禽流感的“罩门”
鸟类患流感的几率和病毒多样性均很高,但是由野生鸟类或家禽将禽流感直接传染给人类并不那么容易发生。感染禽流感的高危人群主要为畜牧和兽医从业者、活禽市场的销售人员和宰杀处理者。这是因为,流感病毒结合并侵入细胞是由病毒表面血凝素与细胞表面多糖之间的特异性结合所介导而起始的。不同型的流感病毒感染不同宿主的能力,是由病毒血凝素及细胞多糖种类和分布决定的。
流感病毒用自身病毒血凝素(能够特异性识别多糖的蛋白质,也称为凝集素)识别细胞表面的多糖,进行特异性吸附并启动侵入过程。禽流感病毒主要识别并结合多糖末端的唾液酸α-2,3半乳糖(唾液酸通过α-2,3化学键连接半乳糖,这两个糖分子位于多糖末端,可被禽流感病毒识别),这种多糖存在于鸟类的整个呼吸道和消化道。而人类上呼吸道(鼻黏膜、副鼻窦、咽、气管)和支气管中主要存在的是唾液酸α-2,6半乳糖。禽流感病毒所心心念念的唾液酸α-2,3半乳糖主要存在于人的支气管和肺泡中。
所以说,一个禽流感病毒“跋山涉水”好不容易到养鸡场作妖一通,想进一步祸祸人类的时候,还要面临如何直达肺泡的挑战。这大概只能在人与家禽“紧密接触并且深呼吸”的时候才可能出现。不难想象,得禽流感的患者,症状往往比较严重——肺炎(因为禽流感感染的是肺部)。
一旦人被鸟类传染禽流感,是不是也会将禽流感传染给其他人呢?这取决于禽流感在人类之间能不能有效传播。在不发生突变的情况下,禽流感病毒感染新的人类宿主时,同样面临着病毒与上呼吸道组织的附着效率低下、细胞受体难以触及的问题。即便成功感染上呼吸道,禽流感病毒在这些组织中的病毒复制水平较低。
另一方面,病毒能够有效传播,除了能够侵染和复制之外,还需要有效地散播新的病毒颗粒。流感病毒在离开宿主细胞的时候,会通过神经氨酸酶,将赖以入侵的多糖受体切割;避免由于新病毒与细胞受体的识别和结合,导致新病毒困在细胞表面或糖蛋白上传播不出去。而禽流感病毒的神经氨酸酶不能有效地切割人类细胞表面受体,因此病毒颗粒雾化不良,难以脱离感染部位并通过飞沫传播出去。综上因素,禽病毒不能有效地通过空气传播途径在人与人之间传播。
与禽流感不同,人流感病毒的受体为多糖末端的唾液酸α-2,6半乳糖,飞沫传播的流感病毒很容易在上呼吸道找到侵染位点,并建立感染。神经氨酸酶也可正常发挥作用,产生并散播出去的新病毒可继续感染其他细胞或宿主。值得注意的是,由于唾液酸α-2,6半乳糖也分布在支气管和肺泡,因此流感有可能发展为肺炎,造成严重后果。
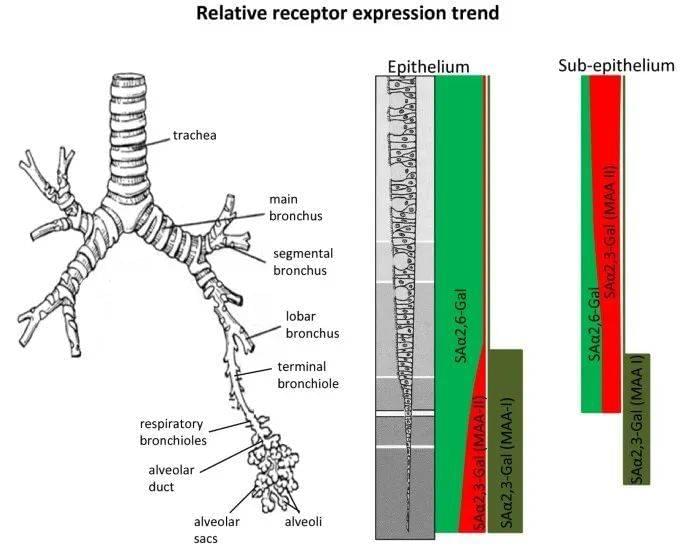
图3 人类呼吸道多糖种类及分布。唾液酸α-2,6半乳糖分布于整个呼吸道(绿色所示),唾液酸α-2,3半乳糖主要分布于支气管和肺泡(红色、深绿色所示)图片来源:参考文献[3]
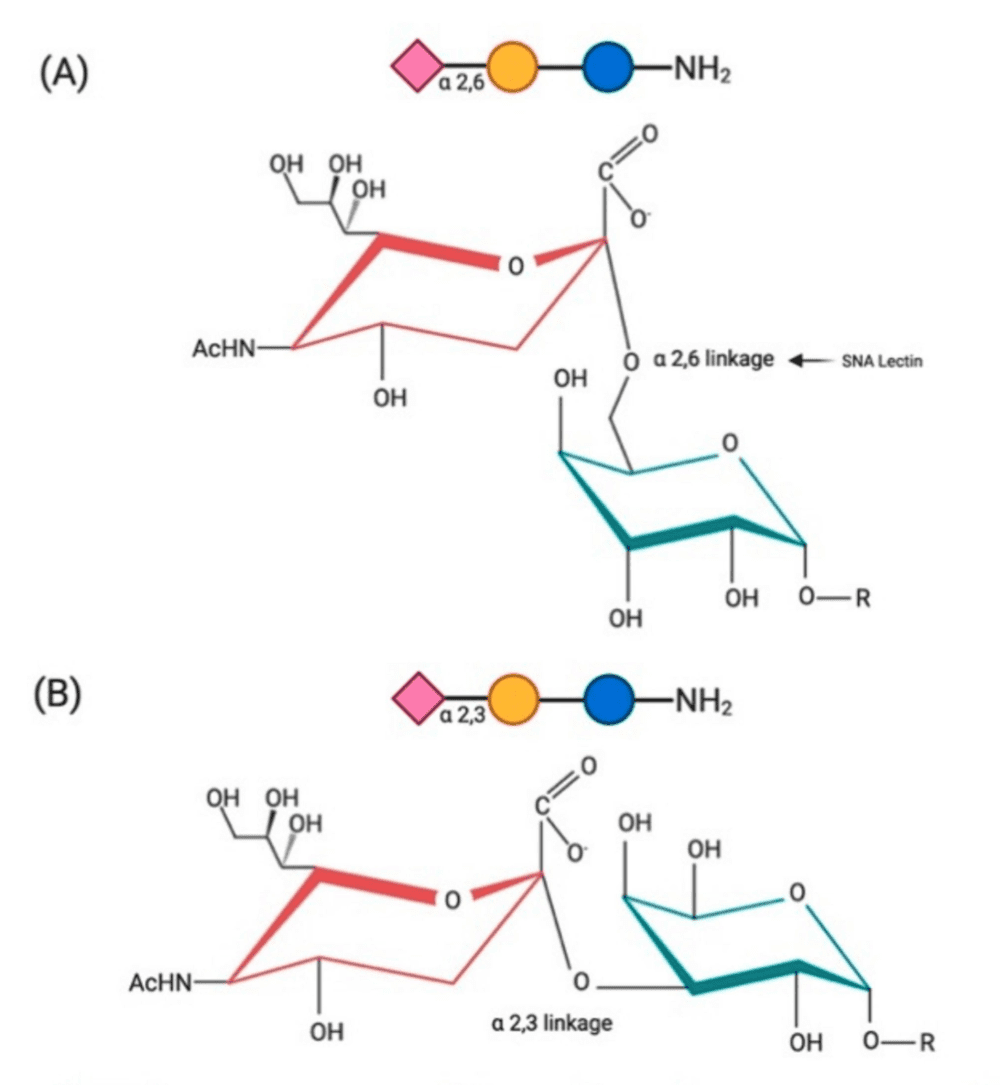
图4 生死就在一“化键”。A为唾液酸α-2,6半乳糖连接,B为唾液酸α-2,6半乳糖连接,其中红色为唾液酸、绿色为半乳糖,唾液酸连接到半乳糖上的位置不同。图片来源:参考文献[4]
流感病毒的“法门”
“突变”是病毒繁衍生息的不二法门。点突变、重组,都不在话下,流感病毒还具有独特的重排技能(参见《传播力胜过SARS,需要担心新冠病毒变异吗?》)。借助这三种突变手段,它们就有可能突破原有宿主范围,实现“宿主跃迁”。
所谓重排,是指分节段基因组病毒的基因组分子重新组合。流感病毒含有8个RNA片段的分节段基因组,如果细胞感染了两种或以上不同的流感病毒,则两种病毒的RNA都会在细胞核中复制。当新的病毒颗粒在质膜上组装时,它会在原有的两套基因组中随机选择8条进行组合,从而产生新的病毒基因组,这个过程就是重排。新病毒被称为重配子。
哺乳动物流感和禽流感病毒之间RNA片段的重排交换,造成病毒特性的大幅度变化(比如抗原性的“抗原转变”),可能产生更易传播的突变病毒,能够引起流感大流行。相比之下,流感病毒也可以通过点突变的方式逐渐适应新宿主,其中点突变造成的抗原性变化称为“抗原漂变”。
流感病毒的猪队友
在青蛇精的“帮助”下,七个葫芦娃可以修炼成一个金刚葫芦娃。那么谁来帮助流感病毒修炼成魔呢?答案是:猪。
在冠状病毒感染人过程中,蝙蝠的作用几乎已经定案;虽然蝙蝠也感染流感,但是蝙蝠传染流感给人类的案例未见报道。在传播流感方面,猪可以说是超强“猪队友”——是野鸟→家禽→猪→人的传染链条上的重要成员。
从生物学上说,猪的呼吸道兼具人和鸟类的多糖受体特征:富含α-2,6半乳糖和唾液酸α-2,6半乳糖两种多糖。所以说,猪可以较好地感染禽流感、人流感和猪流感。这些病毒在猪体内同时存在时,就有概率组合出兼具人流感的传播性和禽流感致病性的重组病毒。因此,猪成为流感病毒的混合器,加速了病毒演化过程。
2009年的H1N1型流行毒株是禽、人和猪三种流感病毒的重配体。而在这个过程中,起关键作用的就是猪——鸡、鸭可以感染来自野鸟的禽流感,并传染给猪;猪也可以感染人的流感病毒,猪同时感染两种或两种以上流感病毒,它们在猪体内发生基因重排,就会产生能感染人的强毒力流感病毒。
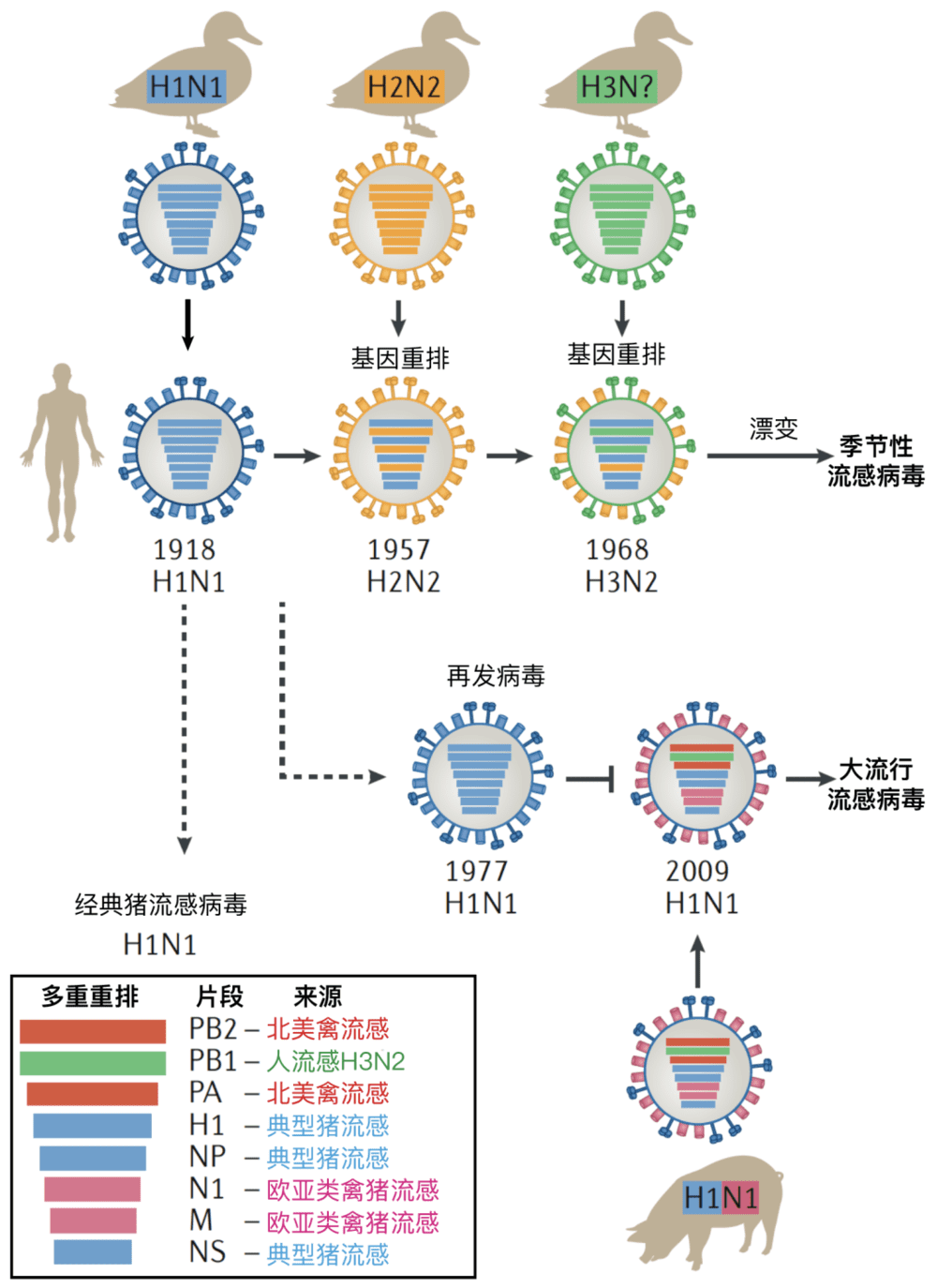
图5 历史上重要的流行及重排事件。1918年流感大流行是来源于鸟类的禽流感毒株造成的,其在1977年再次于局部地区流行。2009年大流行的猪流感病毒,是猪体内发生的,至少三种流感病毒重排产生的病毒。季节性流感病毒的流行变化,除了来自鸟类天然病毒储库的基因重排发生型的变化(抗原转换)外,主要原因是病毒通过点突变造成抗原漂变,逃逸原有人类群体免疫,因此造成再次流行。图片来源:参考文献[5]
流感病毒到底需要“多幸运”
目前只有H1、H2和H3亚型自然适应了感染人类。其他血凝素要想感染人,必须发生适应性突变。血凝素受体结合位点的氨基酸替换是改变多糖结合特性,促进宿主跃迁所必需的。这个过程就相当于对钥匙进行改造,把不同病毒所携带的钥匙(血凝素)改造成能够打开细胞锁(多糖)的过程。而病毒血凝素多糖结合位点的一系列氨基酸残基相当于钥匙上的齿儿。导致受体结合特性改变的特定氨基酸取代对于每种血凝素亚型都是不同的。
为了有效感染人类,病毒必须获得对人类受体的偏好,或者至少具有除了禽类受体之外,还与人类受体具有弱结合的能力,才能成功感染上人类呼吸道中的上皮细胞,并在其中复制。为了实现人与人之间的有效传播,流感病毒还需要减少与禽类受体的结合。这是因为人类上呼吸道上覆盖着含有α-2,3连接的唾液酸受体的分泌型黏蛋白分子,这些黏蛋白不能介导病毒入侵细胞,但可以结合病毒颗粒。而黏蛋白分子与呼吸道上皮紧密结合,导致病毒不太可能通过咳嗽或打喷嚏产生的飞沫排出呼吸道。
病毒是一类没有细胞结构的专性胞内寄生物,其只携带少量基因供自己使用,大部分病毒复制所需要的条件由细胞提供。因此,感染不同宿主或细胞类型的病毒,往往适应其所感染的细胞类型,利用宿主细胞的条件进行复制。换一种物种或细胞类型,病毒的复制过程可能就会出现问题。这种特性称为病毒感染的特异性。病毒感染特异性是病毒复制整个过程的综合体现。导致甲型禽流感病毒宿主跳跃的决定因素很复杂,涉及多种病毒和宿主因素。前述受体的突破只是其中一个相对重要的点。
禽流感克服物种限制并引发新的大流行所需的流感病毒适应性突变积累还有:(1)复制酶特定突变积累;(2)对受体的亲和性改变;(3)病毒颗粒融合pH与人体相符;(4)病毒颗粒的稳定性增加;(5)对限制因子的逃避或抵抗。
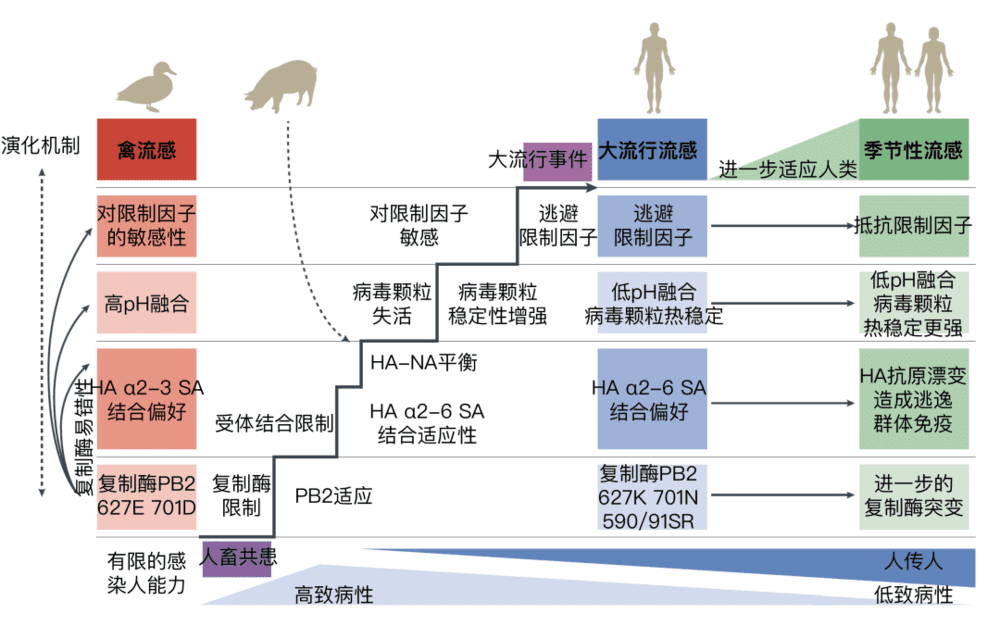
图6:禽流感进行宿主跃迁并发展成为大流行流感或季节性流感的过程。图片来源:参考文献[7]
人类到底需要“多努力”
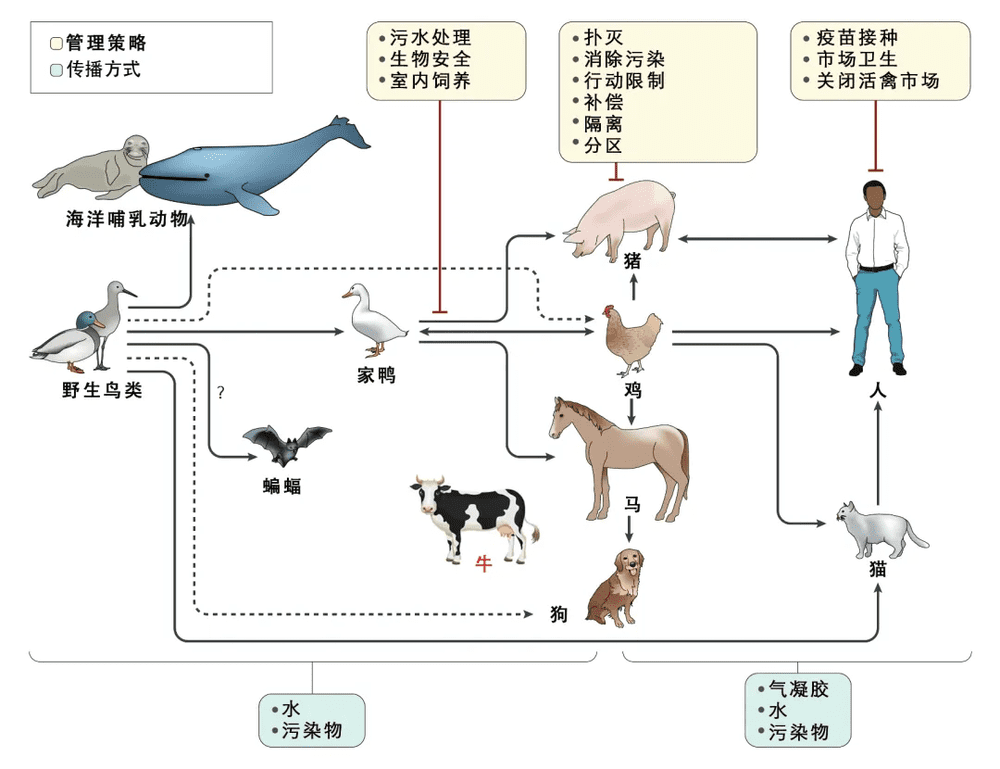
图7 流感病毒的传播及其管控。流感病毒可以经由广泛的宿主范围最终传染给人类。流感病毒源头主要是野生鸟类,而必不可少的中间宿主主要是家禽、猪,还有猫。最新发现,牛也可充当禽流感的“中继站”。
从病毒与宿主的演化关系上来说,病毒最终“目的”不是杀死宿主,而是复制自我。新近感染人类的病毒致病性较强,而与人类具有长期共处历史的病毒往往不具有极强的致病性(病毒被人类所筛选,而人类的免疫状态也不断在完善,以新冠病毒和HIV为例,与出现之初相比,疾病严重程度下降显著)。禽流感病毒最终可能演化为季节性流感:持续在人群中存在,传播性强,但是致病性较差。但是在这个转变过程中,可能出现给人类造成严重灾难的大流行流感:感染性很强,致病性也很强。这是我们所不希望看到的。
鉴于流感病毒的“修炼”能力,持续关注并遏制流感病毒对人类健康的威胁是病毒学家的重要工作。最近在美国发现,牛可感染H5N1流感病毒,引起了全世界的警觉(牛通常只感染丁型流感);更严重的是,首次确认了奶牛将H5N1流感病毒传染给人类(以及猫)的案例。这给我们揭示了一个重大的隐患:禽流感病毒是否正在适应哺乳动物传播——它找到了除猪之外的新路子,甚至可能在人类之间传播。
“同一个世界,同一个健康”,我们关心动物健康事业的发展,除了能够保护野生动物,推进畜牧业发展之外,也是关心我们人类自身的健康。禽流感在家禽、家畜中的流行会重创养殖业,造成经济损失之外,也是人流感大流行的“机会之窗”。为了管控流感传播,需要在中间宿主与野生鸟类接触面、中间宿主、中间宿主与人类接触面上采取措施。对于广大读者来说,注射流感疫苗,避免与活禽、野鸟直接接触,是最重要的防范措施。
参考文献:
[1] https://www.cdc.gov/flu/about/viruses/types.htm
[2] Long, J.S., Mistry, B., Haslam, S.M. et al. Host and viral determinants of influenza A virus species specificity. Nat Rev Microbiol 17, 67–81 (2019). https://doi.org/10.1038/s41579-018-0115-z
[3] Nelli, R.K., Kuchipudi, S.V., White, G.A. et al. Comparative distribution of human and avian type sialic acid influenza receptors in the pig. BMC Vet Res 6, 4 (2010). https://doi.org/10.1186/1746-6148-6-4
[4] Kuchipudi, Suresh V. et al. “Sialic Acid Receptors: The Key to Solving the Enigma of Zoonotic Virus Spillover.” Viruses 13 (2021): n. pag.
[5] Long, J.S., Mistry, B., Haslam, S.M. et al. Host and viral determinants of influenza A virus species specificity. Nat Rev Microbiol 17, 67–81 (2019). https://doi.org/10.1038/s41579-018-0115-z.
[6] Long, J.S., Mistry, B., Haslam, S.M. et al. Host and viral determinants of influenza A virus species specificity. Nat Rev Microbiol 17, 67–81 (2019). https://doi.org/10.1038/s41579-018-0115-z.
本文来自微信公众号:返朴 (ID:fanpu2019),作者:李庆超(山东师范大学),出品:科普中国

