对于很多患者,器官移植是挽救生命的最后希望。然而,全球范围内的器官移植面临着严重的缺口。世界卫生组织估计,在需要进行器官移植的人群中,实际能得到器官的人不足10%。更多人直到生命尽头,也等不到合适的器官。
在解决器官移植问题的潜在方案中,异种器官移植似乎受到了更多关注。2022年,首例猪心脏移植人体的手术进行。接受一颗经过基因编辑的猪心脏移植后,患者在存活60天之后死亡。与此同时,猪肾脏移植试验也已在脑死亡人体中进行。这些突破展现出了异种器官移植的潜力,但猪器官在人体内的长期免疫排斥、病毒感染以及引起功能障碍等风险仍无法排除。
另一种极具潜力的解决思路可以说是反其道而行之,那就是器官异种再生——在动物身上“种植”出可供移植的人类器官。为此,科学家需要将人多能干细胞注入另一种哺乳动物的胚胎,通过这样的胚胎补偿技术,在哺乳动物体内培养出人类器官组织。
此前,科学家已经在小鼠与大鼠之间实现了胰腺、肾脏等器官的异种嵌合体培养。然而,要利用这项技术种植出人类器官,却面临着巨大的挑战。
由于生理、器官大小以及胚胎发育方面与人类的相似性,猪成为“种植”人类器官的热门目标。2017年的一项研究首次培养出人-猪嵌合体胚胎,并在猪体内发育了3~4周,但其嵌合效率很低。一大难点在于,要获得高度嵌合的胚胎,人源细胞必须要竞争过囊胚中的猪细胞;但在实际场景中,猪胚胎可以利用细胞竞争机制消灭外来的人类干细胞,因此难以在亲缘关系较远的物种中长出人类器官。
9月7日,一项发表于《细胞-干细胞》(Cell Stem Cell)的最新研究取得了重要突破!研究团队通过一系列创新手段解决了上述障碍,将人-猪嵌合体胚胎移植至母猪体内后,成功培养出人源中肾(肾脏发育的中间阶段)。28天后,这枚中肾具备正常的肾脏结构,肾小管等功能结构也顺利形成。这是科学家首次实现人源功能性实质器官的异种体内再生,为再生医学发展、肾脏发育研究开启了全新的道路。中国科学院广州生物医药与健康研究院赖良学研究员、戴祯研究员、Miguel A. Esteban研究员以及潘光锦研究员为论文共同通讯作者。

肾脏是人体发育最早的器官之一,也是医学领域移植需求最大的器官之一。在发育过程中,先后出现前肾、中肾和后肾三个阶段。随着中肾的退化,后肾起源于输尿管芽和后肾间充质。
此前对不同哺乳动物肾脏发育的研究,找到了两个在上述肾脏发育过程中起到关键作用的基因:SIX1调节中肾小管的形成,以及后肾发生过程中的输尿管芽分支;SALL1在后肾间充质中维持肾单元祖细胞和新生肾单元。
因此,如果通过基因工程敲除这两个基因,SIX1/SALL1缺失的猪胚胎将产生肾脏的生态位空缺,表现为中肾发育缺陷、后肾缺失。在这样的环境中,外来的人多能干细胞就避免了与猪细胞的竞争。
仅仅改造猪胚胎还不够,研究团队还对人多能干细胞进行了改造。通过表达促生存基因MYCN和BCL2,可以暂时关闭细胞凋亡程序,让它们不易自毁,从而极大地增强了人多能干细胞的竞争能力。此外,研究团队还开发了一种新型培养基,使得人多能干细胞可以回到更早期的发育阶段,显著提升了跨物种嵌合的效率。在将嵌合胚胎移植进母猪体内前,研究人员在最佳条件下培养嵌合体,为其中的人、猪细胞提供各自需要的营养和信号分子。
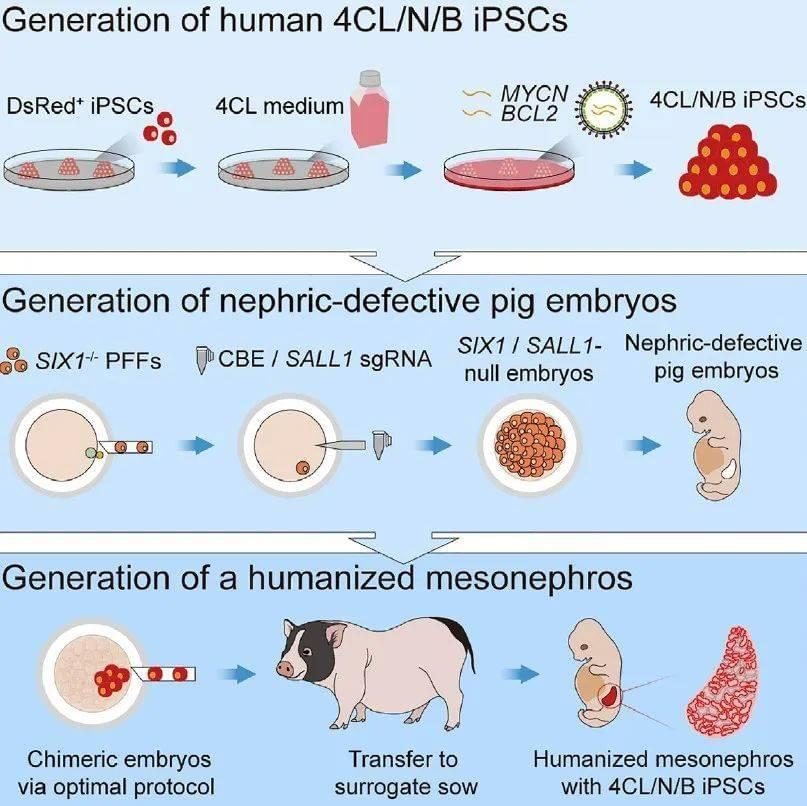
▲研究示意图(图片来源:参考资料[1])
基于这一系列改造措施,研究团队将嵌合胚胎移植进13只母猪体内,其中6只成功受孕。在25或28天后,研究人员终止妊娠并取出了5枚正常发育的嵌合体胚胎(其中两枚收集于移植后25天,另外3枚在28天),以评估嵌合体是否成功产生了人源肾脏。
分析结果显示,这些中肾具有正常的结构,其中人源细胞比例最高可达70%。这时中肾小管和输尿管芽已经形成,后者最终会发育为连接膀胱的输尿管。
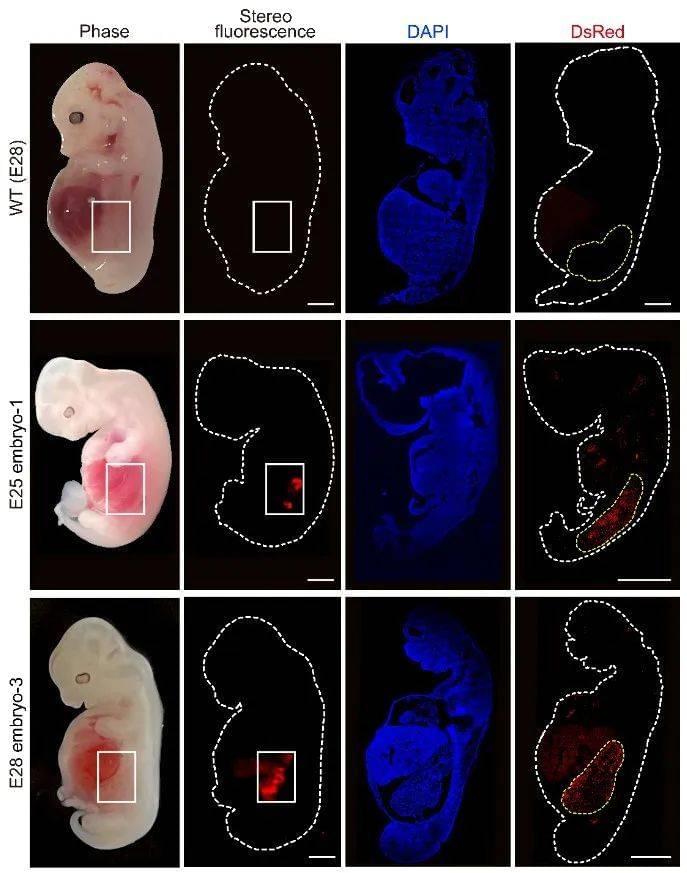
▲胚胎中的人源肾脏细胞(红色荧光区域)(图片来源:参考资料[1])
研究团队还发现,胚胎中的人源细胞主要定位于他们构建的肾脏生态位中,而胚胎的其余部分仍由猪细胞组成。研究人员在大脑和脊髓中只发现了极少数的人源神经细胞;在生殖嵴中没有发现人类细胞,表明人多能干细胞没有分化为生殖细胞。这一结果也支持了该策略在伦理上的可行性。研究人员表示,通过敲除人多能干细胞中的更多基因,有希望进一步避免人源细胞出现在神经、生殖系统中的风险。
由此,这项研究证实了通过改造人多能干细胞、优化胚胎补偿技术,能够在肾缺陷猪体内培养出人源中肾器官。尽管该实验提前终止了妊娠,但取出的中肾功能表明,该策略有望在新生的猪体内“种”出具有生理功能的人源肾脏,为克服器官移植供体短缺的难题提供了具有吸引力的替代方案。
研究也指出,要实现用于人体器官移植的最终目标,仍有大量工作需要完成。除了进一步避免上述伦理问题,未来的研究还需要解决猪胚胎发育失败率高的问题。此外,由于器官由多种不同类型的细胞和组织组成,在猪体内长出功能齐全的人源化器官需要一些额外步骤。在这项研究中,研究人员仅为一个亚群的细胞创造了有利的生态位,这意味着肾脏的血管细胞仍是猪源性,如果用于器官移植,可能会引起器官免疫排斥。而在最终用于器官移植之前,这项技术还为研究人类器官发育,追踪发育过程中的疾病、细胞谱系形成提供了新的机遇。
参考资料:
[1] Jiaowei Wang et al., Generation of a humanized mesonephros in pigs from induced pluripotent stem cells via embryo complementation. Cell (2023). DOI: 10.1016/j.stem.2023.08.003
本文来自微信公众号:学术经纬 (ID:Global_Academia),作者:药明康德内容团队

