本文来自微信公众号:学术经纬 (ID:Global_Academia),作者:药明康德内容团队,原文标题:《<自然>重磅:被忽略百年的发现终获证实!阿尔茨海默病的隐藏“元凶”找到了》,题图来自:视觉中国
一个多世纪前,德国精神科医生阿洛伊斯·阿尔茨海默(Alois Alzheimer)接诊和治疗了一名患有特殊症状的患者,她伴有短时记忆丧失、认知功能障碍的症状。随着病情加重,患者最终因这种奇怪疾病去世了。
阿尔茨海默医生在检测她的大脑样本后,发现了两个明显的特征——神经炎性斑块和神经缠结,而之后有着类似症状和病理特征的疾病也被命名为阿尔茨海默病(AD)。在后续多年的研究里,β淀粉样蛋白(Aβ)斑块与Tau蛋白导致的神经缠结成为了AD研究领域的重点。而FDA近20年来完全批准的首款AD治疗药物,其原理就是通过减少大脑中的淀粉样蛋白沉积发挥作用。
不过,Aβ斑块与神经缠结并非阿尔茨海默医生当初的所有发现,他曾在样本描述中还指出,患者大脑中的胶质细胞内部存在脂质小囊。不过,这种胶质细胞与脂质(glial-lipid)的病理特征并没有受到太多的关注。
3月14日,《自然》杂志上发表了一项来自斯坦福大学Tony Wyss-Coray教授团队的重磅论文,研究团队发现了一种由脂滴相关酶ACSL1定义的小胶质细胞状态。根据论文,那些基因型为APOE4/4的患者,表达ACSL1的小胶质细胞数量更高,并且AD发生的遗传风险与小胶质细胞的脂滴(lipid droplet)累积存在联系,该发现或将为AD疗法带来全新的治疗靶点和策略。

研究提到的APOE基因负责编码载脂蛋白E,参与着细胞的脂蛋白转化与代谢。同时,它也是预测AD发生风险的重要遗传因素,与携带APOE3的人群相比,携带2个APOE4拷贝的人患AD的风险要显著更高。
新研究中,作者收集了具有APOE4/4基因型的AD患者的大脑皮质组织样本,并且对其进行了单核RNA测序分析,对照组则为具有APOE3/3的AD患者样本。研究在大脑主要细胞类型中产生了约10万个单核转录组,他们重点关注了小胶质细胞的差异。
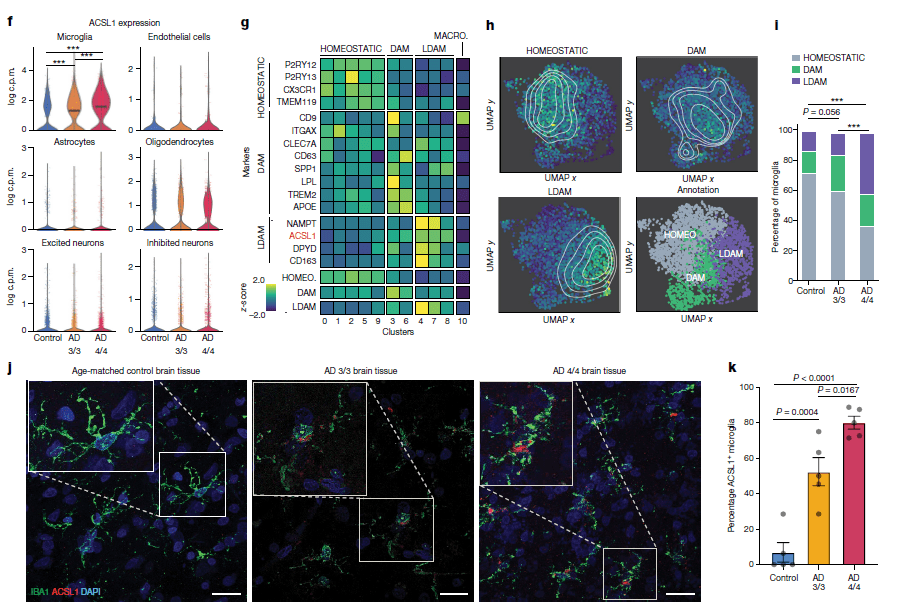
图片来源:参考资料[1],研究发现了一类特殊的小胶质细胞,其表达ACSL1且脂质合成活跃
与对照相比,APOE4/4个体的小胶质细胞,差异最大的是编码脂质处理酶ACSL1的基因,而ACSL1恰好是脂滴生物发生的关键。而根据样本的细胞染色分析,那些充满脂质的细胞大多都聚集在Aβ斑块周围,与此相似的是,那些表达ACSL1的小胶质细胞也倾向于聚集在Aβ斑块附近,这也暗示两者可能就是同一类细胞。
此外,作者在诱导多能干细胞生成的小胶质细胞模型中引入纤维状的Aβ,可以直接诱导细胞ACSL1的表达,甘油三酯合成以及脂滴的累积,并且上述变化在APOE4/4基因型的细胞中显著更高。
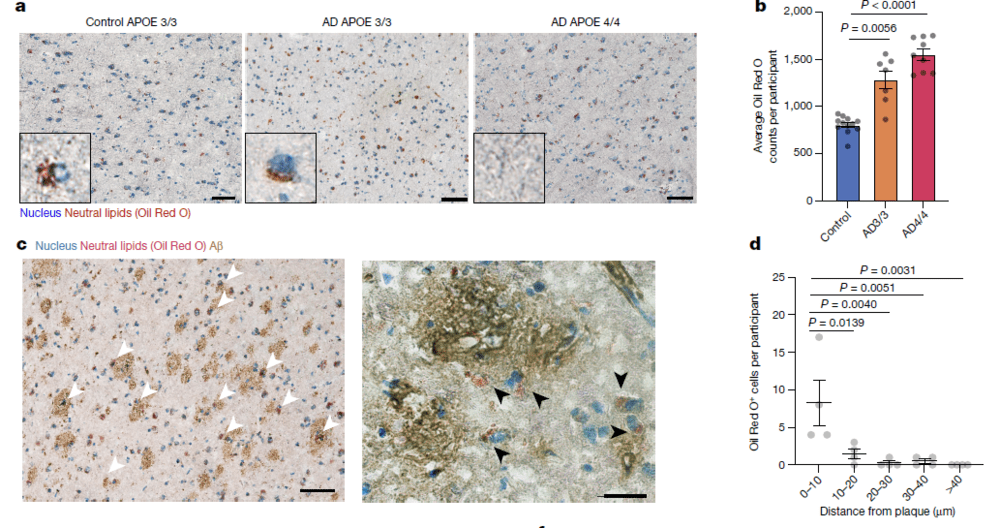
图片来源:参考资料[1],脂质累积与AD病理发展相关
作者指出,ACSL1的高度表达已经可以用于定义小胶质细胞的一种独特状态,他们将其称作LDAM,代表着与脂滴相关且与疾病相关的小胶质细胞。与健康个体相比,LDAM在AD个体大脑中更为普遍,尤其是在APOE4/4基因型个体中富集更加明显。
观察结果显示,AD患者的神经元并不会上调ACSL1,因此他们推测在神经元里发现的过量脂质也可能来源于小胶质细胞。尽管与阿尔茨海默医生的发现相距百年,但新研究终于证实脂质累积的确在推动AD的发生与发展,而该过程是由LDAM介导的,这一发现在未来或为AD治疗策略研发带来了全新靶点和方向。
参考资料:
[1] Michael S. Haney. et al. APOE4/4 is linked to damaging lipid droplets in Alzheimer’s disease microglia. Nature (2024). DOI: 10.1038/s41586-024-07185-7
本文来自微信公众号:学术经纬 (ID:Global_Academia),作者:药明康德内容团队

