本文来自微信公众号:学术经纬 (ID:Global_Academia),作者:药明康德内容团队,原文标题:《〈细胞〉:为了攻克这种常见疾病,科学家让小鼠长出了一颗人类的肝脏……》,头图来自:视觉中国
肝是人体的代谢枢纽,然而全世界超过15亿人正在受到慢性肝病的影响,包括酒精性肝病、非酒精性脂肪性肝病、病毒性肝炎、肝纤维化和癌症等。其中以非酒精性脂肪肝疾病(NAFLD)最为常见,在中国就影响了约2亿人口。
很多生物医学研究常会以小鼠作为实验模型,在同为哺乳动物的小鼠身上模拟很多与人类相似的生物学过程和疾病进展。然而小鼠与人类毕竟不一样,要在它们身上研究人类肝病一直很有挑战,一个重要的原因是小鼠肝脏的核心代谢功能与人类不同。曾有研究发现,使用同一种药物干预低密度脂蛋白胆固醇,在小鼠和人类中甚至会引起截然相反的作用。
为了解决这个难题,耶鲁大学的研究人员设想并实现了一种听起来不可思议的新方案:让小鼠长出一颗完整的人类肝脏。这项成果日前发表在顶尖学术期刊《细胞》上。
领导这项研究的是世界知名免疫学家Richard Flavell教授,他这样解释:“在肝脏内,各种类型的人类细胞以它们自己的语言相同交流。而小鼠细胞和人类细胞用的是不同的语言。现在,我们让人类肝细胞在活体小鼠体内可以用自己的语言交流。”

在论文中,研究人员详细描述了他们让小鼠长出“人源化肝脏”的方法。这颗肝脏主要来源于人类肝脏的祖细胞(干细胞)和成熟细胞(肝细胞),发育成熟后再现了人类肝脏的结构,与体型的相对大小更接近健康人的肝脏。更重要的是,其细胞功能与人类肝脏细胞十分相似,不仅可以执行具有人类特征的代谢和稳态过程,还可以用来模拟在人类非酒精性肝病和肝纤维化中发生的变化。
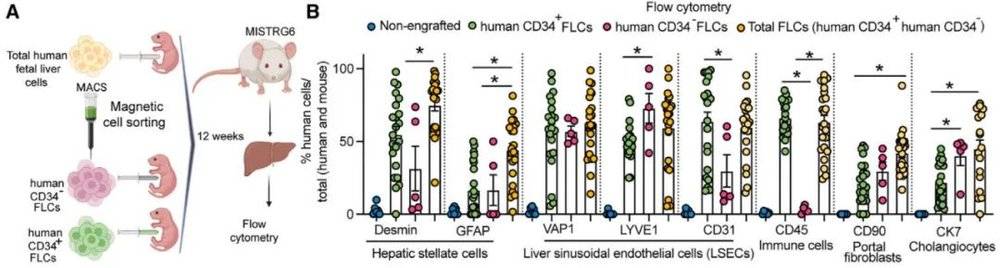
▲移植了人类肝细胞和人类免疫细胞的人源化小鼠模型(图片来源:参考资料[1])
这项研究还发现,人类肝细胞的基本代谢功能,例如调节胆固醇水平,并非由肝细胞自主实现,而是受到了内皮细胞等肝脏非实质性细胞(non-parenchymal cells,简称NPC)的控制。
这些内皮细胞位于为肝脏供血的血管。研究人员发现,它们通过人类特有的旁分泌机制控制着胆固醇向肝细胞的运送。具体来说,它们会分泌出一种名为WNT的信号分子,而人类肝细胞通过特异性受体FZD5接收这一WNT信号,然后调控胆固醇摄取、胆汁酸合成等一系列代谢功能。
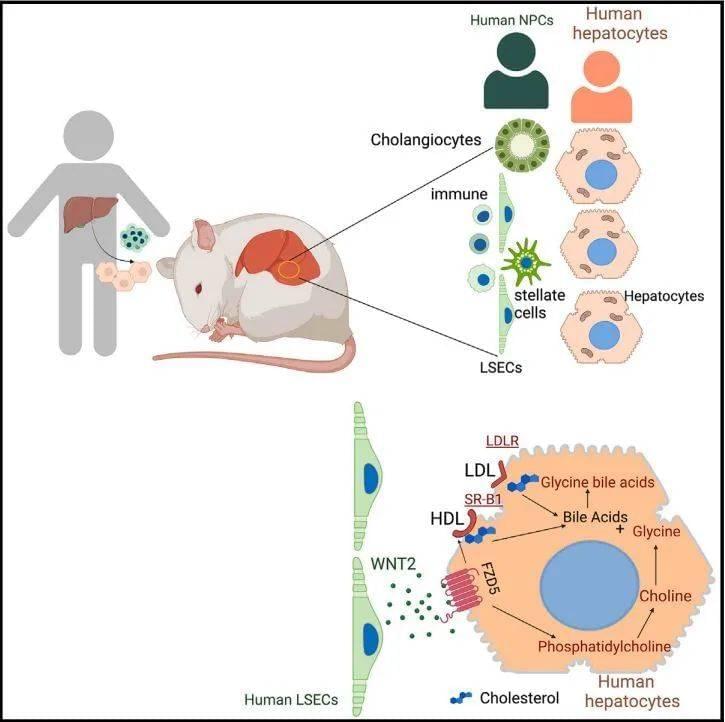
▲研究示意图(图片来源:参考资料[1])
研究人员指出,有了这种人源化肝脏模型,在为慢性肝病开发药物时,可以更准确地评估实验药物的安全性。而长期来看,科学家们的最终目标是找到预测、预防和治疗所有肝脏疾病的方法,
参考资料:
[1] Kaffe et al., Humanized mouse liver reveals endothelial control of essential hepatic metabolic functions, Cell (2023), https://doi.org/10.1016/j.cell.2023.07.017
[2] ‘Humanized’ liver in mice reveals roots of chronic diseases. Retrieved Aug. 9, 2023 from https://www.eurekalert.org/news-releases/997880
本文来自微信公众号:学术经纬 (ID:Global_Academia),作者:药明康德内容团队

