本文来自微信公众号:返朴 (ID:fanpu2019),作者:维罗妮卡(清华大学医学院),原文标题:《同样感染HPV,为什么有些人发展为宫颈癌,有些人却没事?》,题图来自:视觉中国
人乳头瘤病毒(human papillomavirus,HPV)与宫颈癌的发生发展密切相关,尽早接种HPV疫苗也已成为当今社会的女性共识。不过,感染HPV的人数众多,最终真正发展成宫颈癌的却数目寥寥。感染了高危类型,也只有一部分会发展为癌;而感染了低危类型,也不代表一定不会发展为癌,只是相对来说风险很低。如何更精准地预测宫颈癌的发生,是困扰科学家多年的难题。
早诊早筛对宫颈癌的预后尤为重要,可是从发现感染到确诊为宫颈癌,往往有长达十几年的过程,要保证十几年内定期反复检查诊断,对普通人来说成本太高、太难了。
今年初,来自中国的科学家团队首次提出了HPV在宿主细胞内分为两种整合状态,其中一种无害,另一种则与癌症进程紧密相关。这给宫颈癌的精准早筛带来了希望。
宫颈癌:女性健康的头号杀手
子宫颈癌(cervical cancer,简称宫颈癌)是最常见的妇科恶性肿瘤,在女性所有恶性肿瘤中发病率排在第四位,仅次于乳腺癌、结直肠癌和肺癌。全球每年新增宫颈癌病例约60.4万,新增死亡病例约34.2万。其中,近83%的新增病例和88%的死亡病例发生在中低收入国家(low- and middle-income countries)。我国每年新增宫颈癌病例数多达13.5万,造成了沉重的疾病与经济负担。
宫颈癌以鳞状细胞癌为主(80%~85%),宫颈腺癌也较为常见(15%~20%)。高发年龄为50~55岁,但近年来宫颈癌发病有逐渐年轻化的趋势。宫颈转化区(transformation zone),即柱状上皮与鳞状上皮相交接的区域,是宫颈癌的好发部位。
在转化区形成过程中,宫颈上皮化生(柱状上皮转化为鳞状上皮)过度活跃,再加上外来物质(如HPV、精液组蛋白等)的刺激,造成新生的鳞状上皮细胞存在不同程度的不成熟或分化不良,细胞核的异常有丝分裂象增加,逐渐形成宫颈上皮内病变(cervical intraepithelial lesions, CIN)。
根据2003年世界卫生组织(World Health Organization, WHO)的分类标准,宫颈癌的癌前病变可分为CIN1、CIN2和CIN3三类,分类依据是具有核异常有丝分裂象的细胞在宫颈鳞状上皮中所占据的比例。
CIN1又名极轻/轻度不典型增生(very mild/mild dysplasia),此类病变中具有核异常有丝分裂象的细胞不超过宫颈鳞状上皮的下1/3。以此类推,CIN2(中度不典型增生)指异常细胞不超过下2/3。CIN3包括重度不典型增生和原位癌,其中重度不典型增生指异常细胞超过下2/3,但未达鳞状上皮全层;而原位癌指异常细胞已占据上皮全层,但尚未突破鳞状上皮下基底膜。
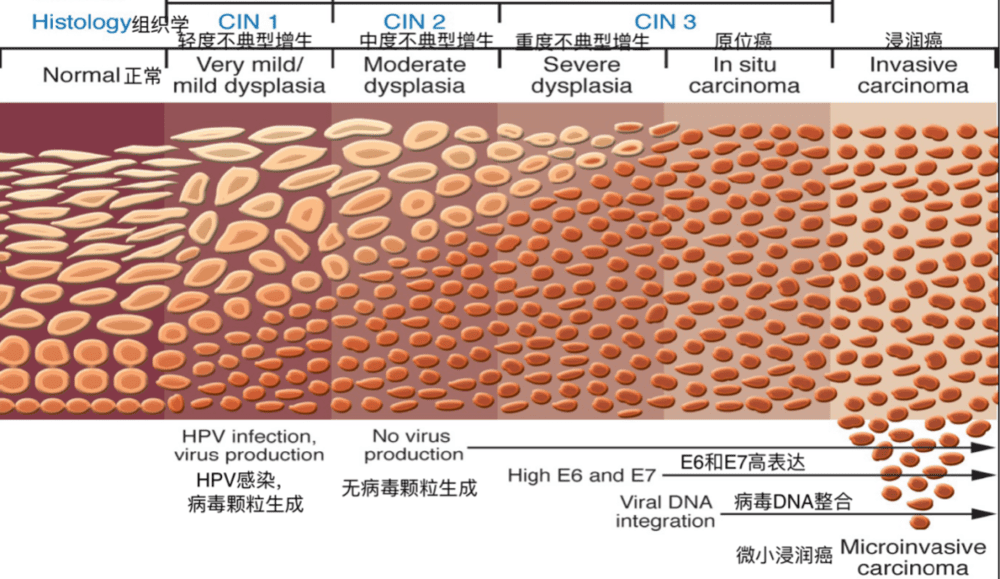
图1. 宫颈癌上皮内病变发展阶段。| 图源:Ortoski, R. A. (2011). Anal cancer and screening guidelines for human papillomavirus in men. The Journal of the American Osteopathic Association, 111(3 Suppl 2), S35–S43.
当宫颈上皮内病变进一步发展,突破上皮下基底膜,浸润间质,便形成了宫颈浸润癌。从宫颈上皮内病变发展成浸润癌是一个漫长的过程,通常需要10~15年的时间,但也有约25%的患者在5年内便发展至浸润癌阶段。
宫颈癌一般有哪些临床表现呢?早期宫颈癌通常没有明显的症状或体征,因此容易造成漏诊或误诊。随着病变进一步发展,最常出现的症状是阴道流血。早期多为接触性出血,即在同房后或妇科检查后流血;晚期多表现为不规则阴道流血,可无外因刺激。在未绝经患者中,也可以表现为经期延长和经量增多。另一个典型症状是阴道排液增多,排出的液体通常稀薄如水样或呈米泔状,外观为白色或带有血色,有一股腥臭味,与正常的白带有明显不同。
当肿瘤越长越大,压迫到周围的组织器官或走行的神经时,还可以出现尿频尿急(压迫膀胱)、便秘(压迫直肠)、下肢肿胀(压迫下肢血管)和疼痛(压迫神经)等非特异性症状。早期宫颈癌以手术切除为主,中晚期宫颈癌需采取手术联合放疗、化疗的综合治疗手段,且肿瘤复发率高,患者预后较差。因此,早诊早筛是改善宫颈癌预后的重要途径。
高危型HPV感染是宫颈癌发展的重要条件
人乳头瘤病毒(HPV)是嗜上皮性病毒,目前已确定的分型超过120种,其中近80种与人类疾病相关,而能影响生殖道的HPV型别超过35种。
HPV病毒颗粒由一条闭合环状双链DNA和一个20面体型的衣壳构成。HPV具有嗜鳞状上皮细胞特性,能够通过皮肤黏膜微小的破损进入表皮基底细胞,进行复制、增殖,造成上皮细胞的异常分化和增生,引起良性增生物形成。其传播途径主要包括性传播和接触传播,外伤或皮肤、黏膜破损是发生HPV感染的重要因素。
图2. HPV病毒颗粒示意图。| 图源:https://www.mdanderson.org/cancerwise/what-causes-cervical-cancer--6-questions--answered.h00-159543690.html
根据病毒导致癌变的可能性高低,可将HPV分为高危型和低危型。低危型HPV以6、11型为主(还包括42、43、44、81型等),与疣的产生密切相关,已知由HPV感染引起的皮肤病包括扁平疣、寻常疣、跖疣和甲周疣等。HPV-6、-11等型别能感染泌尿生殖道上皮,引起尖锐湿疣等良性病变。即使感染者没有表现出明显症状(比如长疣),只要病毒还处于活跃状态,也仍具有传染性。这些疣虽然看着可怖,但却是“无害的”,基本不会发生恶变,对患者整体健康的影响也极为有限。
高危型HPV以16、18型为主(还包括31、33、35、39、45、51、52、56、58、59、68型等),它们较少导致疣的产生,但能够引起癌症。值得警惕的是,这一过程往往是“静默无声的”——在癌症真正发生以前,患者通常没有任何症状。高危型HPV感染主要引起的是宫颈癌,但也能导致肛门癌、阴茎癌、喉癌、阴道癌和外阴癌。因此,男性感染高危型HPV后也有发生癌症的可能,但风险低于女性。
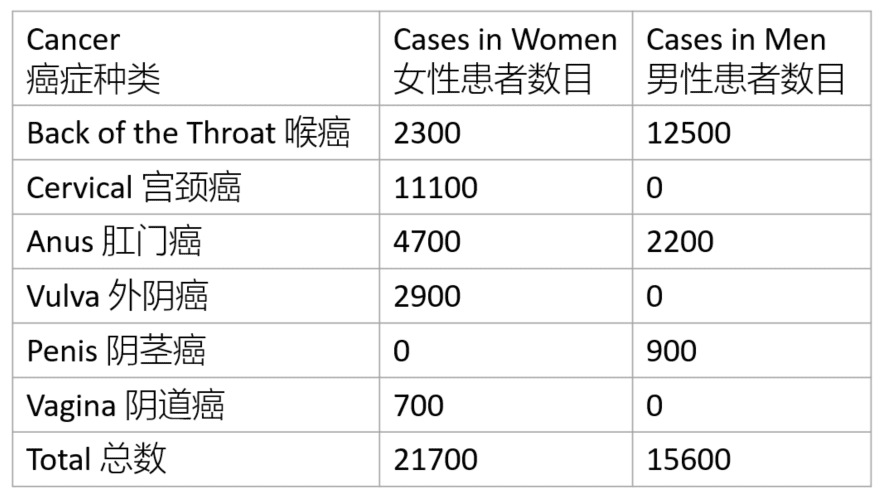
图3. 美国每年由HPV导致的癌症病例数。| 图源:https://www.cdc.gov/hpv/parents/cancer.html
根据美国疾控中心(Centers for Disease Control,CDC)统计,90%以上的宫颈癌与HPV感染直接相关。在这部分宫颈癌中,近半数是由HPV-16型感染导致的,还有20%为HPV-18型感染。其余高危型HPV感染,在宫颈癌中所占比例较低。
HPV感染在人群中极为普遍,是美国最常见的性传播疾病,全球每年感染HPV的人数接近1400万。据美国CDC报道,几乎所有未曾接种过HPV疫苗且性生活频繁的人,在其一生中都曾感染过HPV。到目前为止,人类仍未找到能对抗HPV的特效药物,但约90%的HPV感染都会在1~2年内被机体的免疫系统清除。
对抗HPV感染、预防宫颈癌发生的最有效途径是接种HPV疫苗。WHO推荐的HPV疫苗接种年龄是9~14岁,在初次性生活前接种疫苗效果最佳。即使错过了最佳接种时间,HPV疫苗仍能提供保护效果,所有年龄在9~45岁的女性均推荐接种HPV疫苗。
宫颈癌是唯一病因明确、可防可控的癌症,接种HPV疫苗后,免疫有效率可达90%以上。目前,我国多个省市已实现对14岁以下幼女提供免费HPV疫苗接种,这是我国卫生健康领域非常了不起的成就,也为实现WHO设立的“在2030年以前,全球超过90%的15岁以下幼女完成HPV疫苗接种”的目标贡献了一份力量。
最常见的二价HPV疫苗能够预防2个最主要的高危型病毒:HPV-16及HPV-18,而四价HPV疫苗在此基础上还额外覆盖了HPV-6及HPV-11(最常见的低危型),九价HPV疫苗覆盖的HPV型别更多。但比起追求疫苗的“价数”,尽早完成HPV疫苗接种更为重要。
HPV感染后,哪些人会最终发展成宫颈癌?
除接种HPV疫苗外,定期进行宫颈癌及癌前病变的筛查也是防治宫颈癌的重要手段。根据WHO的推荐,30~65岁的妇女不论是否接种HPV疫苗,均应定期进行HPV的筛查,高危妇女人群的起始年龄需相应提前。此处高危妇女人群是指艾滋病毒(HIV)感染、器官移植及长期应用糖皮质激素的妇女。HIV感染的妇女,发生宫颈癌的风险是普通妇女的6倍。
2013年,美国阴道镜和子宫颈病理学会(American Society for Colposcopy and Cervical Pathology, ASCCP)发布了宫颈癌筛查指南,建议30~65岁的妇女应每隔5年进行一次HPV病毒检测及宫颈细胞学筛查。两者同时进行,方法是通过阴道内窥镜打开阴道口,使用软毛刷刷取宫颈脱落细胞,再将这些脱落细胞收集起来,一部分送去做PCR(查HPV病毒),一部分做细胞学检查。取材过程在门诊诊室即可完成,无明显痛苦或不适。
HPV病毒检测包括HPV DNA及HPV mRNA检测,是一种客观、便捷、便宜的检测方式,容易在中低收入国家推广。检测的最佳时间是月经来潮后第10~18日,检查前48小时内需避免同房。
常用的细胞学筛查手段分为两种:巴氏涂片和TCT检查。巴氏涂片(Pap smear)即宫颈脱落细胞涂片,是将从子宫颈部刮取的少量上皮细胞,涂抹到载玻片上,经染色后在显微镜下观察细胞形态是否正常。高危男性群体,例如HIV阳性的男同性恋人群,也建议定期进行肛门巴氏涂片筛查。巴氏涂片简单而便宜,被广泛应用于普查,但缺点是标本中上皮细胞常堆叠在一起,影响观察,因而准确率不足。
图4. 显微镜下的宫颈鳞状上皮细胞。| 图源:https://www.the-scientist.com/news-opinion/why-some-hpv-infections-carry-more-cervical-cancer-risk-70931
TCT(Thinprep cytological test)检查的全名为“薄层液基细胞学检测”。细胞经固定、离心、制片、染色等多个步骤,可以获得更加清晰的图像。TCT准确率较高,但依赖专业的设备仪器,成本较高,因此一般建议在巴氏涂片中发现异常细胞的患者,应在一个月以后再行TCT检查。
HPV病毒检测及宫颈细胞学筛查,是宫颈癌“三阶梯诊断”的第一步。在发现异常细胞后,第二步是建议患者行阴道镜检查,而第三步是进行组织病理检查,包括阴道镜下取材活检、子宫颈管搔刮术(endocervical curettage, ECC)、电刀环切(loop electrosurgical excision procedure, LEEP)和冷刀锥切(cold knife conization, CKC)。
宫颈癌的发展是一个漫长的过程,通常需要10~15年的时间。这意味着感染高危型HPV的人群,需要在长达十几年的时间里,反复进行宫颈癌的“三阶梯诊断”。这需要耗费大量的人力和金钱,而且其中大部分患者都不会最终发展成宫颈癌。
HPV感染后,究竟哪些人会最终发展成宫颈癌?我们有没有办法在病毒感染之初,就做出精准的判断呢?今年一月,华中科技大学的马丁团队在《细胞基因组学》(Cell Genomics)期刊上发表了一项有关HPV DNA在宿主细胞中整合状态的研究,为回答这个问题带来了新的思路。
多组学分析揭开HPV DNA整合之谜
2014年,美国俄亥俄州立大学(The Ohio State University)学者阿卡吉(Keiko Akagi)发现HPV DNA能够整合入人类基因组,并导致染色体不稳定。研究者认为,这是宫颈癌发生发展过程中的关键病因学事件:80%以上的宫颈癌患者中存在HPV基因整合。
既往研究认为,HPV DNA在宿主基因组中的整合位点是随机分布的。然而,有研究者发现,在宿主基因组中的转录活性区域及癌症相关基因附近,常常能检测到HPV DNA的整合。关于整合在这些区域的HPV所发挥的作用,学界仍然存在争议。

图5. 美国学者阿卡吉的研究。| 图源:Akagi, K. (2014). Genome-wide analysis of HPV integration in human cancers reveals recurrent, focal genomic instability. Genome research, 24(2), 185–199.
美国匹兹堡大学(University of Pittsburgh)医学院的罗伯特·菲利斯(Robert Ferris)教授提出,HPV的整合位点不同,导致的基因损伤也不同,这或许能解释为什么HPV病毒对不同个体造成的影响不一样。每个人都暴露于HPV,但只有一小部分个体会罹患HPV相关的癌症。
那么,具体到患者个体,要怎么预测她是否会发展成癌症呢?
马丁团队首次提出,宫颈癌中HPV整合位点可分为转录型(productive)和沉默型(silent)两种类型,并通过多组学分析和单细胞测序描述了两种整合状态的不同分子特征。团队发现,沉默型整合往往是无害的,而转录型整合则与肿瘤侵袭、免疫逃逸和肿瘤进展密切相关,在宫颈癌的发病机制中起着重要作用。
美国密歇根大学(University of Michigan)的肿瘤学家黛安·哈珀(Diane Harper)认为,HPV基因能够整合入人类基因组的无数个位点,带来难以预测的结果,因此医生们通常将每个HPV感染患者都当作潜在宫颈癌患者来对待。而马丁团队的研究,“对于确定哪些整合位点存在高风险,哪些位点可以被忽视(从而让携带者感到安心),是非常重要的一步。”

图6. 马丁团队的研究。| 图源:Fan, J. (2023). Multi-omics characterization of silent and productive HPV integration in cervical cancer. Cell genomics, 3(1), 100211.
马丁团队首先确定了不同HPV基因整合位点的特征。研究者收集了来自98位女性宫颈癌患者的肿瘤组织及邻近正常组织样本,进行多组学分析(multi-omics analyses)。多组学分析是如今医学研究领域中的热点,广泛应用于多种疾病的研究。
本项研究中用到的多组学分析手段包括高通量HPV捕获测序(high-throughput HPV capture screening)、全外显子测序(whole-exome sequencing)、转录组学测序(transcriptome sequencing)、蛋白质组学(proteomics)和磷酸蛋白组学(phosphoproteomics)。
在这98位患者中,仅有6位患者未检测出HPV DNA整合位点,2位患者为HPV阴性。通过多组学分析,研究者发现,部分HPV整合位点能增加HPV-宿主融合DNA的转录水平,这些位点集中分布于人类基因组上的一些特定位置,且与某些特殊的DNA序列相关。
此类位点被赋名为“转录型(productive)整合位点”,它们的存在预示着不良的疾病进展及预后;其他不会增加融合DNA转录水平的位点被称为“沉默型(silent)整合位点”,它们均匀分布在整个人类基因组上,对临床结局造成的影响十分有限。两类整合位点在多组学分子特征上也存在明显差异。
研究团队共发现了8个转录型宫颈癌组织,并对其进行了单细胞测序。测序结果说明,转录型整合位点能上调细胞分裂和DNA复制相关基因的表达水平,从而增加宫颈癌的侵袭性,并通过转录水平的调控来实现免疫逃逸。而沉默型整合位点能增强机体的免疫反应,因而携带此类整合位点的患者肿瘤发生概率较低。
哈珀教授称,她要向研究团队“脱帽致敬”,因为要在每个宫颈癌组织样本中检测HPV整合位点的核酸及氨基酸序列,并依照疾病严重性进行对比,是一项浩大的工程,她难以想象研究团队为此付出了多少心血。“他们做了大量分析,检测出每个位点的序列并进行解码,从而发现哪些基因序列与疾病进展相关,哪些序列与之无关。我认为这项研究结果具有很高的创新性,让学界了解了人类基因组中哪些HPV整合位点是值得进一步研究的。”
研究团队证实,位于转录型整合位点,尤其是病毒上游调控区域(upstream regulatory region, URR)的病毒序列,能够上调E6和E7基因的表达水平。
HPV E6和E7是宫颈癌研究领域的明星基因,它们编码的原癌蛋白是导致子宫颈上皮癌变的重要因子。E6蛋白能促进p53蛋白快速降解,导致细胞周期失控,其效应等同于p53突变。E7蛋白能使E2F和pRb复合物解离,促进细胞由G1期进入S期,使细胞周期失控而发生永生化。研究团队的这些发现进一步证实,转录型整合位点与宫颈癌进展密切相关。
此外,研究团队还开发了预测模型,利用患者病变组织中的HPV基因组特征,来预测转录型HPV整合位点存在的可能性,从而判断宫颈癌癌前病变进展的风险。他们通过ROC(受试者操作特征,receiver-operating characteristic)曲线计算得出,该模型的准确率高于85%。不过,也有专家指出,任何临床工具都需要在大样本群体中经过验证,才能在临床推广,而此项研究中涉及的患者数目有限。
当然,对于未来科学家们寻找HPV相关宫颈癌的生物标记物及危险因素而言,马丁团队的研究结果意义非凡。但它也有自己的局限,还有待后续的研究跟进。
例如,哈珀教授就提出,将感染HPV的女性按照患宫颈癌风险分层的意义有限,因为到目前为止,手术仍是去除CIN3病变或癌组织的唯一方法。即使根据患者是否具有转录型HPV位点进行了风险分层,筛出了最可能发展成宫颈癌的那部分患者,我们能做的也十分有限。
在病变发展成CIN3或宫颈癌之前,现有的医学手段无法遏制这一发展进程。医生唯一能做的,也只是等待其发展成CIN3病变或宫颈癌,再通过手术去除。或许有读者会问,那能不能提前进行手术呢?但手术毕竟是有创伤、有风险的,在病变早期,患者无明显症状,此时是没有手术指征的,因为手术带来的创伤和风险大于获益。
如果在未来,研究者能找出早期逆转宫颈癌进程的方法,风险分层的实用意义便会大大提升。此外,该研究的对象仅限于已确诊宫颈癌的女性患者,未来研究者或许需要进一步纳入宫颈癌癌前病变的患者,来验证该结论是否仍成立。
尽管如此,该项研究找出的信号通路在未来可能有很大的应用潜力。其他研究者可以据此进行药物研发,以阻止转录型HPV整合的发生,或防止转录型整合位点引发癌症。这为解开HPV相关癌症的谜团提供了一块新的地图。
“大多数带有CIN3癌前病变的患者,一辈子也不会发展成宫颈癌。我们尚未弄清楚是什么让有些CIN3病变永远维持在CIN3,而有些进展成了癌症。这项研究至少给了我们一个可能的答案。”
参考文献
[1] 沈铿等.《妇产科学》,人民卫生出版社,2015年8月第3版
[2] 张健中等.《皮肤性病学》,人民卫生出版社,2015年6月第1版
[3] Fan, J. (2023). Multi-omics characterization of silent and productive HPV integration in cervical cancer. Cell genomics, 3(1), 100211.
[4] Akagi, K. (2014). Genome-wide analysis of HPV integration in human cancers reveals recurrent, focal genomic instability. Genome research, 24(2), 185–199.
[5] Burmeister, C. A. (2022). Cervical cancer therapies: Current challenges and future perspectives. Tumour virus research, 13, 200238.
[5] Robitzski D. (2023). Why Some HPV Infections Carry More Cervical Cancer Risk. https://www.the-scientist.com/news-opinion/why-some-hpv-infections-carry-more-cervical-cancer-risk-70931
[6] https://www.who.int/news-room/fact-sheets/detail/cervical-cancer
本文来自微信公众号:返朴 (ID:fanpu2019),作者:维罗妮卡(清华大学医学院),出品:中国科协科普部

