本文来自微信公众号:返朴 (ID:fanpu2019),出品:中国科协科普部,作者:顾舒晨,原文标题:《寻找原始核糖体,重现40亿年前生命最初诞生的时刻》,题图来自:视觉中国
生命的起源一直是科学界争论不休的问题,从古至今,世界各地都有着不同的传说,如西方的创世说,中国的盘古开天地说等等。直到19世纪,伴随着达尔文《物种起源》一书的问世,生物科学发生了前所未有的大变革,为人类揭示生命起源这一千古之谜带来了一丝曙光。
在达尔文的理论中,地球生命的演化,特别是从化学过程到生物过程的演化,一直是他孜孜以求的重要问题,而其中构成生命的遗传物质的出现是最令人难以捉摸的。
“RNA世界”的提出
现如今,我们已经知道构成生命的最重要的物质包括DNA、RNA和蛋白质,它们之间构成了极其复杂的化学反应网络。今天,所有已知的生物都使用同样的遗传分子“核酸”来存储信息,在所有的生命体内都有两种核酸:DNA(脱氧核糖核酸)和RNA(核糖核酸)。
DNA负责编码基因中的遗传信息,并由DNA转录生成RNA,遗传基因最终通过RNA翻译成为蛋白质。作为细胞最重要的组成成分,蛋白质最终执行绝大多数分子功能,比如协助DNA到RNA和RNA到蛋白质这两个流程的转化,这一过程就是生物学上著名的“中心法则”[1]。
从某种意义上说,40亿年来生命史就是这三种物质跳的一场漫长的华尔兹,但我们并不知道这场华尔兹是如何迈出的第一步的。虽然这些遗传信息在如今的生化机制上始于DNA,但在进化史上最早存在的是哪种物质却并不清楚。
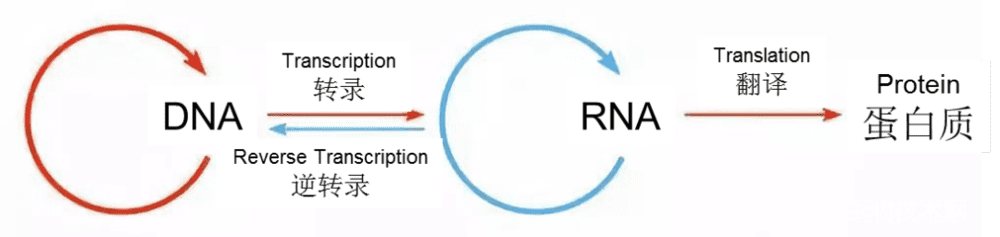
最初人们将注意力集中在DNA和蛋白质上,因为前者是遗传信息的起点,而蛋白质是生命活动中最重要的功能物质,但最终这两种讨论都陷入了两难。正如中心法则(图1)显示的那样,看起来起点应该是DNA,由DNA向蛋白质流动,按照这样的理论,DNA应该出现在蛋白质之前。
但是,问题并没有这么简单,DNA需要自我复制才能保证生命在40亿年的岁月中延绵不绝,而这个过程单靠DNA自己是无法完成的,它需要经过特定的酶才能完成复制,这些酶统统都是蛋白质。因此,在生命起源的讨论中,DNA和蛋白质的起源问题就变成了分子生物学版本的“先有鸡还是先有蛋”。(编者注:类似的问题在线粒体的起源上也存在,参见《线粒体起源之谜:真核细胞的能量工厂,究竟是如何建成的?》)
当然在生命产生之初不可能一下子拥有这整套精密的机制,更可能是某个更加简易且能行使所有功能的版本。上世纪70年代,美国科罗拉多大学的科学家Thomas Cech在研究真核细胞的“RNA剪接”现象时,发现RNA分子在不需要蛋白的情况下就能自我催化剪接[2]。首次证明了RNA分子并不只是一个被动的遗传信息载体,它们也可以有蛋白的催化功能,并能参与细胞的反应。
随后,美国耶鲁大学的科学家Sidney Altman发现大肠杆菌的核糖核酸酶P的RNA部分也具有全酶的催化活性[3]。这两项发现都颠覆了所有酶都是蛋白质的传统概念,也让他们共享了1989年的诺贝尔化学奖。
这些发现向大家展示了RNA的能力,既能顶替DNA编码遗传信息,还可以有蛋白的酶催化功能,也就是说,RNA可肩负储存遗传信息和催化反应两大重任。这意味着RNA分子可能抛开DNA和蛋白质,独霸天下。
这一发现让另一位诺奖得主Walter Gilbert在Nature杂志上高调提出“RNA世界”(The RNA World)的论点[4]。“RNA世界”学说认为:生命最初可能是以RNA的形式出现,随着环境的改变,进化出现了如今的DNA和蛋白质。最初的RNA具有与如今DNA分子一样的储存遗传信息的功能,同时也拥有如蛋白酶一样的催化功能,为早期的细胞或者生命运动提供了一切所需的前提条件。
原始核糖体存在吗?
“RNA世界”指明了生命起源的奥秘吗?非也,该学说仍然存在很多问题,比如单凭RNA自己如何产生蛋白质就难以解释。在细胞中,蛋白质的产生是遗传物质从DNA转录到mRNA(信使核糖核酸)上,再根据mRNA中的碱基排列顺序转变为蛋白质或多肽(可以看作迷你蛋白),而这一过程需要在细胞中的“核糖体”这一细胞器中完成。因此,要生产蛋白就必须先有核糖体。
于是有科学家提出在生命起源阶段,当RNA演化出能合成蛋白质的能力时应该存在一种“原始核糖体”(protoribosome),这种原始核糖体甚至就是“元生命”了。那么这种元生命的原始核糖体到底是否存在,就成了这个科学假说中非常重要的论据,支持者要么在自然界中寻找到,要么在实验室中制造出这个元生命。
最近在实验室制造元生命的研究获得了重要进展。2022年2月,来自以色列魏茨曼科学研究所的Yonath团队于Nucleic Acids Research发表论文,他们在实验室中重建了原始核糖体,并重现了它合成蛋白的过程[6]。
2000年,科学家们就发布了完整核糖体的精确结构,这一成就为他们赢得了2009年的诺贝尔化学奖,其中就包括Ada Yonath。2000年Yonath团队鉴定出了核糖体的结构,它由蛋白质和RNA组成,并被排列成两个不同大小的亚基[5]。
虽然这些素材来自极端微生物细菌,但随着其他生物体的核糖体结构被发表,他们注意到了一些核糖体结构的规律:在大亚基的核心深处均存在一个半对称的结构,这一区域包含一个由核糖体RNA组成的口袋状结构,被称为肽基转移酶中心(peptidyl transferase center,PTC)。在mRNA翻译成蛋白质的这一过程中,氨基酸将被放置在PTC中进行两两链接。可以说,是PTC为氨基酸链接在一起创造了条件。
通过观察不同物种的PTC,他们发现尽管该结构的核苷酸序列因物种而异,但每个PTC的形状都是相同的。Ada Yonath 和她的团队猜测PTC的这个半对称区域很可能就是核糖体最原始的结构,现在的核糖体很可能就是从这个结构进化而来,也正因为这样的猜测让他们首次提出了“原始核糖体”的概念和设想。
![图2:原始核糖体的3D结构<sup label=图片备注 class=text-img-note>[6]</sup> <br>](https://i.aiapi.me/h/2023/03/24/Mar_24_2023_08_27_38_10474479121348619.jpeg)
通过对PTC的对称性的深入分析,他们发现这是一对形状类似的RNA,它们以不可思议的精度形成了一个半对称的漏斗状口袋结构,在翻译过程中,带有氨基酸的tRNA(转运核糖核酸)会带着氨基酸伸进漏斗,在漏斗的中心当氨基酸靠的足够近时,它们将链接在一起形成肽键。
于是,他们提出了一个在早期地球上可能出现的“原始核糖体”模型,这个原始核糖体只需要两个形状类似的L形RNA,分别由60和61个核苷酸组成(图2)。他们猜测在这样的原始核糖体中,由RNA形成的口袋状结构可以将氨基酸链接在一起形成小肽段[6]。但在Yonath和她的团队首次提出这一猜想的时候,并没有实验证据表明这样一个结构能够真实存在并能像大家设想的那样工作。
为了证明这个猜想,Yonath和她的团队必须要在实验室里重复这一过程或重建这种结构。而实验的第一步就是要构建这种理论上的原始核糖体。通过对现代核糖体的分析,他们花了很长时间,从现在的核糖体上剥离掉任何看起来与原始核糖体无关的东西,只留下足够的RNA来创建形成PTC核心的半对称的口袋结构。
实验的第二步就是证明这种假定的原始核糖体可以吸收两种氨基酸并将它们链接在一起形成多肽。但这一过程并不容易,原始核糖体即便能起作用,但可能因为没有蛋白酶参与,导致效率非常低,能够产生的多肽很少,以至于研究人员将很难检测到。因此该项目也在不同研究人员手中接力,花了超过15年的时间才最终确定“原始核糖体”能够链接两个氨基酸形成多肽[6]。
当然这样一个“诺奖级问题”一定也吸引了无数科学家的关注,Yonath团队并不是唯一一个追踪“原始核糖体”的团队。日本的田村教授(Koji Tamura)也受到PTC半对称核心口袋的启发,他的团队成功地创建了一个类似的功能性原始核糖体[7],同样验证了Yonath提出的“原始核糖体”假设。这两项工作现在不仅为生命起源研究填补了更多细节,也为分子生物学研究打开了大门。
现在,很多研究人员正在研究原始核糖体或类似的东西,作为开发新型分子生物研究的工具。因为有核糖体就能够合成蛋白。这种核糖体不受氨基酸限制,可以制造新的生物蛋白,或者新的生物分子,比如右旋氨基酸(目前构成生命的氨基酸都是左旋)。而且这种合成方式可以更便宜、更环保。
生命起源的多重问题
当然,生命的起源也可能没有这么简单。有学者认为原始核糖体只是核糖体起源的一种猜测,两个实验室的原始核糖体结构都与现代的PTC结构完全相同,而我们对核糖体的进化还并不了解。这一结果只是证明了PTC结构有合成蛋白的能力,但不足以证明今天的核糖体就是从PTC结构的原始核糖体演化而来。
其他一些学者也指出,多肽可能还以其他方式出现在早期地球上。例如,氨基酸加上α-羟基酸(包括乳酸和柠檬酸的一组)可能在早期地球凉爽、潮湿和炎热、干燥的气候循环条件下形成多肽,并且这一过程并不需要RNA参与[8]。
2022年,另一个研究团队使用RNA碱基(尽管不是现代RNA代码中使用的A,C,G和U碱基)将肽链接在一起[9]。这一结果也说明氨基酸的链接也可能发生在没有核糖体的“RNA世界”中。这些蛋白生产的方式与大自然现在在RNA中制造蛋白的方式毫无相似之处。
多年来,科学家们一直在探索承担“生命起点”这一伟大使命的物质是一种什么形式,但关于生命起源还有很多研究要做。比如,我们需要弄清楚RNA是如何获得自我复制能力的;还需要发现早期核糖体如何识别原始mRNA编码的特定肽。这些过程,加上合成肽的能力,将为生命起源提供更多的可能。
四十亿年前古地球的“原始汤”随周遭环境变化发生了一系列化学反应,最终产生了某种成为如今绚烂多彩的亿万生命起点的物质,它究竟是如何出现并逐渐演化的,或许这会一直是人类探索的目标,并以此激励一代又一代好奇的我们。
参考文献
[1] Crick F. Nature. 1970 Aug 8;227(5258):561-3.
[2] Kruger, K. et al. Cell 31, 147–157 (1982)
[3] Stark BC. et al. Proc Natl Acad Sci U S A. 1978 Aug;75(8):3717-21.
[4] Gilbert, W. Nature 319, 618 (1986).
[5] Schluenzen, F. et al. Cell 102, 615–623 (2000)
[6] Bose T et al. Nucleic Acids Res. 2022 Feb 28;50(4):1815-1828.
[7] Kawabata Mr. et al. Life (Basel). 2022 Apr 12;12(4):573.
[8] Forsythe, J. G. et al. Angew. Chem. Int. Edn Engl. 54, 9871–9875 (2015).
[9] Müller, F. et al. Nature 605, 279–284 (2022).
本文来自微信公众号:返朴 (ID:fanpu2019),出品:中国科协科普部,作者:顾舒晨

