成功总是需要不断地摸索,过程可能会磕磕绊绊,也需要经过“山重水复疑无路”,才能柳暗花明。本文来自微信公众号:深究科学 (ID:deepscience),作者:徐诗露,责编:李晓韦,原文标题:《张锋创立的公司临床受挫,CRISPR基因疗法接下来的挑战更大》,题图来自:视觉中国
近些年,CRISPR技术发展迅猛,成为了生物医药、作物培育等领域的“当红明星”。
然而,近日张锋创立的Editas Medicine公司,却在CRISPR药物的临床试验中,面临了一次“滑铁卢”——他们用来治疗先天性黑蒙症的CRISPR药物,临床试验结果并不理想。目前,Editas已暂停了这项试验。
曾大放异彩的CRISPR基因疗法是如何发展起来的?为何它会屡屡受挫,却又被业内普遍看好,未来这一技术又该何去何从?
第一家上市的CRISPR基因编辑公司遭遇“滑铁卢”
正当CRISPR基因编辑成为举世瞩目的新技术时,挫折也找上门来了。
2022年11月17日,专注于研发CRISPR基因编辑药物的Editas Medicine公司,公布了EDIT-101的I/II期临床试验(Brilliance)的数据,因结果不理想而暂停试验。
Editas Medicine是由华裔科学家张锋创立的,也是世界上第一家上市的CRISPR基因编辑的公司。
他们近期研发的EDIT-101,是一种体内CRISPR/Cas9基因编辑药物,用于治疗Leber先天性黑蒙症10型(以下简称LCA10)引起的失明。
LCA10是一种遗传性视网膜退行性疾病,至少由18个不同的基因突变引起,十分复杂。

Editas Medicine的研究人员之所以专注于研发LCA10的基因治疗,是因为Leber先天性黑蒙症是儿童患上遗传性失明的常见原因,会导致严重的视力丧失,严重的有可能完全失明。
全球每10万名儿童中就有3人深受其害,目前,我们依然没有能针对这种严重罕见病的有效治疗方法。
在所有LCA疾病中,最常见的就是LCA10,这一类疾病是由CEP290基因突变引起的。
因此,Editas Medicine公司的EDIT-101正是利用CRISPR/Cas9基因编辑技术,对突变的CEP290基因进行编辑,希望能帮助患者恢复感光细胞的功能。
想法是好的,技术也是顶尖的,然而临床数据却不尽如人意,这给研究者带来了许多无奈。
LCA10的临床试验是怎么开展的?
首先,研究人员给14名患者(12名成人和2名儿童)注射了通过CRISPR/Cas9基因编辑技术修饰了的AAV病毒(腺病毒载体)来进行试验。
但经过治疗后,在这14名受试者中,只有3名患者的视力得到了“临床意义”上的改善。
而这3名患者有些特殊,其中一名患者是接受AAV病毒剂量最多的5名成年人之一,另2名患者,体内都有两个突变的CEP290基因。
在美国,有两个CEP290基因突变的LCA10患者,大概也就300个,显然人数是非常稀有的。
这也意味着这3位有临床改善的患者,也许只是“偶然”事件。这个结果与Editas Medicine原本的预期,可以说是大幅缩水。
因此,他们发布消息称,将暂停EDIT-101的试验。
不过暂停倒也不是放弃,他们正在寻找合作伙伴,以继续开发EDIT-101。
AAV-CRISPR基因疗法的发展史
CRISPR基因疗法的发展速度已经十分迅速,而在成功来临的前夕,总需要有人摸着石头过河。
前文提到,患者使用的载体是AAV病毒,将CRISPR系统递送到细胞内。
在我们的认知里(尤其是AAV-CRISPR基因疗法出现之前),遗传病似乎是一类无法攻克的疾病。
AAV-CRISPR基因疗法的出现和应用逐渐改变了我们的这一固有观念。
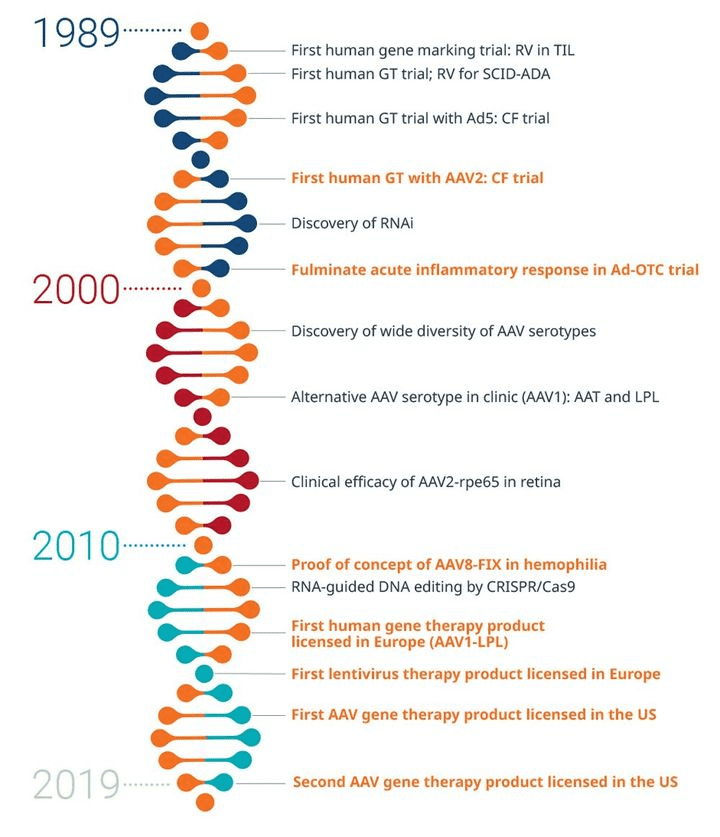
基于AAV的基因疗法,从出现到如今能够安全地治疗遗传疾病,已有30多年的时间。
1980年代末和1990年代初,基于AAV的动物和人类基因治疗逐渐受到一些科研机构的关注。
1995年,第一个患有囊性纤维化的患者接受了基于AAV的基因治疗。
在此后的10年间,使用基于AAV的基因疗法治疗其他遗传疾病(如血友病B)的试验也投入研究中。
2012年,欧洲药品管理局(EMA)首次批准,将基于AAV的基因疗法用于治疗脂蛋白脂肪酶缺乏症(LPLD)。
同年,科学家发现可以通过CRISPR/Cas9技术来修改特定的DNA序列。
2017年,美国食品与药品监督管理局(FDA)首次批准了体内基因疗法。截至2020年,FDA已确定了6项基因治疗指南,包括基因疗法研究和临床开发的指南草案,另外批准了2种基于AAV的基因疗法。
相较于其他疗法,AAV-CRISPR基因疗法发展相当迅速,但它也存在一些挑战,这或许是此次临床试验不利的原因之一。
AAV-CRISPR基因疗法面临的挑战
每一项新技术从出现到成熟的过程,都需要科学家们披荆斩棘、前赴后继地研究,AAV-CRISPR基因疗法也不例外。
2020年,高光坪、张锋、王丹三人联合在《细胞》(Cell)杂志发文,总结了AAV-CRISPR基因疗法面临的挑战。

论文指出,AAV-CRISPR基因疗法面临的问题有很多,主要如下:
1. 预先存在的AAV衣壳和载体诱导的免疫反应、递送效率和特异性,以及AAV载体的开发问题;
2. AAV-CRISPR的临床应用过程中需要各种不同的解决方案;
3. 在人体本身对Cas9免疫的情况下,将载体Cas9蛋白直接递送到人体中,是否会不安全,或影响治疗效果;
4. 脱靶编辑问题,任何脱靶事件产生的潜在生物学后果,在很大程度上需要根据经验进行评估;
5. 除了脱靶编辑外,靶向编辑还可能导致意料之外的编辑事件,例如导致附近基因的大缺失、染色体重排、AAV载体基因组整合等,更好地了解这些相关的细胞过程才能保证基因编辑的结果和安全性;
6. 缺乏与目标患者有相似基因突变的实验动物。
如此种种,都是AAV-CRISPR基因疗法在发展过程中不得不去面对,并要解决的问题。
Editas:失望但不气馁
当然,Editas Medicine公司面对EDIT-101的I/II期临床试验(Brilliance)数据,虽然有些失望,但并不气馁。
“此次试验的结果为遗传性视网膜疾病项目提供了理论上的支持和证明。我们已经证明,对于特定的患者而言,CRISPR基因编辑治疗药物是安全的。”Editas Medicine总裁兼首席执行官吉尔摩·奥尼尔(Gilmore O'Neill)表示。
他也再次强调,“虽然当前我们不会自行推进EDIT-101后续的临床试验,但是我们依然关注患者的需要,并正在寻找合作伙伴,来继续这项研究。”
参考资料
1.Editas Medicine Announces Clinical Data Demonstrating Proof of Concept of EDIT-101 from Phase 1/2 BRILLIANCE Trial | Editas Medicine
2.CRISPR Gene Editing | Editas Medicine
3.Groundbreaking CRISPR treatment for blindness only works for subset of patients | Science | AAAS
4.天生一对:CRISPR/Cas9与AAV - 生物通 (ebiotrade.com)
5.History of Gene Therapy | inGENEuity (ingeneuityhub.com)
6.History of Gene Therapy | Discovery and Evolution (thegenehome.com)
7.CRISPR-Based Therapeutic Genome Editing: Strategies and In Vivo Delivery by AAV Vectors: Cell
8.Editas Medicine Pauses Trial of CRISPR-Cas9 Treatment for Blindness Disorder (genengnews.com)
本文来自微信公众号:深究科学 (ID:deepscience),作者:徐诗露,责编:李晓韦

