今年诺贝尔生理或医学奖授予两位学者——卡塔琳·卡里科以及德鲁·魏斯曼,以表彰他们为mRNA疫苗研发做出的开创性贡献。
得益于他们的发现以及创新技术,新冠疫苗才能被快速研发出来,挽救了数以百万计人的生命。如今这项技术也在应用到其它传染病疫苗、肿瘤新抗原疫苗、罕见病疗法等领域。
《深究科学》邀请了业内资深专家徐亦迅博士深度解读mRNA技术。虽然没有mRNA递送技术的专家分享今年的诺奖,但徐博士认为,“未来不排除脂质纳米颗粒的技术突破有单独获得一次化学奖的机会。”
mRNA疫苗领域两位先驱问鼎诺奖
问:今年诺贝尔生理或医学奖授予mRNA疫苗领域,您觉得是在意料之中还是意料之外?
徐:两年前,我就期待着他们能获得诺贝尔奖,所以今年他们获奖我并不觉得意外,反而感觉晚了两年。这一延迟可能对很多重要的决策也有一定影响。
两位获奖者的主要贡献
问:您能评价一下这两位获奖者的主要贡献吗?为什么是这两位科学家而没有第三位可以分享这次诺贝尔奖?
徐:mRNA技术作为疗法的应用可以追溯到很早以前。举例来说,人体内缺失某种基因后,补充蛋白在操作上会比较复杂,蛋白合成的成本也非常高。多年以来,尝试去改变DNA一直被视为是不可能的任务,直到2012年CRISPR技术的发明,才让便捷的基因编辑成为可能。
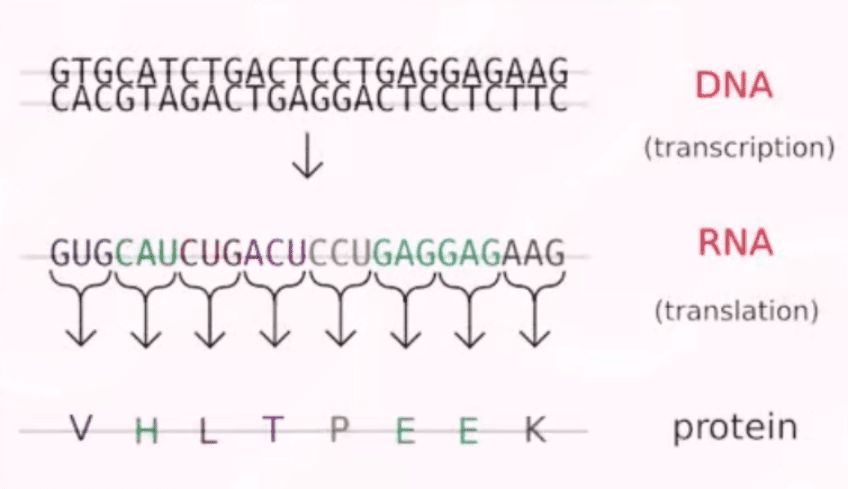
mRNA的发现可以追溯到1961年,在此基础上得以阐明的中心法则告诉我们:mRNA在DNA和蛋白之间传递遗传信息。
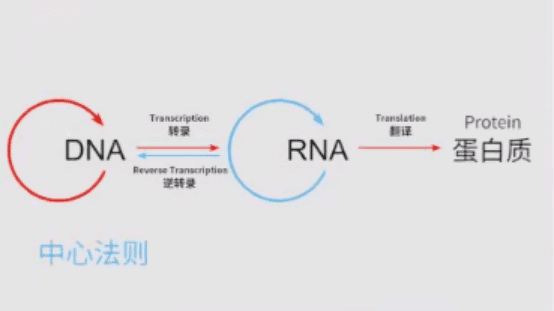
mRNA具有明显的优势。如果将mRNA导入体内,去补充那些缺失或变异的蛋白,它有一个最大的好处:由于它不改变DNA,所以是一个非常安全的疗法,只要没有反转录酶存在,就不会被整合进人类的基因组。
此外,mRNA在翻译成蛋白后通常很快会降解。一旦mRNA疗法可能出现副作用,由于它在体内的半衰期较短,并且它不会整合进基因组,只要我们暂停给药,可能出现的有害副作用就会逆转,这也是为什么mRNA疗法如此吸引人的原因。
然而,要达到这一点,无论是将mRNA作为疗法还是疫苗,都需要解决一个问题:因为mRNA本质上与病毒和细菌相似,一旦以外来途径进入人体细胞,很容易被人体的先天免疫系统识别为危险信号,并引发强烈的炎症反应。在这种情况下,mRNA就无法实现治疗或者疫苗的效果。
两位科学家在2005年发表的《Immunity》杂志上的论文是一个里程碑式的工作。
在所有的诺贝尔颁奖历史上,一直强调,从0到1的突破比从1到100的完善更为重要。
问:除了这两位教授之外,还有其他学者在这一领域做出过重要贡献吗?如mRNA的递送技术方面。
徐:我在两年前的讲座中也提到了脂质纳米颗粒(LNP)技术的重要性。卡里科和魏斯曼在他们的公开演讲中也强调了LNP技术对新冠mRNA疫苗研发成功的重要性。
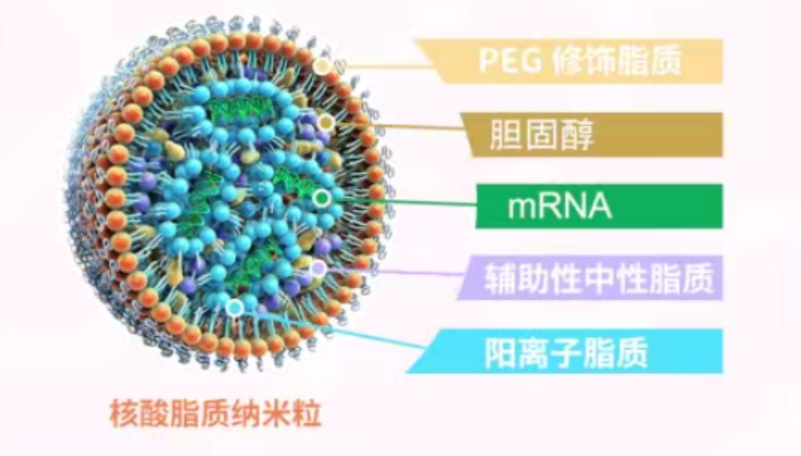
然而,由于诺贝尔奖的名额有限,卡里科和魏斯曼是必得的,只剩下一个名额。如果将这个名额给予LNP技术突破的代表科学家,大家也是可以接受的。后来我们知道彼得·库里斯(Pieter Cullis)似乎在LNP研究领域的表现最为突出,有一些奖项由他与卡里科和魏斯曼共同分享。

但诺贝尔委员会的标准往往强调从0到1这最关键的一步。不过未来不排除LNP的技术突破有单独获得化学奖的机会。
mRNA技术发展历程
问:1961年科学家发现了mRNA,但直到60年后,mRNA疗法才逐渐成熟。在这期间,科学家先后解决了mRNA的稳定性、免疫源性和递送问题。您能简单回溯一下这个疗法的发展历程吗?
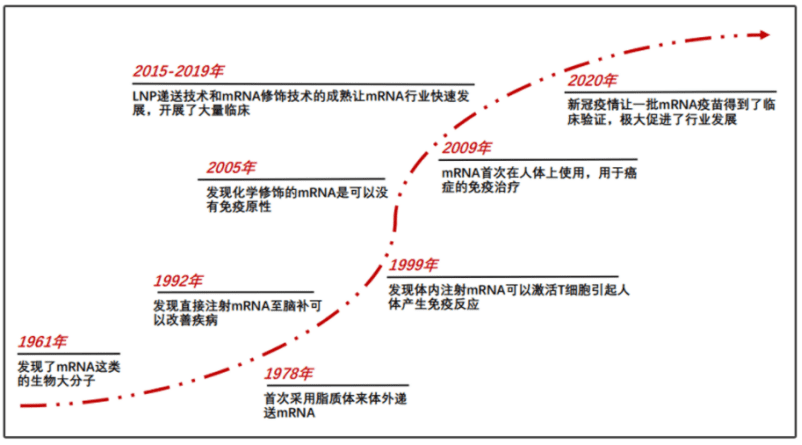
徐:在两年前的直播讲座中,我曾分享过一张图,展示了从1961年到2020年间的mRNA技术的发展历程。
1961年,多家实验室同时发现了mRNA,此时已有很多人认为这项发现可能获得诺贝尔奖。然而我估计或许由于人数众多,所以很难确定哪三个人获奖,结果使得mRNA的发现与诺奖擦肩而过。
随着分子生物学的不断发展,面临的首要挑战之一是降低合成mRNA的成本。按照中心法则,DNA到mRNA的转录是一个关键步骤。首先要做的是在体外,即试管中,将DNA片段转录成mRNA。在1985年之前还没有PCR技术,得到大量模板DNA的价格比较高。
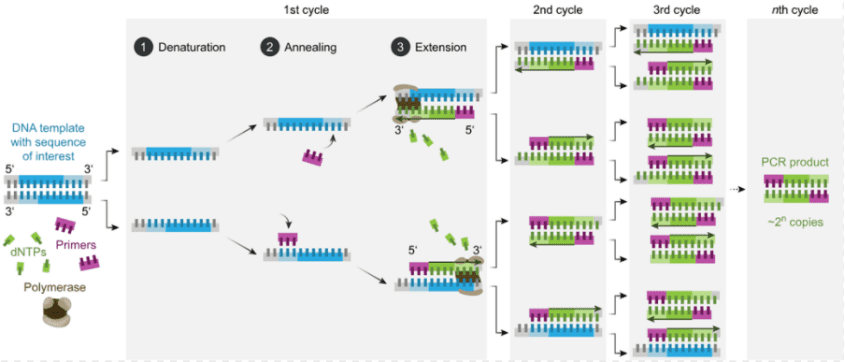
聚合酶链式反应(PCR)
有了PCR技术后,科学家可以轻松获得足够的模板DNA,利用RNA聚合酶在体外进行转录,就可以轻松获得大量mRNA。随后,研究人员需要解决mRNA的稳定性问题,因为它容易被降解。最重要的是,卡里科和魏斯曼通过修饰核苷解决了mRNA的免疫源性或毒性问题。
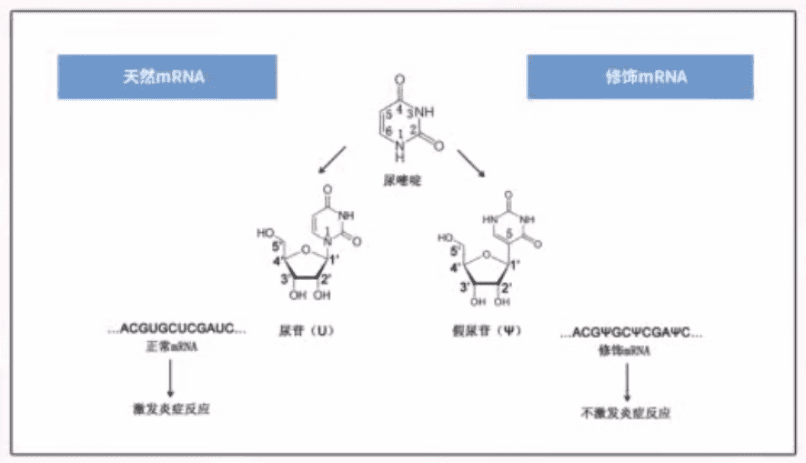
只有克服了这些技术困难,mRNA疫苗和mRNA疗法才具备可行性。
mRNA技术在疾病领域的应用
问:mRNA技术因新冠疫情而被人广泛熟知。除了应对传染病,它在肿瘤以及其他疾病领域也大有可为。您能否谈谈您在这方面的看法?
徐:这是一个非常有趣的问题。实际上,我们可以深入研究两家凭借mRNA新冠疫苗成功的公司:BioNTech和Moderna。BioNTech公司成立于2008年,是德国一家出色的生物技术公司。初创时的目标是用mRNA技术来研发肿瘤产生新抗原的癌症疫苗。很多年内并未考虑研发传染病疫苗,直到新冠疫情爆发让他们“灵机一动”,通过结合mRNA的核苷修饰技术加上2017年取得突破的LNP技术,组合起来可以来应对新冠疫情的挑战。
而Moderna公司早期更早想要开发mRNA疗法,很多公司给它投钱。但当新冠来袭时,他们将主攻方向的一部分转向扩增传染病的mRNA疫苗。此外,他们找到了一位优秀的合作伙伴——美国默沙东公司,从而把很大一部分精力继续投入到新抗原肿瘤疫苗。在过去一两年中,他们的Ⅱ期临床数据表现非常出色,尤其在黑色素瘤领域。
这两家公司明白新冠疫情已经过去,于是很快将把下一个着眼点放在肿瘤新抗原的mRNA疫苗上。
至于其他疾病的疗法,正如此前说的mRNA作为一种“缺啥补啥”疗法,有很多公司在做,但是短期内尚未看到即将取得突破性进展的迹象。不过总的来说,这个领域的发展必定是生物医药界未来的热点之一。
mRNA技术的未来
问:在业内很多专家看来,mRNA技术可能会给生物医药领域带来巨变,甚至将其称为mRNA医学。您对这个技术未来发展前景有何评价?
徐:这种前景确实存在,然而我强烈呼吁大家不要对其过度炒作。因为mRNA在疫苗研发上的成功有其特殊性,许多客观条件都恰好在特定时间点上水到渠成。mRNA疫苗的突飞猛进得益于新冠病毒的突然来临,驱使各国政府迅速投入大量资金,以超快的速度共同应对全人类面临的共同危机。
在正常情况下,许多疾病已经有其他的治疗方法。要推进mRNA作为一种新疗法,必须解决比现有疗法更具优势的问题。然而,如果要在已有疗法的疾病领域成功推动mRNA疗法的发展,就必须克服许多技术上的困难。
mRNA药物开发的优势
问:过去,药物的研发周期很长、成本极高,而mRNA药物具有短研发周期的优势,对于这一点,您有何看法?
徐:研发周期的缩短是相对而言。mRNA序列的合成非常容易,这在疫苗研发上确实是一个巨大的优势。尤其是针对那些经常发生变异的病毒,我们可以随时修改编码抗原的mRNA序列来跟上病毒变异的速度。 另外mRNA的批量生产过程已经非常成熟。
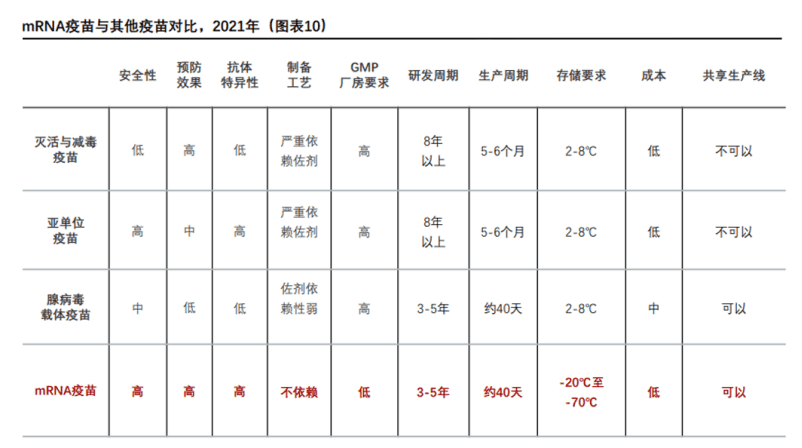
然而临床试验这一阶段通常不是想快就能快得起来的,它往往是一个“限速”步骤。也就是说,尽管上游的生产和其他过程可以加速,周期可以相对缩短,但要找到一种疾病是否适合这个疗法并不是那么简单。而且一旦找到适用的疾病,需要招募愿意参与临床试验的患者,还要与已有的成熟疗法做头对头的比较,这个过程不容易快起来。因此,大家不应轻易高估mRNA疗法研发的速度。
AI如何助力mRNA药物开发
问:这两年AI很热,并在mRNA序列设计以及验证上有很大的优势。对此,您怎么看?二者的结合能否在未来加速mRNA疫苗药物的开发?
徐:首先简单评价一下,所谓的AI制药是一个难以精确描述的概念。我们传统意义上提到的AI主要指深度神经网络,比如大家熟知的AlphaGo。2020年出现了AlphaFold,尤其是2021年的AlphaFold2在蛋白质结构预测方面取得了非常了不起的成就。这些能够预测蛋白质结构的AI工具能够助力药物研发,尤其是在分析小分子化合物或抗体与靶标蛋白结合时,通过算法分析这些结构的变化可以提供很大的帮助。
此外,还可以利用深度学习的模型来帮助筛选小分子药物文库,做虚拟的小分子药物库。一些公司甚至能够根据靶标蛋白的结构设计有机小分子,优化其抑制或激活的效力。另外由于生物大分子序列与人类语言有一定的相似性,ChatGPT这类基于大语言模型的生成式AI,对设计抗体序列或mRNA序列可能有一定的帮助。
然而,我仍要强调,我们不应过分神化这些工具,也不要对AI制药概念进行夸大炒作。
如何坚持科学研究方向
问:无论是卡里科还是其他诺奖得主,我们可以从他们的科研道路中得到一些启示。例如,如何在困难时期保持执着,不放弃自己的研究方向,如何坚持科研的原创性?
徐:简而言之,卡里科的职业生涯可以总结为相当曲折,因为她并不完全适应美国生命科学研究的游戏规则。
卡里科幸运地遇到了命中的贵人——魏斯曼。如果不是魏斯曼在1997年“救场”,她可能无法继续她热爱的mRNA疗法研究。当然,卡里科本身就是一个非常坚韧不拔的人。在1995年被宾大降职以及40岁时患癌症的双重打击下,她仍决定不放弃对mRNA疗法的研究方向,这种坚持难能可贵。
然而,这种坚持并非适用于所有科学家,因为有时候某些研究方向可能确实会陷入“死胡同”,而保持灵活头脑,转向其他方向未必是坏事。
卡里科案例的特殊性在于她在mRNA领域有深厚的积累,从而对mRNA疗法的信心有很强的科学依据,这也是她能够与魏斯曼产生共鸣的原因。魏斯曼作为新晋助理教授,有很多研究方向可选。如果他没有和卡里科一样看到相似的研究路径,就不会有如此默契。
本文来自微信公众号:深究科学(deepscience),嘉宾:徐亦迅,主持:叶水送,整理:周晨

