11月16日,英国监管机构批准了一款使用基因编辑技术的治疗方法,该方法通过失活特定基因,来治疗遗传性血液疾病镰刀细胞病。这在当时引起了不小的轰动,因为这是世界上首个获批的CRISPR/Cas9基因编辑疗法。

不过,研究人员显然不满足于此,他们希望获得第二次授权,这一次,他们将目标瞄准了更大的市场——美国。不到一个月后的12月8日,这款基因编辑疗法获得了FDA批准。

可以说,这是基因编辑疗法领域的一个大事件。不少人将其视为基因编辑技术1.0转向2.0时代的一个转折点。
目前,基因编辑领域的疗法五花八门,但这或许仅仅只是个开端。
Prime Medicine公司首席执行官Keith Gottesdiener表示,“我们倾向于将这些称为基因组编辑1.0……它们能够做出一些惊人的地方,但应用范围相对有限。”
基因组编辑2.0时代正在来的路上,新一代的CRISPR系统能够克服以往技术的缺陷。这些新型的CRISPR系统比起传统的基因组编辑工具,具备更精准、更多样化的DNA编辑能力。它们能够实现传统工具无法做到的事情,例如激活基因。
比利时鲁汶天主教大学呼吸疾病和胸外科实验室的肺病专家Marianne Carlon认为,CRISPR/Cas9的监管批准为基因组编辑技术的下一代奠定了基础。
单碱基编辑技术的新应用
单碱基编辑(Base editing)是2017年由哈佛大学David Liu(刘如谦)团队开发的一款基因编辑工具,单碱基编辑技术在当年被评为“Science年度十大突破”,而David Liu也凭借该技术跻身2017年“Nature年度十大人物”。
单碱基编辑可以应用到治疗囊性纤维化突变,这些突变会损害肺部和消化系统,这是传统的CRISPR/Cas9没有办法解决的问题。Gottesdiener认为,CRISPR/Cas9技术之所以无法解决做到是因为“CRISPR更善于摧毁而不是修复”。
目前,Carlon正在做的就是研究如何用单碱基编辑来治疗囊性纤维化。这种编辑技术能够改变单个DNA字母或碱基,比如把A变成G,或者C变成T。它利用最初CRISPR系统中的Cas9酶来准确地定位这些点突变。
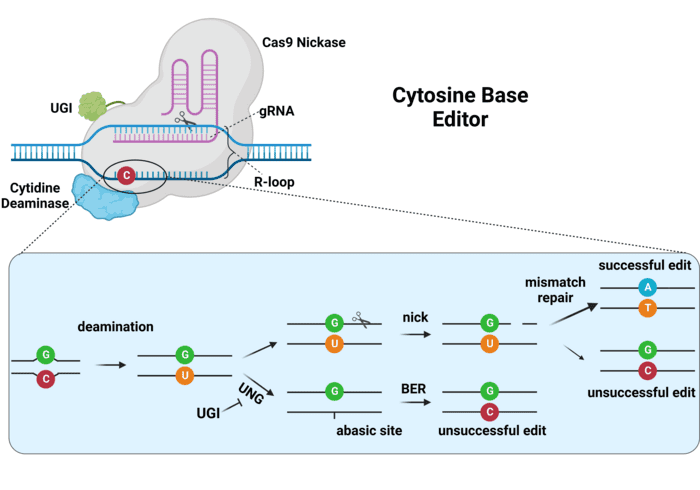
自从单碱基编辑被首次报道以来,已经过去了7年,科学家找到了方法来减少不必要的DNA变化,并且还缩小了编辑工具的尺寸,使其更容易进入细胞。
现在,单碱基编辑的疗法已经进入了早期临床试验中应用,包括治疗高胆固醇以及某些类型的白血病。
不过,尽管这项技术非常精确,但却有一些缺陷:它只能改变特定的DNA序列,无法将新的DNA片段插入到基因组中。
先导基因编辑势头正劲
2019年,一种名为先导基因编辑(Prime editing)的全新CRISPR系统横空出世。这款基因编辑技术同样由David Liu(刘如谦)团队开发。
先导编辑能够能够实现任意碱基替换、DNA片段插入和缺失。相较于单碱基编辑,它更为灵活,几乎可以靶向并修正基因组中的任何位点。
但与之相对应的是,它也更为复杂。Carlon表示,“它具备多样性,但这也增加了操作上的一些挑战”。
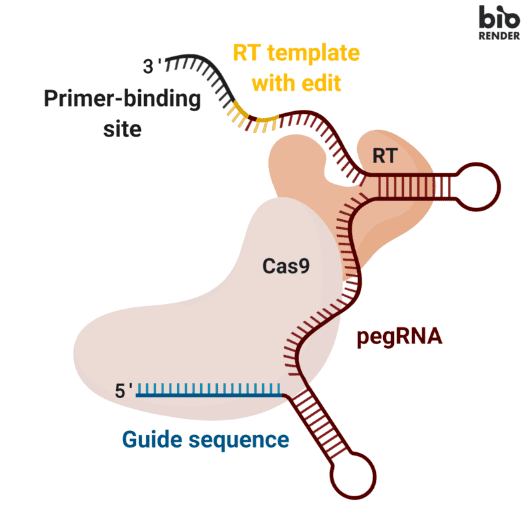
自2019年以来,科学家通过改良酶的设计,让先导编辑变得更有效率。同时采取其他改进措施,防止细胞自然的DNA修复机制引发错误。
Prime Medicine计划预计明年向FDA申请启动一项先导编辑治疗临床试验,针对的是慢性肉芽肿病这一遗传性免疫紊乱疾病。
与此同时,科研人员正在尝试在技术方面开拓新的领域,他们试图在基因组的特定位置插入越来越大的DNA片段。这为整个基因的替换铺平了道路。
马萨诸塞理工学院剑桥分校的生物工程师Omar Abudayyeh表示,这将使得治疗遗传性疾病变得更加容易,比如囊性纤维化,因为这种疾病可能由某个特定基因发生多种不同的突变。这意味着有朝一日,我们可以通过替换有缺陷的基因拷贝来治疗,而不是为每个突变设计不同的治疗方案。
表观基因组编辑的潜力
除了改变基因自身的序列,CRISPR系统还可以通过修改“表观基因组”来调控基因活性,这包括对DNA的化学修饰。
2021年,麻省理工学院(MIT)和加州大学旧金山分校(UCSF)的科学家们共同开发了一种新型的表观遗传编辑器(Epigenome editing)——CRISPRoff。这种编辑器可以在瞬间实现持久、可遗传且可逆的DNA甲基化修饰和基因转录调控。
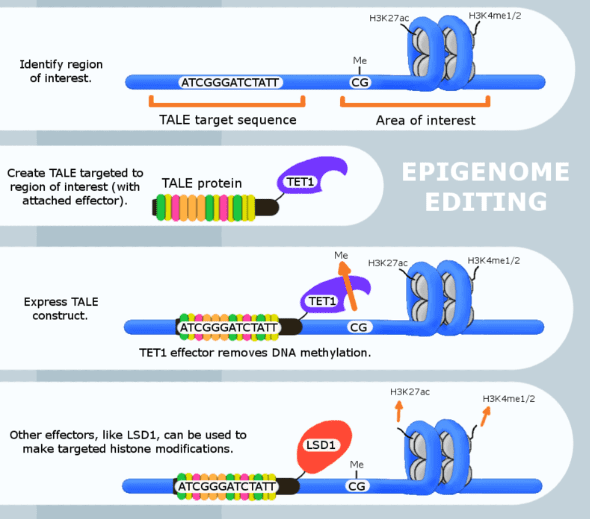
然而,与单碱基编辑不同,表观基因组技术的发展速度较慢。这部分原因在于科学家曾认为在细胞分裂期间进行的表观基因组编辑会被清除。Tune Therapeutics公司首席科学官Derek Jantz解释说:“这是一个普遍存在的误解……表观遗传学对基因有着持久的影响。”
今年5月,Tune的科学家进行了一项实验,成功关闭了非人灵长类动物中的PCSK9基因,而不用改变DNA的核心结构。他们采用了一种技术,在DNA上加入了一些称为甲基基团的化学标记,这些标记能够影响基因的工作方式。据Jantz表示,这种影响已经持续了至少11个月。
Jantz指出,这种长期效应可能让表观基因组编辑在某些需要定期重新给药的RNA药物中具有优势。同时,这种治疗方法并不会改变DNA本身,这有助于减轻监管机构对CRISPR/Cas9治疗的安全性担忧。
深入地理解表观基因组能够帮助我们开发更有效的治疗方法,甚至解决其他形式的CRISPR编辑无法处理的疾病。例如,Tune公司计划利用表观基因组的编辑方法来治疗乙型肝炎病毒感染。他们希望通过影响细胞内的病毒DNA,即使在抗病毒治疗后病毒仍潜伏的情况下,也能有效控制这种感染。
虽然这些应用与首个获批的CRISPR药物中使用的CRISPR/Cas9编辑有所不同,但监管机构的批准证明了基于CRISPR的编辑是一种可行的治疗疾病的方法。
“基因编辑技术获得批准是一个重大事件,之后的同类技术可能会进入快速发展的阶段。”
参考资料
1.CRISPR 2.0: a new wave of gene editors heads for clinical trials.Nature.
2.UK first to approve CRISPR treatment for diseases: what you need to know.Nature.
3.FDA Approves First Gene Therapies to Treat Patients with Sickle Cell Disease.FDA.
本文来自微信公众号:深究科学 (ID:deepscience),编译:周晨

