本文来自微信公众号:返朴 (ID:fanpu2019),作者:返朴,原文标题:《生物正交化学和点击化学摘得2022化学诺奖,Sharpless二度获奖!Bertozzi如何创立生物正交化学?》,题图来自:视觉中国
瑞典当地时间2022年10月5日11时45分(北京时间10月5日17时45分),诺贝尔奖委员会宣布将2022年诺贝尔化学奖颁发给美国化学家Carolyn R. Bertozzi,丹麦化学家Morten Meldal和美国化学家Karl Barry Sharpless,以表彰他们“为点击化学和生物正交化学的发展”做出了突出贡献。

2022年诺贝尔化学奖奖励的是简化化学反应的过程。Barry Sharpless和Morten Meldal为一种分子功能化——点击化学——奠定了基础。“点击”就是指两个东西像积木扣在一起一样,咔嚓(click)一声,分子构建单元快速而有效地结合在一起。Carolyn Bertozzi将点击化学带到了一个新的维度——在生物体中使用它。
长期以来,化学家们一直渴望构建越来越复杂的分子。药物研究中,通常需要人工制造具有药用特性的天然分子,科学家发现了许多有意义的分子结构,但成本高昂并且非常耗时。诺贝尔化学委员会主席Johan Åqvist表示:“今年的化学奖获奖工作不是一类复杂的方法,而是把问题变得简单和便捷。功能分子甚至可以通过一条直接的路线来构建。”
大约在2000年,Barry Sharpless创造了“点击化学”的概念,这是一种简单而可靠的化学形式,在这种化学中,反应快速发生,避免了不必要的副产品。不久之后,Morten Meldal和Barry Sharpless各自独立提出了现代点击化学王冠上的明珠:铜催化叠氮-炔环加成。这是一种优雅而高效的化学反应,现在在药物开发、DNA定位和创造新材料等方面被广泛使用。
为了绘制细胞表面重要但难以捉摸的生物分子——聚糖,Carolyn Bertozzi开发了在生物体内起作用的点击反应。她的生物正交反应不会破坏细胞的正常化学反应,其正在被用于探索细胞和追踪生物过程。利用生物正交反应,研究人员改进了癌症药物的靶向性,许多临床试验正在进行中。点击化学和生物正交反应将化学带入了功能主义时代,为人类带来了伟大的效益。
值得一提的是,这是Barry Sharpless的第二个诺贝尔奖,他曾于2001年因手性催化氧化反应方面的贡献获得2001年诺贝尔化学奖。在诺贝尔奖历史上,此前只有居里夫人(Marie Curie)、约翰·巴丁(John Bardeen)和弗雷德里克·桑格尔(Frederick Sanger)三人曾经两次获得科学奖。其中只有桑格尔是1958年和1980年诺贝尔化学奖得主,如今的Sharpless是继桑格尔后第二位在化学奖上“梅开二度”的。
Sharpless曾说,一开始他想给这类反应取名,然而他有“取名困难症”,便求助于他的妻子。他的妻子是某个期刊的编辑,有点文艺细胞,就引用了一个美国俗语“click it or ticket”(不系安全带就吃罚单),取名为“click chemistry”。所以“click”其实指的是扣安全带,形容反应像扣安全带一样简单高效。
重庆大学副教授李存璞对《返朴》介绍说:“点击化学或者生物正交化学很多都基于叠氮:三个氮原子连接在一起,一方面可以很方便的与两个碳原子形成五元环,如同奥运五环一般;另一方面也可以脱去氮气分子,留下一个氮原子构建新的功能化体系。氮元素作为最重要的有机物中的杂原子和生命分子的核心元素,未来还有更多的内涵值得科学家继续探索。”
什么是生物正交化学?
一个不简单的学术任务锻造出一把生化“利剑”,轻轻一击,便为生物化学开疆扩土。在生物正交化学出现之前,荧光蛋白标记法是蛋白质层面最热门,最广泛的方法,通过基因编辑蛋白质,与绿色荧光蛋白质或者其变体结合打上标记,从而跟踪被标记物的结构、功能。但这个方法有一明显缺陷:标记物蛋白往往很笨重,容易影响被标记生物分子,改变实验结果。[1]
而Bertozzi开发出的“生物正交化学”方法则轻便得多:让两个小分子在活细胞环境中相互作用,形成反应类型单一但彼此相连的共价键。然后如同“桥梁”一般,其中一个小分子通过代谢标记法与靶点糖分子整合,而另一个则与化学标记物结合。在整个过程中,小分子以及靶点大分子的整合借助生物体内已有的生化反应,却不会影响反应本身。2005年,Bertozzi团队发表在《自然·化学生物》(Nature Chemical Biology)的一篇论文详细阐述了该实验策略。[2]
![来源:论文 《生命系统中的化学》<sup>[2]</sup> <br>](https://i.aiapi.me/h/2022/10/05/Oct_05_2022_08_08_45_4712390025189391.png)
也正是Bertozzi团队正式创造出“生物正交化学”(Bioorthogonal chemistry)这一术语,并一直引领着该领域的发展。根据定义,生物正交化学是在生物环境中发生的一组对生物分子影像微小,或对生化过程干扰微小的反应[3]。所谓“正交”,便有相互独立,不加干涉的涵义。
生物正交化学反应的代表性课题组
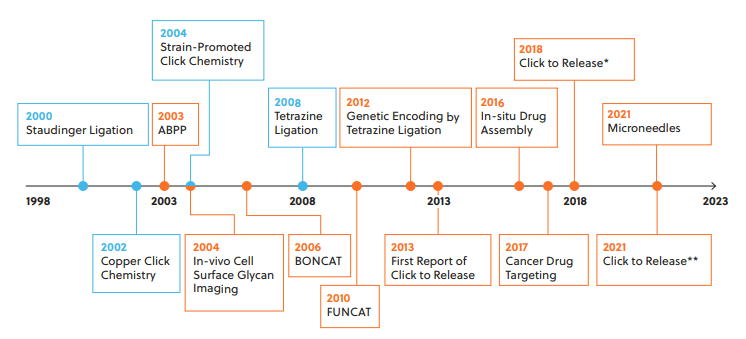
最初的生物正交化学主要指偶联反应,2000年Bertozzi团队基于施陶丁格(Staudinger)还原反应开发出施陶丁格偶联反应,即叠氮-膦基酯反应,将其用于细胞表面的化学修饰[4],也正是这一研究掀起了各种其他生物正交化学反应的研发热情。
2002年,美国有机化学家卡尔·巴里·夏普莱斯(Karl.Sharpless)团队和丹麦有机化学家莫滕·梅尔达(Morten P. Meldal)团队分别独立报告了一价铜催化的叠氮化物-炔烃环加成反应(CuAAC 反应),该反应遵循点击化学(Click chemistry)的选择性原则,产率高,应用范围广,非常适合生物正交化学。CuAAC反应使用的两种小官能团容易与靶点分子结合,同时不影响自然生化反应[1]。
尽管优势明显,CuAAC反应有一个隐患:铜催化剂在细胞中反应会产生有毒的活性氧自由基。于是,Bertozzi团队翻阅资料,寻找不用铜催化的办法,她们很快就找到了一种名为环辛炔的有机化合物,和叠氮化合物之间可以在生理条件下实现应变促进的[3+2]环加成反应,且无需催化剂。在短短几个月之内,团队构建好反应小分子,先在蛋白质,后在细胞上进行选择性修饰实验,结果相当理想,且没有毒害。2004年,团队在《美国化学学会期刊》(JACS)上发表论文,证明了无铜点击化学正交反应的应用潜力。[5]随后,团队进一步改良了环辛炔试剂以求更快的反应动力学,成功对发育中的活斑马鱼体内膜相关聚糖进行成像,识别并跟踪聚糖的表达模式。[6]
就在Bertozzi团队在生物正交化学的道路上突飞猛进之时,其他科研团队也积极探索新的反应策略。2008年,美国德拉瓦大学(University of Delaware)约瑟夫·福克斯(Joseph Fox)团队在《美国化学学会期刊》(JACS)上发表研究,提出了S-四嗪(Tetrazine)和反式环辛烯(TCO)在生理条件下无需催化剂的环加成反应。[7]四嗪的连接反应是目前已知生物正交反应中最快速的一种,福克斯表示:“有了最强反应的反式环辛烯,反应速率超过了3,300,000 M-1 S-1。”[1]
从2010年起,中国科学家迎头赶上,在生物正交反应研究领域积极做出自己的贡献[8],其中最重大的突破便是2014年北京大学化学与分子工程学院陈鹏团队在《自然·化学》(Nature Chemistry)在线发表的论文,首次提出“生物正交剪切反应”(bioorthogonal cleavage reaction)这一概念。 在陈鹏团队之前,正交反应的思路往往遵循键合反应,而陈鹏则反其道而行之,希望在生物正交化学反应中打断键化学键,从而激活蛋白,甚至递送药物。
于是,陈鹏团队研发出别具一格的蛋白质,其活性位点上的一个关键残基被保护性官能团“锁在笼中”。随后使用正交剪切反应,可打破“牢笼”,解除保护,将其激活。在这篇论文中,团队在活细胞内实现了蛋白质侧链的原位脱保护反应(Proc-赖氨酸向天然赖氨酸的转化)。[8-9]这一策略的优势在于将非天然氨基酸直接插入了目标蛋白质酶的催化活性位点,使其处于完全“关闭”的状态;而在激活过程中只要产生少量的处于“开启”状态的蛋白质就足以对其功能及相关生物学功能进行研究。[10] 2019年,团队在《美国化学学会期刊》(JACS)上提出了另一种“双取代炔丙基/铜试剂”生物正交剪切反应,从“末端脱笼”拓展至“分子内剪切”。在此基础上,团队设计并制备了基于氨基和酚羟基的可控释放型抗体偶联药物 (Cleavable ADCs),成功实现了对癌细胞的选择性杀伤。[8, 11]
生物正交化学的未来发展
生物正交化学是一个非常年轻的领域,由Bertozzi开创的革命性技术,在近20年时间内科学家们不断拓展其内涵和外延,虽然到目前为止,生物正交反应并非尽善尽美,在效率、速率、底物稳定性、易得性、生物兼容性、相互正交性以及操作便捷性等方面或多或少还存在着各种各样的问题。[8]但从最初作为偶联反应的补充反应,到独立壮大如今成为生物化学的核心领域之一,发展潜力不容小觑。生物正交化学不仅推动着糖生物学的发展,而且在药物靶向方面的应在范围未来很可能会进一步扩大。 [3]例如:
药物制剂的原位合成:生物正交化学可能会有助于用较小的前体来组装药物。在需要的时间创造药物,药物就会更有效、毒性更低;药物干预的范围也可以扩大。
聚糖标记:科学家已使用叶酸配体生成了含有叠氮化物标记的半乳糖胺的脂质纳米粒。 当肿瘤细胞暴露于人类血清中时,肿瘤膜纳入叠氮修饰的双苯环辛烷,触发免疫反应。
点击释放(Click to Release):该方法是利用生物正交化学控制药物释放的时机和位置,产生对靶细胞有选择性毒性的药物。
参考文献
[1]https://www.chemistryworld.com/features/the-bioorthogonal-revolution/4015604.article
[2]https://www.nature.com/articles/nchembio0605-13
[3]https://www.cas.org/zh-hans/resources/blog/bioorthogonal-chemistry
[4]https://www.science.org/doi/10.1126/science.287.5460.2007
[5]https://pubs.acs.org/doi/10.1021/ja044996f
[6]https://www.science.org/doi/10.1126/science.1155106
[7]https://pubs.acs.org/doi/10.1021/ja8053805
[8]http://sioc-journal.cn/Jwk_hxxb/article/2021/0567-7351/348249/0567-7351-79-4-406.mag.shtml
[9]https://www.nature.com/articles/nchem.1887
[10]https://pubs.acs.org/doi/10.1021/jacs.9b05833
下文介绍了Bertozzi的学术成长经历,编译自2018年《化学世界》的“Cells, sugars and synthesis”一文,撰文Sarah Houlton,编译Kestrel
2022诺贝尔化学奖得主Bertozzi和她的糖生物学帝国
1966年出生的Bertozzi Bertozzi在马萨诸塞州莱克星顿镇与她的两个姐妹一同长大。她们的父亲William Bertozzi是MIT的一名物理学教授,三姐妹的成长也一直围绕着科学,当被问到“长大想做什么”的时候,她们异口同声回答“当核物理学家”。父亲也期待着女儿们参加MIT的夏令营,进MIT读书。不过,事情的发展超出了老父亲的预期……
少年时代的Bertozzi Bertozzi见到什么有意思的就想尝试,12岁时,为了学花哨的轮滑跳跃动作,骨折一条腿,和石膏、腋杖一起呆了半年,高中的足球教练也说她初生牛犊不怕虎。
Bertozzi还喜欢音乐。高中时,她曾在作曲和音乐方面多次获奖,去哈佛大学念本科,也是因为哈佛能提供更多科学之外的丰富内容。她本想选择音乐专业,但父母不支持,只好选择了包含数理课程的医预(pre-med,医学预科)轨道,并在大一结束时选择了生物学专业。这时,她还不喜欢大一的普通化学课。
意识到自己对化学更感兴趣,是在第二年的有机化学课上。Bertozzi 说:“听说教授故意把问题弄得又费劲又难懂,同学们抱怨这门课记忆练习的成分很大,但我不一样。当时我最喜欢的就是这门课了,一点儿都不觉得枯燥。有机化学跟我的脑袋比较对味。”
一年后,她就改到化学专业。音乐也没有完全放弃。许多学生在餐厅当服务生打工挣学费,Bertozzi则在一个摇滚乐队当键盘手以及伴唱。那是个八十年代的长发重金属乐队,叫做Bored of Education(学习好无聊)。校园里举行派对或者其它活动时,会有人来请他们,要么唱自己写的歌,要么翻唱当时流行的歌。后来,他们的主吉他手Tom Morello毕业后去洛杉矶组建了一个乐队,这就是大名鼎鼎的Rage Against the Machine(暴力反抗机器)。
Bertozzi当然也会遐想,要是自己当时跟着去了,现在会是何种光景。“我当时没有上那车,现在就只会最简单的‘The wheel on the bus go round and round’。我只能等我的儿子们将来长大了,能欣赏八十年代的重金属!”
找寻机会
哈佛鼓励理科专业的本科生暑期到科研实验室去实习。Bertozzi想找个做有机化学的实验室,但找来找去都说没位置了。兜兜转转,去到了麻省眼耳医院(Massachusetts Eye and Ear hospital)的一个研究膜氧化损伤的实验室。她在Irene Kochevar教授那儿搬砖,学期中每周去几个小时,带着一袋零钱去三英里外的医学院图书馆复印文献。
那时的激光近视手术还是新事物,人们需要了解手术激光是否会损伤眼部组织。Bertozzi帮忙制备“血影”——把红细胞放到低渗溶液中,让它们胀裂、释放出内容物,只留下细胞膜,再用激光照射,看看它们会不会受到损伤。
到下一个学期,Bertozzi选了一门开给一年级研究生的物理有机化学课,在课上认识了一些研究生。她去他们的实验室参观,想着他们也许会把自己引荐给他们的PI,让她获得一份暑期实习工作——并没有。暑假来临,她还是没能找到有机化学方向实验室的实习位置。这时,Bertozzi开始感到,也许当有机化学家并不是个好主意。
她于是开启了备用计划:争取去生物化学实验室。这时,她遇到了Joe Grabowski,是她选的那门研究生课的老师。他的实验室当时只有一位研究生——那个时候,由于长期前景的不确定性,哈佛的助理教授比较难招到研究生。Grabowski对招本科生是很开放的,有天下课,他问Bertozzi暑期要不要到他的实验室工作。机会忽然出现了!Bertozzi简直惊呆了,赶紧放弃了去生化实验室的打算。
边学边做
Grabowski想做一个光声量热学方面的项目,大概就是,测量光激发的分子弛豫放热,造成局部溶剂膨胀时形成的压力波。简单说来就是,你可以在比色杯边缘放个耳机去听这些波,声音的幅度可以提示你,有多少能量转化成热消散掉了。
但作为一个本科生,Bertozzi实际上不是很理解这整件事。多年后,她回忆说:“暑假刚开始的时候,我根本就是两眼一抹黑。有的事情你就是知道肯定不会发生——好比我看一场NBA比赛,我就知道我怎么样都不可能成为一名职业篮球运动员。但这会儿我必须想办法整一个仪器出来。”
一边搭仪器、装配零件来测量声波,一边将那些模拟信号数字化,Bertozzi同时开始学习Forth语言编程,用来控制仪器。暑假结束的时候,她已经做成了一套将那些数字信号转化成图表的程序。
她用这个项目做了本科的毕业论文,到她离开的时候,仪器已经搭出来了,虽然她从来没用它做过实验。“到我快要博士毕业的时候,论文出来了,而且上面还署了我的名字!回头看,虽然不是有机合成方面的,但是这件事情很鼓舞人。它教会了我,要达成一个大目标,你并不需要清楚整个路径——你每天都做出一点儿,杂草就会慢慢清出,路径就会越来越清楚。人很容易被大的挑战吓倒,但你又不是得一天之内完成它。我觉得一下子被交给一个力尚不能及的项目,是好的经历,因为我得边做实验边弄明白很多事。”
虽然如此,Bertozzi还是很想去做有机合成。“摆弄电脑和激光固然很有意思,可是我还是很喜欢思考有机分子的行为以及创造新的有机分子的概念。Jeremy Knowles教授开的生物有机化学课激发了我的兴趣。我对酶如何操控分子特别着迷。”
在新泽西州贝尔实验室的一次暑期实习进一步激发了Bertozzi的兴趣。她在Christopher Chidsey的实验室工作,Chidsey是一位年轻的表面科学家,当时在研究硫醇在金的表面自组装成的单分子层。虽然仍不是做合成,但Bertozzi还是很兴奋——至少可以溶解以及制备有机化合物了!
巧的是,Chidsey正抱怨没有能用的软件来处理循环伏安法实验的数据,刚好在考虑用Forth语言写一个。这给了Bertozzi一个施展技能的机会——那个夏天的工作后来发表在美国化学学会会刊(JACS)上。尽管Bertozzi后来发表了很多很有影响力的研究,但那篇文章到现在还是她被引用最多的工作之一。
终于是合成化学家了
去加州大学伯克利分校(UCB)读博之后,Bertozzi的有机合成之梦终于实现了。她在Mark Bednarski的实验室设计用于生物学研究的分子。Mark Bednarski也是一位年轻学者,Bertozzi读本科时他也在哈佛大学George Whitesides的实验室做博后,两人当时就认识了。Bednarski对糖类化学感兴趣,而那个时候治疗流感的神经氨酸酶抑制剂药物Relenza(zanamivir,扎那米韦)和Tamiflu(oseltamivir,奥司他韦)正呼之欲出,两者都是唾液酸(即N-乙酰神经氨酸,一种带有9个碳原子的单糖衍生物)类似物。流感病毒的神经氨酸酶和血凝素刚被解出来,让这个领域散发出激动人心的光彩。
读博第三年时,导师Bednarski确诊了结肠癌。他请了一段假去治疗,随即决定成为一名医生,改去斯坦福学医。Bertozzi和实验室的另外两个学生决定不换到其他组,而是继续当时的研究。他们自己做实验,自己投稿,甚至给期刊编辑打电话对评审意见提出抗议,最终,他们在没有导师指导的情况下完成了PhD的研究工作。多年后回头来看,这些事情起了“祛魅”的作用,让他们早早了解到PI怎么运转一个实验室,虽然只是一个小实验室。Bertozzi说:“这换到现在不可能发生,因为学校还有监管以及安全方面的考量。但当时就有点像闯西部似的。我很感恩当时的研究最后成功了,实在是不想换一个新的实验室从头开始。”
博士毕业后,Bertozzi在加州大学旧金山分校(UCSF)的一个免疫学实验室做博后。在那里,她又遇见了Christopher Chidsey——他已经是斯坦福的老师了。他鼓励Bertozzi去申请一份化学生物学的研究工作,斯坦福当时刚好在招这样的人。但Bertozzi希望留在湾区,所以还同时申请了UCB和UCSF。三所院校都给了offer,Bertozzi最终选择了回到伯克利。
生物正交化学的诞生
做博后的经历让Bertozzi了解到,在生物系统里研究糖科学是件多么令人沮丧的事——工具太原始了,没法用来测量细胞、组织或生物个体。她需要一件趁手的工具。
这件事成为她回到伯克利的首个学术任务:开发能加快糖生物学家研究进展的新工具。不像蛋白和核酸,当时还没有能用于糖类的成像技术。Bertozzi开始开发专门的成像工具,能对人为引入到糖分子上的“探针”进行成像。这引出了代谢标记法——通过喂给细胞化学修饰的代谢前体来获得带标记的糖。探针本身不能直接插入,因为它们太大了,会被酶破坏掉,但你可以先放个化学标记,然后再加探针。
运用代谢标记法,Bertozzi开发出了她称为“生物正交反应”(bioorthogonal chemistry)的新反应类型,这类反应可以在活着的生物体内进行,而不会干扰其原生的生物学过程。她的实验室有部分人进一步开发生物正交反应方面的技术,剩下的人则做应用方面的研究,使用他们开发的带标记的糖来做成像。
新的想法在做已有项目的过程中不断冒出来。其中之一便是结核病(tuberculosis,TB)——当时结核病致病菌的基因组刚刚完成测序,组里的研究生Joseph Mougos(现在也成为了一名杰出的学者)对此很感兴趣。他们已经在研究多种人类的酶,所以把这些酶的序列跟TB基因组的序列做了联配,想要找到细菌版本的这些酶。令他们意外的是,Mougos找到了人类磺基转移酶(sulfotransferase)的远亲。
下一步就是做敲除突变体,找表型。这件事说起来容易,但是研究结核需要P3实验室,也就是生物安全防护要达到三级标准。可是Bertozzi当时并没有这么一个实验室。多年后,Bertozzi接受采访时说:“我当时就是一个助理教授,预算紧,可是我又想:为什么不呢?既然我本科的时候能搞一个光声量热仪出来,我的研究生为什么不能做TB?”在Bertozzi的支持下,Mougos找到了必要的密闭设备,自己搞清楚了怎么做诱变,然后大家开发了一套质谱仪平台,可以用它来进行富集硫-34的重硫酸盐标记,以此来寻找这些酶可能涉及的代谢物。
弄清楚一种磺基糖脂(当时认为是一个毒力决定因素)的生物合成途径后,他们想到,这个生物学过程可以应用于成像。更令人兴奋的是,成像工具可以检测出感染者痰液中感染结核菌的细胞(结核分歧杆菌是兼性胞内寄生的细菌),只需要用上一个电池供电的显微镜。这些设备早就被广泛用于诊断疟疾,而且对于TB流行但医疗资源稀缺的地方更是能派上大用场。
“我们做了一个荧光标记试剂,而且这跟项目现在得到了盖茨基金会(Bill and Melinda Gates Foundation)的资助,用于现场快速诊断(point-of-care diagnostic)。要是这么多年以前,没有那个学生自己勉强自己去做TB,我们现在还离这个目标很远。路是我们在这十多年间,一个实验一个实验这样铺出来的。”
搬到那边
在伯克利呆了快20年后,2015年,斯坦福大学又找到了Bertozzi。斯坦福在创建一座新的研究所,叫做ChEM-H(Chemistry, Engineering, Medicine for Human Health,即“化学、工程、医学与人类健康),邀请她来工作。
Bertozzi看到了从头开始为一项事业做出贡献的机会。可这时机不太对,因为她和丈夫快要有第三个孩子了。但她清楚知道自己想要这份工作。她希望自己的学生在医学的生态环境中增长经验。这在伯克利不容易办到,但是斯坦福有个医学院,正好在加州Palo Alto,所以他们决定搬去。
另一个意料之外的研究方向几乎同时出现了。硅谷一位成功的技术企业家Matt Wilsey,也是斯坦福校友,给Bertozzi打来电话。Wilsey的小女儿Grace确诊了一种很罕见的遗传病:她的两个NGly1基因拷贝均发生了不同的突变。NGly1基因编码的是一种酶,叫做N-聚糖酶,其作用是将折叠错误的糖蛋白上的糖基水解下来,以便蛋白质部分进入降解途径。Wisley创建了一个非营利的科研基金会,希望找到治疗甚至治愈这种病的办法。他已经招募到了好几位资深的遗传学家和其它生物学家,但还没有专注研究糖类的化学家。因为Bertozzi实验室正好是做糖科学的,Wilsey便想请她来帮忙。
Bertozzi对N-聚糖酶缺失何以让孩子生病还没有足够的理解,她犹豫要不要写个研究计划。当时这个酶的功能还不太清楚,它的功能跟病人的症状之间有何关系,大家也没有好的思路。
几个月过后,又一巧合发生了。在一次会议上,Bertozzi碰见了加州理工大学的生物学家Ray Deshaies。N-聚糖酶定位在蛋白酶体上,所以有人认为它的作用是去掉错误折叠的蛋白上面大的聚糖部分,好让蛋白酶体将其降解成小肽。但是在体外培养的带有相同突变的细胞里面,并没有像预料中那样积累无用的糖蛋白——没有了N-聚糖酶,培养皿里面的细胞还是活得好好的,可是患病的人或者小鼠症状却很严重。显然有某一环缺失了。
学界开始怀疑一些细胞里面有某种底物,人如果没有患病,则一定是N-聚糖酶把糖类单元去掉了。但找到那些底物是很大的挑战。
Bertozzi 把这事告诉了Deshaies,发现正好问对人了。几年前,Deshaies研究过一个不寻常的转录因子,叫做Nrf1,并且他认为去除N-聚糖对这个转录因子对激活很重要。Nrf1在蛋白酶体不足的条件下,例如在蛋白酶体超负荷运转或者被药物抑制的情况下,会驱动蛋白酶体亚基基因的表达。Deshaies对Nrf1很感兴趣,因为它可能参与了肿瘤细胞对蛋白酶体抑制剂药物的抗药性,而这类药物其中之一卡非佐米(carfilzomib),正是他参与研发的。
根据这个建议,Bertozzi想到,N-聚糖酶将N-聚糖移除这一步对Nrf1的加工和激活来说,可能是重要的。那次会议剩下的时间里,Bertozzi都坐在后排搜索这个转录因子,阅读其各种小鼠敲除模型的表型报告——这些小鼠根本上复制了人类的NGly1疾病的表型。她简直难以相信——这个转录因子很有可能是最重要的底物!一回到斯坦福,她就写了研究计划。
接下来一年的工作证明这个推测完全正确——敲除该转录因子基因的小鼠和病人的细胞系都对蛋白酶体抑制剂很敏感。Bertozzi怀疑这个缺陷是NGly1病人一些神经方面的症状的原因,因为没有了Nrf1,他们的细胞无法应对蛋白酶体不足的情况。大家知道,神经元对蛋白降解与周转方面的问题特别敏感。
Bertozzi将他们的研究与斯坦福的临床科学相结合的目标不到一个月就实现了。这个项目起于一位病人和她的家人,现在是Bertozzi实验室的代表性成果之一。
创业尝试
这次来到斯坦福的第一年,Bertozzi就和发现Siglec的糖免疫学家Paul Crocker共同创建了Palleon Pharmaceuticals。(注:Siglec全称为sialic acid-binding immunoglobulin-like lectin,即“唾液酸结合免疫球蛋白样凝集素”,其中凝集素是一类能特异性结合糖基的蛋白质。)后续不到五年,Bertozzi又创建了四家公司。2017年,她加入了礼来(Eli Lilly and Company)董事会。2019年,风投机构Versant Ventures任命她为独家顾问。
Bertozzi认为自己的创业热忱来源于斯坦福式的合作成果,这是在伯克利不曾有过的经历。比如说,医学院的同仁听到这里有位糖生物学家,就会带着他们筛选药物靶点找到的有趣基因来找她。
Bertozzi对热门领域免疫肿瘤学(immuno-oncology)越来越感兴趣,因为在这一领域中,糖基化对免疫调控和肿瘤微环境起着重要的作用。她说:“对糖科学家来说这是个好时代——生物学家用基于Crispr的基因组筛查发现了越来越多起着重要作用的糖代谢相关基因,而且他们很愿意跟能够弄清相关生化通路的专家合作。所以如果你是你们那边的糖科学专家,你会接到很多电话,都来找你帮他们解释一列列名称跟一锅乱炖的字母汤似的的基因。”
Bertozzi说:“时时会有很多机会从你身边掠过,幸运的话你会发现其中那么几个。我们也肯定错过了好多,因为没法都注意到,我们的‘带宽’也就这么一点。但机会是时常有的,你若是注意到了,不妨上这趟车,看看它会带你到哪里。”
编译来源:https://www.chemistryworld.com/features/carolyn-bertozzi/3008380.article
本文来自微信公众号:返朴 (ID:fanpu2019),作者:返朴

