本文来自微信公众号:返朴 (ID:fanpu2019),作者:Annie Melchor,编译:于涛(美国印第安纳大学医学院),题图来自:视觉中国
我们都知道,人体内有一套复杂而高效的免疫系统,不但能够抵御病原体的侵袭,还能够将“变坏”的细胞扼杀在摇篮之中。同时,人体还为免疫系统配备了一个被称为“检查点”的刹车系统,它能够防止免疫反应被意外激活,或是持续的时间过长。而狡猾的肿瘤细胞则学会了“踩刹车”——它们能激活刹车系统,抑制免疫系统的攻击,从而得以在病人体内张扬跋扈。
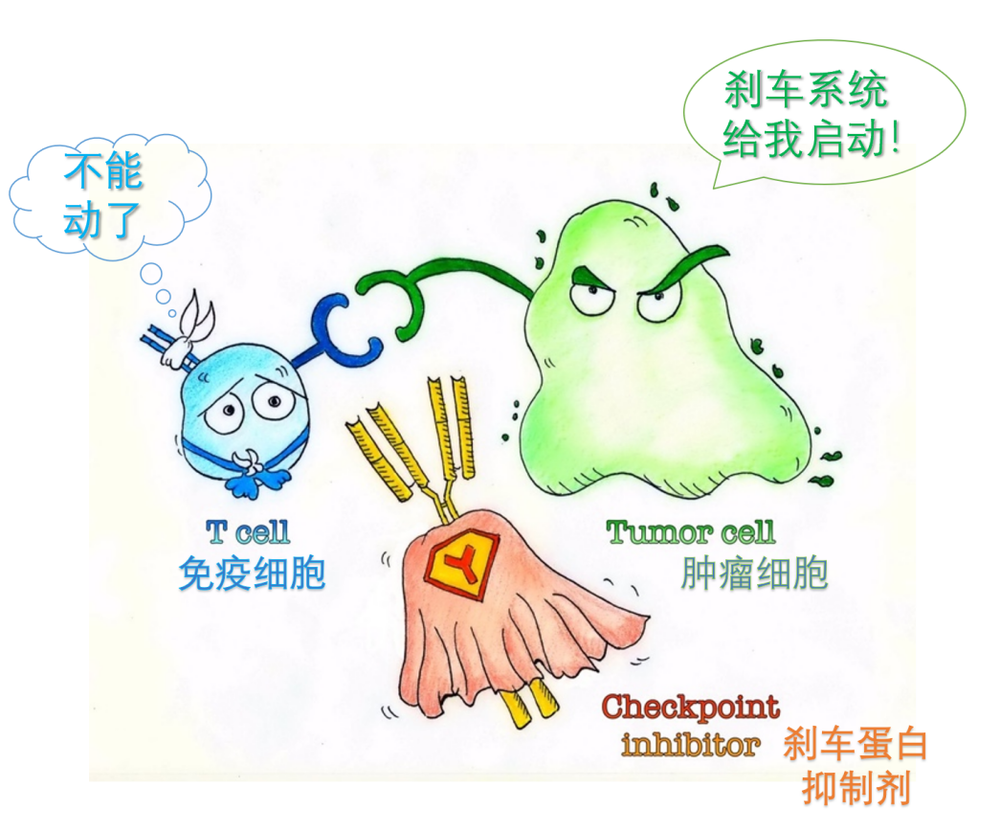
近年来,科学家们找到了许多存在于免疫细胞上的刹车蛋白,并且研制出了相应的抗体,能够结合这些刹车蛋白,并抑制刹车信号。将这些抗体输入肿瘤病人体内,就能解除肿瘤细胞对免疫细胞的抑制作用,重新激活免疫细胞的活性,从而起到抗肿瘤的效果,这便是近年来出现的“肿瘤免疫检查点阻断疗法”。
不过,随着越来越多临床试验的开展,医生们发现,阻断疗法对一些类型的肿瘤病人并不能起到很好的效果,但其中的原因不得而知。而让医生们意想不到的是,一种大脑中的寄生虫似乎给解决这个难题带来了一丝曙光。
一、疯狂的想法
用寄生虫来对抗癌症,似乎听起来危险而疯狂,但其实类似的想法在一个多世纪以前就已经有了。
大约在十九世纪二十世纪之交,纽约有一名癌症外科医生叫威廉·科利(William Coley),他在阅读旧病历时有了一个惊人的发现:一名本来会在七年前死掉的晚期癌症患者竟然活到了今天。病历中一条不起眼的记录引起了他的注意:这位病人曾经感染过一种细菌。那时,这样的小事丝毫不会引起医生的注意。但科利医生却做出了极为大胆的推测:会不会是这次细菌感染治好了病人的癌症?
于是他立刻开始进行试验,给自己的癌症患者注射活的或者灭活的细菌。在感染细菌后,有一些病人身上的肿瘤缩小并存活了下来,但并不是所有的病人都能那么幸运。经过长期的试验后,科利医生最终发明了一种含有灭活细菌的癌症治疗疫苗,注射后可以诱发炎症反应,足以杀死肿瘤细胞。由于疫苗所含的是灭活细菌,因此不会带来任何细菌感染的风险。
这种灭活细菌就被称为“科利毒素”。

然而,随着时间的推移,科利毒素逐渐失去了医生们的青睐。“很多人试图复制科利的工作,但效果不佳”,达特茅斯盖塞尔医学院的肿瘤免疫学家史蒂文·菲林( Steven Fiering)说:“放射疗法迅速取代了科利毒素。但不可否认的是,通过增强自身免疫系统以对抗癌症的总体思路一直都没有被人们忽视。”
二、治疗癌症的脑寄生虫
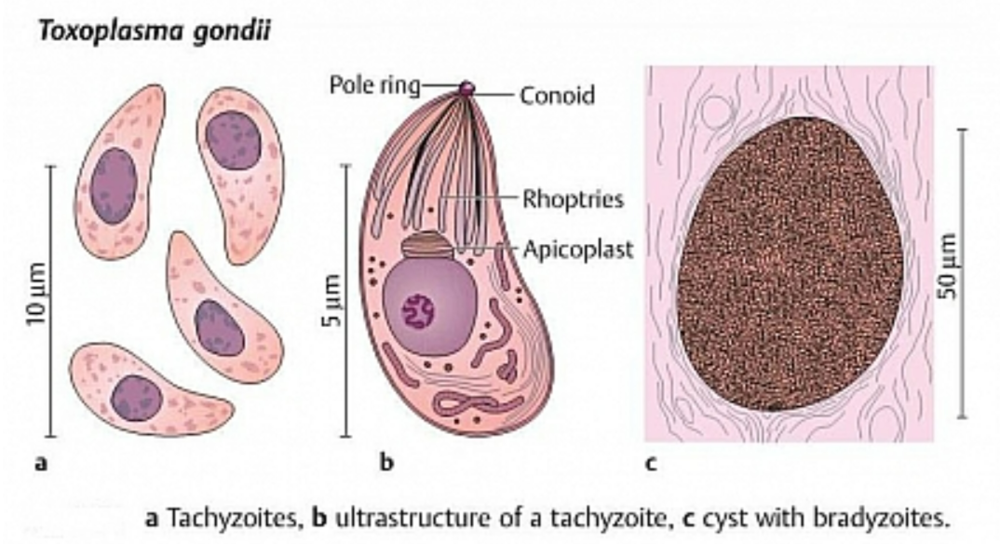
刚地弓形虫(Toxoplasma gondii)是一种比细胞还要小的寄生虫,它能够感染宿主的细胞,在里面扩增并产生后代。猫是弓形虫的唯一终宿主,弓形虫会在猫的体内产生大量的卵囊,并随着猫的粪便流入土壤或水中,感染大量的宿主。事实上,弓形虫可以感染几乎所有的温血动物,并长期存在于被感染动物的骨骼肌和大脑内。
尽管弓形虫在感染宿主时采取了巧妙的免疫逃逸策略,但在它生命周期的某些阶段也可以触发强烈的免疫反应。在感染初期,弓形虫以“速殖子”形式快速复制。此时,如果宿主死掉或被捕食者吃掉,那么弓形虫在经过捕食者消化道时便会被杀死,无法感染新宿主,因为此时弓形虫尚未安全置身于包囊内。
所以,为了确保在速殖子阶段宿主不会被杀死,弓形虫会在感染早期阶段就触发宿主强大的免疫反应,来控制其自身的复制扩增水平。具体来说,速殖子侵入细胞后,迅速大量扩增,并从细胞中喷薄而出,导致细胞死亡,同时引发全身和局部炎症。一般经历几周后,从最初的炎症爆发中幸存下来的弓形虫会隐藏在骨骼肌或大脑中的长寿命细胞中。
在这里,弓形虫转变为一种缓慢的复制形式——“缓殖子”,并构建一堵糖分子形成的“墙”,保护自己免受宿主免疫系统的攻击(见图4中的包囊)。虽然在偶发情况下,充满寄生虫的包囊会破裂并引发局部炎症,但大多数弓形虫可以在这些包囊中度过余生。在此之后,如果有捕食者摄入了含有包囊的组织,弓形虫便可以成功感染新的宿主。
微生物学家帕斯卡尔·吉顿(Pascale Guiton)是加州州立大学东湾分校研究弓形虫的专家。他说:“世界上约有三分之一的人可能已经感染了这种寄生虫。对于大多数人来说,感染弓形虫后往往不会出现症状。然而,对于免疫功能低下的人、孕妇和发育中的胎儿来说,弓形虫感染可能是致命的。目前还没有针对慢性弓形虫病的疫苗或治疗方法。”
二十世纪60年代到70年代,有科学家发现,弓形虫感染可以增强小鼠对癌症及多种感染的免疫抵抗力。随后的几十年中,弓形虫感染可能有助于癌症治疗的证据越来越多。2021年11月份发表在Journal for Immuno Therapy of Cancer (《癌症免疫治疗杂志》)上的一项研究则发现了更直接的证据:将弓形虫直接注射入小鼠的肿瘤内,可以极大地促进免疫检查点阻断疗法的疗效。
三、肿瘤原位疫苗接种
直接向肿瘤中注射免疫刺激剂(例如科利毒素、弓形虫)的治疗方法被称为原位疫苗接种(in situ vaccination)。根据菲林的说法,肿瘤细胞常常会部署一系列自我保护策略,削弱机体的抗肿瘤免疫反应,而原位疫苗接种可以重新激活被肿瘤所抑制的免疫反应,类似于一种佐剂。它能打破肿瘤局部的免疫抑制,激活或招募更多的肿瘤特异性 T 细胞,这些 T 细胞不但可以杀死局部的肿瘤细胞,甚至可以在早期杀死转移到其他部位的肿瘤细胞——而在这个阶段,临床医生通常都很难发觉肿瘤转移的迹象。
除了科利毒素,医生们还尝试了很多其他原位疫苗,比如减毒的李斯特菌,或包裹/携带着病原体抗原的纳米颗粒。2016 年,菲林的研究小组在小鼠模型上发现,含有灭活的缸豆花叶病毒(一种植物病原体)的纳米颗粒可以抑制卵巢癌、结肠癌和乳腺癌等多种肿瘤的生长。近年被FDA批准上市的溶瘤病毒T-Vec,在晚期黑色素瘤的治疗上也显示出很好的效果。
与众多其他原位疫苗接种方案相比,弓形虫所引发的免疫反应类型与众不同。这也是癌症科学家对弓形虫兴趣不减的原因。宾夕法尼亚大学的免疫寄生虫学家克里斯托弗·亨特(Christopher Hunter)解释道:“病原体各有特色,我们的身体对不同病原体的感染会产生不同类型的免疫反应。免疫系统应对弓形虫胞内感染的机制,与机体对抗一些癌症的途径相同,比如,两者都能引发强烈的T细胞反应,以及诱导白细胞介素12和干扰素γ之类的细胞因子”。
另外, 使用弓形虫作为肿瘤的原位疫苗还有一个巨大的优势:它们可以感染多种细胞和组织,对肿瘤类型并不挑剔,科学家们可以在多种模式生物中对其进行测试。
“当弓形虫被引入肿瘤时,它们确实会激发你所希望看到的抗肿瘤免疫”,达特茅斯盖泽尔医学院的寄生虫免疫学家大卫·比齐克(David Bzik)说道:“它重新唤醒了被肿瘤所抑制的免疫力”。
四、想法成为现实
2010年,比齐克的实验室敲除了弓形虫身上一种合成嘧啶的关键酶,制造出了一种无法复制的弓形虫,它可以在补充了尿嘧啶的培养基中正常生长和复制,但无法在宿主动物体内复制。如同不可复制的病毒载体做成的疫苗,这种有缺陷的虫株可以作为预防弓形虫感染的疫苗。
2013年,比齐克和菲林的实验室共同发现,在卵巢癌小鼠模型中注射这种缺陷弓形虫,可以显著提高肿瘤浸润性T细胞的数量和活性。他们还发现,如果把这些被激活的T细胞提取出来,注射到其他荷瘤小鼠体内,同样能够发挥出抗肿瘤效力。一些其他的研究也发现,缺陷弓形虫在胰腺癌和黑色素瘤小鼠模型上也能起到很好的效果。
诺丁汉大学的兽医哈尼·埃尔谢哈(Hany Elsheikha)和中国的合作者在他们的新论文中进一步证实了比齐克的发现。他们在多种荷瘤小鼠模型上采用了一种复制减弱的弓形虫虫株(不同于比齐克的虫株),发现这个虫株也能够促进杀伤性T细胞和自然杀伤细胞侵入肿瘤中,并增强免疫检查点阻断疗法的效果。也就是说,复制弱化虫株和免疫检查点抑制剂联合治疗,比单独使用抑制剂能够更有效地缩小肿瘤。不过,联合治疗只有在使用活寄生虫时才有效,而使用加热灭活的寄生虫则完全没有效果。同时,在载有两个肿瘤的小鼠模型上,将复制弱化虫株注射到其中一个肿瘤中并进行联合治疗,小鼠身上的另一个肿瘤也显著缩小了!这说明该疗法对于远端转移的肿瘤可能也具有治疗潜力。
比齐克认为这项研究具有重要的意义,特别是对癌症晚期患者而言。有许多患者直到癌症已经转移时才被诊断出来,此时要切除所有的肿瘤是几乎是不可能的事情。比齐克说,但这一研究给了我们新的希望——联合疗法对于远端肿瘤也具有显著的治疗效果——这样我们在治疗原位肿瘤的同时也能够靶向转移肿瘤。
当然,事情不会一直这么顺利。使用弓形虫作为原位肿瘤疫苗还面临着一个巨大的技术障碍。
由于疫苗只能使用活的弓形虫,而弓形虫只能在宿主细胞内生长和繁殖,因此在实验室培养弓形虫时也要依赖于细胞培养,这大大增加了获取弓形虫的难度和成本。事实上,在实验室中复苏新鲜细胞后,需要培养好几天才能够获得足够滴度的弓形虫,这在普通诊所中是不可行的。菲林曾经与达特茅斯的临床医生讨论使用弓形虫作为免疫疗法的潜力:“我们需要一些可以从冰箱中取出并直接注射到患者体内的现成产品,而不是每隔几天就必须从活细胞培养中恢复的东西。即便这在理论上是可行的,但从临床角度来看是不切实际的。”
抛开技术上的挑战不谈,许多科学家都怀疑,给患者注射活寄生虫的疗法(即使注射的是减毒的虫株)——尤其是对免疫抑制患者具有潜在威胁的疗法——是否真的能在临床上占据一席之地?
五、弓形虫作为工具
事实上,基于弓形虫的治疗从来都不是埃尔谢哈的目标。他说:“我们不会把它作为一种治疗方法来宣传,我们的研究目标是弄清楚弓形虫的感染和激活免疫反应的机制。”他不仅仅把弓形虫看作是一种病原体,而是将弓形虫视为了解基本生物学机制的有力工具。既然弓形虫能迫使靶细胞改变其正常的生物学特性,他想知道,是否可以创造性地利用这一点——“这正是我们在研究中所要努力搞清楚的东西”。
弓形虫还有另一个巨大优势,那就是它的遗传易处理性。
弓形虫基因改造有悠久的历史。与许多其他模式生物不同,操纵弓形虫的基因相对要容易些,免疫学家和微生物学家可以轻松地将弓形虫用作解决免疫系统问题的工具。亨特发现了白细胞介素 27在弓形虫感染期间抑制免疫反应的机制,基于该研究成果的1 期临床试验已经在进行中。研究团队期待着,能否在晚期实体瘤中看看怎么通过阻断白细胞介素27来解除肿瘤免疫抑制。
埃尔谢哈最近的研究成果也许可以告诉我们,对抗肿瘤需要什么类型的免疫反应。从这里开始,研究人员接下来需要搞清楚,如果不使用活弓形虫,如何在肿瘤中激发这样的免疫反应。
目前的研究还发现了一条很重要的线索,即,死亡的寄生虫不会引起相同的反应。这意味着,可能是活弓形虫分泌的某一种蛋白质增强了抗肿瘤免疫反应,而其表面的组成型蛋白质则没有这样的功能。如果能够鉴定出这种分泌蛋白,我们离目标就不远了。
此外,从癌症生物学的角度来看,重中之重是要了解感染是怎么促进免疫检查点阻断疗法的。比齐克说:“目前 FDA 批准的所有治疗方法都在使用免疫检查点抑制剂。但科学家和临床医生并不知道为什么对有些患者(其实是大多数患者),或是在某些类型的癌症中,免疫检查点阻断疗法的疗效却不怎么好。如果研究人员能够弄清楚“感染”是怎样克服肿瘤的免疫抑制的,他们可能会发现改善疗效的方法。”
吉顿补充说:“用寄生虫来治病并非闻所未闻,但我们目前还不能广泛地使用它,因为我们对寄生虫生物学了解得还不够深入。部分原因是政府对基础寄生虫学研究的资助不足,尤其是在受寄生虫影响较轻的国家。要想通过探索这些寄生虫来帮助人类,比如治愈更多的癌症病人,我们真的需要深入研究它们。”
本文经授权编译自 TheScientist.com,原文标题为Turning Toxoplasma Against Cancer,配图为译者所加。
本文来自微信公众号:返朴 (ID:fanpu2019),作者:Annie Melchor,编译:于涛(美国印第安纳大学医学院)

