本文来自微信公众号:健识局(ID:jianshiju01),作者:古月,头图来自:视觉中国
年关将至,PD-1/PD-L1市场弥漫的气氛却不那么喜庆。
12月21日,基石药业的PD-L1舒格利单抗正式上市。至此,国内市场PD-1/PD-L1产品已达到了12款,其中国产品种8个。
业内已经不讲“内卷”了,而是说:我们每家都需要PD-1。
“联用”的说法,和当年的“万能抗癌药”一样,很容易被市场打得找不到牙,各家都明白这个道理。于是,有的药企开始努力证明自己是“最优的”。
12月16日,正大天晴自研的PD-L1单抗TQB2450 联合安罗替尼,开展了一项对标百济PD-1替雷利珠单抗的头对头Ⅲ期临床试验。这是正大天晴为自家这款产品启动的第二项头对头试验,另一项对照的是默沙东的K药帕博利珠单抗(注:K药,商品名可瑞达,英文名Keytruda,是抗癌药的一种)。
多年来,K药不进医保,今年甚至都没参加医保谈判,但依然是PD-1领域“神一样的存在”。上市7年来,K药拿下了29项适应症,销售额远超其他品种。啃下K药,成了国内外PD-1/PD-L1的理想。
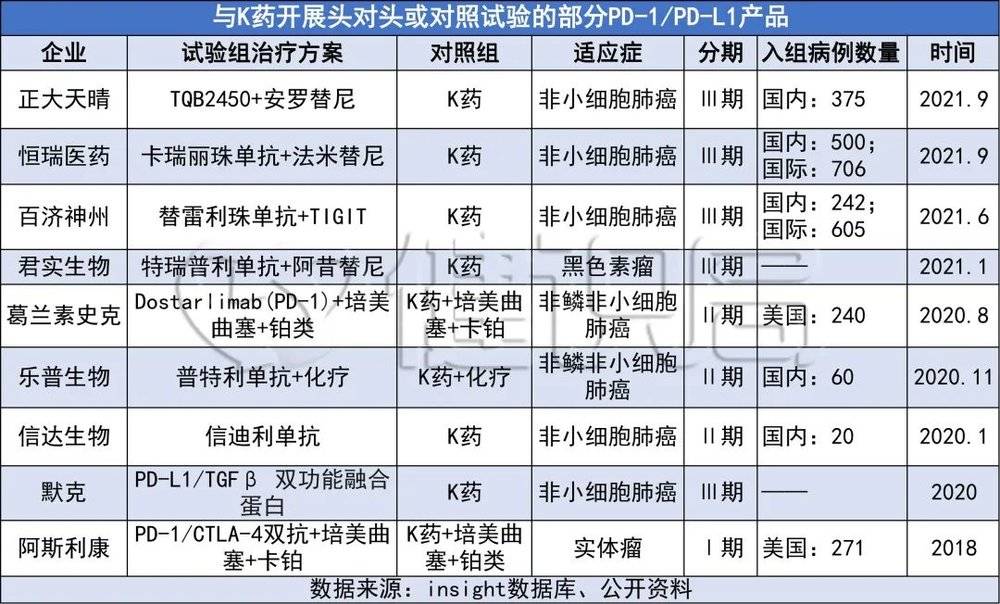
健识局粗略统计,包括恒瑞、百济神州、君实、信达、乐普在内,诸多国内企业都曾开展过针对K药的头对头或对照试验。
药企们嘴上都很淡定,身体却很诚实:
PD-1领域的竞争没有特殊空间,只有挤掉对手才行。
一、白月光K药
一个有意思的数据是:2021年以来,用在对照组的K药就可能治疗了500多名癌症患者。
K药在疗效上的地位确实难以撼动。
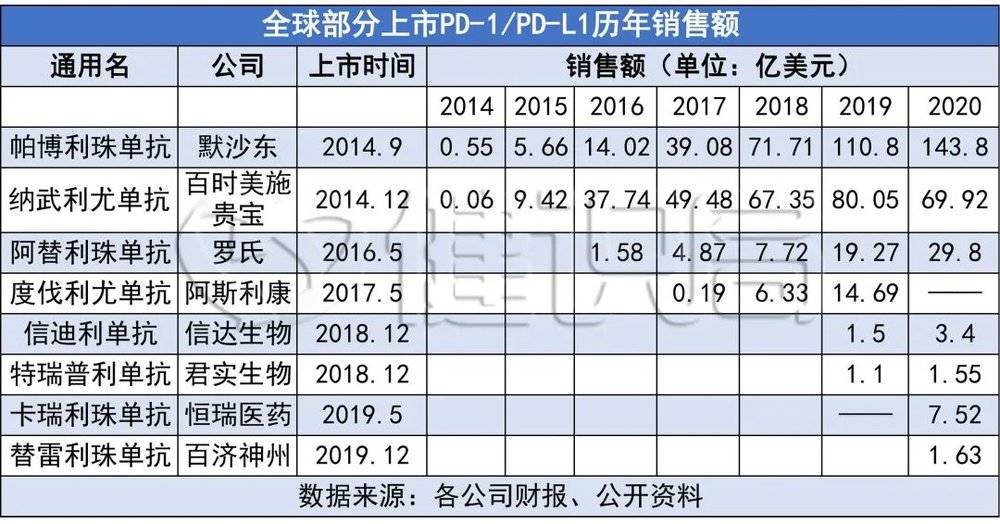
自2018年开始,K药的销售额连续三年摘得PD-1/PD-L1市场桂冠。2020年,K药在全球总共卖出了143.8亿美元,比第二名的O药高出了2倍不止。
今年6月,默沙东在一场投资者会议上宣布,目前K药已在超过30种癌症类型中显示出活性;8月召开的欧洲医学肿瘤学会公布的数据显示,当下K药治疗晚期肺癌的5年生存率已经达到31.9%,是化疗的2倍左右。
尤其是11月份,CDE关于肿瘤药物临床研发的指导原则正式落地,“阳性对照”成为必选项。未来,只有证明自身“优效性”的药物才能够被认可,这让肿瘤药上市的门槛变得更高。
像正大天晴这样,还没上市就开始琢磨“头对头”,时也命也。
早在今年7月,CDE新规征求意见稿出炉之时,有药企研发负责人就曾对健识局表示:这其实是在暗示,一些小药企应该转换思维,不要在PD-1等内卷靶点上“死磕”了。
然而,能像当年礼来那样及时止损的企业毕竟不多。头对头试验的风险和成本是明摆着的,众多已上市的国产PD-1/PD-L1只能选择将K药作为对照药物。
上述药企研发负责人认为:目前国内PD-1/PD-L1的竞争,考验的其实是商业化能力。如果只是想拿适应症,未必需要做头对头。
“开展头对头,更重要的目的在于开拓海外,尤其是美国市场。”
另有药企人士也向健识局证实,由于不同人种在数据结果上还是存在差异,如果有海外入组数据,会更受国际认可。
二、海上也不安全
PD-1需要出海,是所有企业的共识;但在海的另一边,FDA正在收紧准入规则。
12月20日,信达生物召开线上会议,紧急回应有关美国收紧PD-1/PD-L1药物上市政策的传言。信达生物回应称,信迪利单抗出海进程“按计划的时间表在走,公司对药效也有信心”。
此前,信达生物基于国内进行的Ⅲ期临床数据,向FDA提交了信迪利单抗上市申请,并没有纳入足够数量的海外患者。对此,FDA启动了外部专家投票。
更为重要的信息是,12月中旬,FDA的两位顶级癌症医生在《新英格兰医学》杂志上联合发文表示:全球PD-1/PD-L1市场已经冗余,但数据显示目前仍有超过2000项临床试验正在进行中。已上市的适应症中,45%都是选择先单臂试验申请加速审批上市,再做临床确认。
走捷径的恶果是:数据结果不一致。
健识局注意到,罗氏、阿斯利康、百时美施贵宝、默沙东4大PD-1/PD-L1企业,都曾因为后续验证性试验未达终点“自愿撤销该项适应症申请”。
“行业应该遏制过度的研发热情,不要执着于开发me too药物。”两位FDA专家直言,如果企业真的像自己说的那样在做“优效”产品,就直接做头对头试验。
业内人士分析,这其实不是在鼓励大家真的盲目去做头对头,而是希望企业都冷静下来,将关注点重新聚焦到药品质量本身上。
和单臂试验相比,头对头成本高很多。多数国内创新药企在海外其实没有什么临床团队,只能选择把项目外包给CRO公司,无形之中又增加了成本。
前述药企人士估算,如果按照国内当前的成本,临床试验平均每个患者身上的花费在30万元到50万元不等。但如果对照K药开展国际多中心试验,费用还会高出很多。
目前,国内K药年费是17.9万元,以此推算,300人以上的Ⅲ期临床试验,光是买对照药就要几千万。如果是海外头对头临床,买药花费可能要上亿。
头对头试验的失败者很难再在市场上立足。今年年初,默克宣布终止PD-L1/TGFβ对比K药进行的针对非小细胞肺癌的Ⅲ期临床试验。原本被寄希望于成为二代PD-1的明星产品,就此失去了一大批忠实的拥护者。
出海问题上,国内第一梯队的PD-1生产企业纷纷选择了对外授权。如百济与诺华、信达与礼来、君实与Coherus,把市场化风险和压力转移给了国际大药企。目前,这也是一条大家都挤破头的渠道。
“早上市真好啊。”一位药企人士对健识局感慨。
本文来自微信公众号:健识局(ID:jianshiju01),作者:古月

