9月25日,CDE发布《仿制药质量和疗效一致性评价受理审查指南(征求意见稿)》,其中一条引发行业热议。
《意见稿》提到:自第一家品种通过一致性评价后,三年后不再受理其他生产企业相同品种的一致性评价申请。
这其实不是新规则。2018年国家药监局在《关于仿制药质量和疗效一致性评价有关事项的公告》中,已经明确这一规则。CDE此次发布,是从审评流程上做的一次敲定,并在文件中将之前的“不予再注册”改为“不再受理申请”。

企业在申请时需对该项作勾选 图源:CDE官网文件
行业普遍认为:这条政策主要针对有批文但未过评或没有实际生产的仿制药,目的就是清退大量陈旧批文。因为在现行制度下,未过评仿制药一般会被撤网。
值得注意的是,这一规则并不影响新3类、新4类仿制药上市视同过评的情况。也就是说,即使首家过评三年后,企业仍旧能以新的3、4类仿制药申请上市。但相应地,所需的临床效果方面的门槛也将更高。这或将倒逼企业从一开始临床设计就必须考虑做一致性评价,药物开发更加以疗效质量为导向。
“僵尸”批文出清,拒绝仿制药低劣和同质化竞争,CDE这回来真的。
《意见稿》也保持了之前审批上的灵活度:针对临床必需、市场短缺品种,可向所在地省级药监部门申请延期评价;境外生产药品或港澳台生产医药产品,可向国家药监部门提出延期申请。
另外,《意见稿》还要求企业承诺:补充申请一致性评价的药品,其在国内外上市的该产品均采用同一生产线,且原辅材料的来源与质控、处方工艺、质量控制要求等都要保持一致。
一、仿制药批文大清理
强调仿制药一致性评价的新规则,表明在前一阶段开展集采的基础上,国家药监局开始要清理那些落后于时代的药品批文了。
2003年国家药监局统一药品批准文号以来,仿制药多小散乱的问题一直未能彻底解决。2012年开展一致性评价以来,部分好的品种脱颖而出,但差的品种没有被淘汰。
以盐酸二甲双胍片为例,国家药监局上显示的批件共124条,2018年石药集团首家过评,目前已超50个品规过评。
按照新的规则,二甲双胍剩余的70多个批文有效期一过就将失效。
过去几年,仿制药批文也曾有过大清理。2016年,国务院办公厅发布《关于开展仿制药质量和疗效一致性评价的意见》,要求2012年版基药目录中289个品种在2018年底完成一致性评价,最晚不得超过2021年,否则就不给再注册。这在当时引发一片哗然,业内称“仿制药大限将至”。
一致性评价不是一件容易的事,评价成本涵盖BE试验等在内,大概在500万元以上。国务院文件要求的289个品种都是2007年10月前获批的药物,疗效层次不齐,做一致性评价存在很大的不确定性,药企肯定不愿意看到自己的产品评价不通过,因此政策发布后进展并不快。
2017年年底,国家药监局发布第一批通过一致性评价品种,数量仅17个品规,属于289个基药的只有4个。
于是2018年开始,国家药监局调整政策,规定成首个过评三年后不予再注册,主要针对口服制剂。2020年,国家药监局又细化了注射剂一致性评价的技术要求。
CDE发文再次强调三年期限,信号已经非常明确:一致性评价会是仿制药的金标准。只要同通用名有一家企业过评,往后三年除了卷速度,仿制药企还得在质量上卷起来。
这样一来,CDE也能够专注在更具临床价值的药品批准。
二、3家过评,其余不过评就撤网
为了不让做过一致性评价的企业吃亏,这几年多部委出台了不少配套政策。
2016年国务院文件里已经明确:通过一致性评价的药品品种,在医保支付方面予以适当支持,医疗机构应优先采购并在临床中优先选用。另外,通过一致性评价药品生产企业的技术改造,符合条件的话,可以申请中央基建投资、产业基金等资金支持。
最关键的一条是,同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种。
地方均在落实这项政策。以辽宁为例,2019年曾发文表示:当地挂网品种同通用名有3家过评的,三家过评,其他未过评品种直接撤网。今年6月、9月,辽宁已发布两批因此暂停挂网的品种名单,其中不乏上市企业的品种,如广州白云山每瓶含量1g的注射用哌拉西林钠、石药每瓶含量1.125g的注射用哌拉西林钠他唑巴坦钠等。
过评品种在集采中的优势也有凸显。2018年12月的“4+7”带量采购试点中,25个中标品种内,除原研药,仿制药基本都是过评品种。集采非中选且未过评的品种则大多被清退。
一致性评价正在重塑行业的格局,这也是当初设定这一制度时想要达到的初衷。
大药企在申请一致性评价上更有优势,齐鲁制药、成都倍特、石药是目前补充过评通过数量前三的企业。2022年,通过一致性评价品规数量的前几家企业分别是山东鲁抗、齐鲁制药、成都倍特和罗欣药业;获批时视同过评数靠前的则是扬子江、石药、科伦。
值得注意的是,视同过评的新注册仿制药正在成为大趋势。2019年,仿制药一致性评价的补充申请数量达到顶峰后开始下降,2022年新注册分类仿制药申请数量突破2000条,是补充申请数量的近3倍。2022年,新注册视同过评的仿制药数量已经超过补充过评的数量。
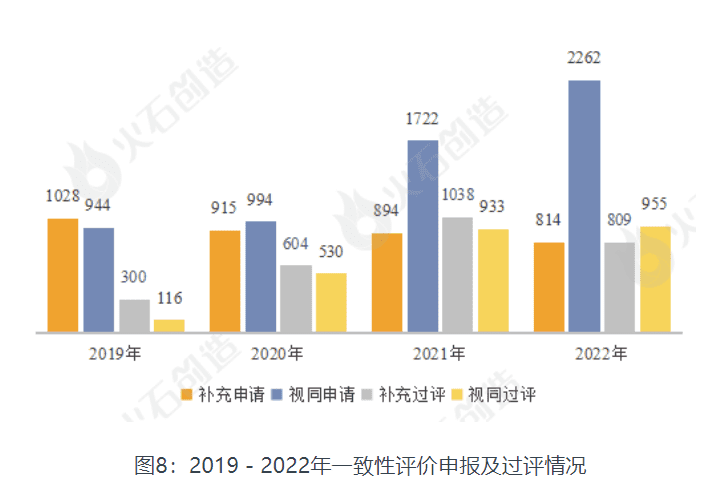
图源:火石创造
一致性评价推进下,仿制不再是复制的代名词。仿制药企需要及时改变以前重销售、轻研发的思路,才能适应时代的变化。再加上集采促使仿制药价格不断下探,致力创新,提高自己的产品门槛是仿制药企需要考虑的。
本文来自微信公众号:健识局 (ID:jianshiju01),作者:杨曦霞,编辑:江芸、贾亭

