 图源:辉瑞官网
图源:辉瑞官网戏剧性的是,就在一天之前,全球首个获批上市的新冠口服抗病毒药刚刚出炉——默沙东与 Ridgeback Biotherapeutics 联合开发的抗新冠病毒药物 Molnupiravir 在英国获批上市。(点击链接查看往期文章《全球首个新冠口服药上市!死亡风险降低 50%,能终结疫情吗?》)
据 Molnupiravir 的 III 期临床中期数据,该药可令新冠患者住院或死亡风险显著降低约 50%。
前一天是全球首款,后一天有效率高达 89%,新冠口服药也开始卷起来了?
跨越 17 年的研究
讨论「卷不卷」之前,先来聊聊辉瑞这款新冠口服药 PAXLOVID 到底是怎么回事。
新冠病毒是蛋白质包裹的单链 RNA 病毒,病毒本身并没有完整的细胞结构,它的复制必须在宿主细胞中完成。
想要生产,得有材料。在冠状病毒的复制过程中,RNA 先会编码出 2 个大的多聚前体蛋白和 4 个结构蛋白。多聚蛋白需要经过蛋白酶水解产生短的、非结构蛋白,促进病毒复制。
在水解过程中,起到关键作用一种酶叫做 3CL 蛋白酶(也叫主蛋白酶,Mpro)。
辉瑞研发的 PAXLOVID 实际上是一款复方抗病毒药物,包括 PF-07321332 和利托那韦(Ritonavir)两个部分。其中,PF-07321332 正是一种新冠病毒的 3CL 蛋白酶抑制剂。
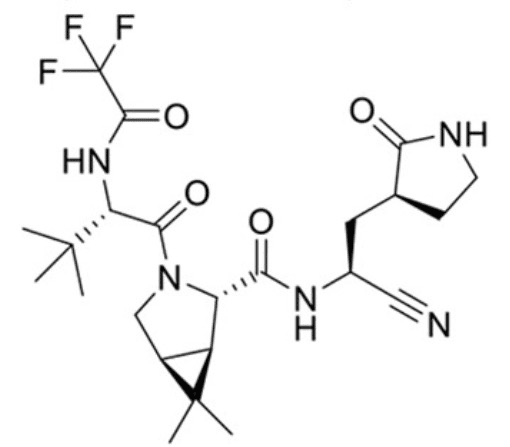 PF-07321332 分子结构
PF-07321332 分子结构图源:参考资料 1
PF-07321332 的研发也并非一日之功。
17 年之前,在 SARS-CoV 流行时期,辉瑞的研发团队曾试图以 Rupintrivir(人鼻病毒 3C 蛋白酶的不可逆抑制剂)为起点,设计 SARS-CoV 的 3CL 蛋白酶抑制剂。在经过了一系列优化后,得到了 PF-00835231。
然而,随着 SARS-CoV 流行的结束,进一步的研究也被搁置。直到 2020 年新冠疫情爆发,研究发现,新冠病毒和 SARS-CoV 复制所需的 3CL 蛋白酶的序列在蛋白质切割的催化位点 100% 相同,辉瑞这才把差点被埋没了的 PF-00835231 翻出来继续开发。
研究前试验表明,PF-00835231 的活性好且代谢稳定,但渗透性和口服吸收利用度却很低。因此,辉瑞研究团队在前一化合物的基础上经过进一步优化,得到了 PF-07321332。
PF-07321332 对病毒的抑制活性非常强,在表达 ACE2 蛋白的人气道上皮细胞、HeLa 细胞和 A549 细胞中,PF-07321332 的半抑制浓度 IC50 分别为 62、99 和 56 nM(IC50 越低,活性越强。对比来看默沙东 Molnupiravir 的 IC50 为 220 nM,吉利德 Remdesivir 则是 651 nM。)
在进一步探索中,研究人员发现,CYP3A4(细胞色素 P450 3A4 酶)在 PF-07321332 的药物代谢中起到重要作用,加入强 CYP3A4 抑制剂如利托那韦后,可以有效提高 PF-07321332 的治疗浓度。
至此,PAXLOVID(PF-07321332+Ritonavir) 正式诞生。
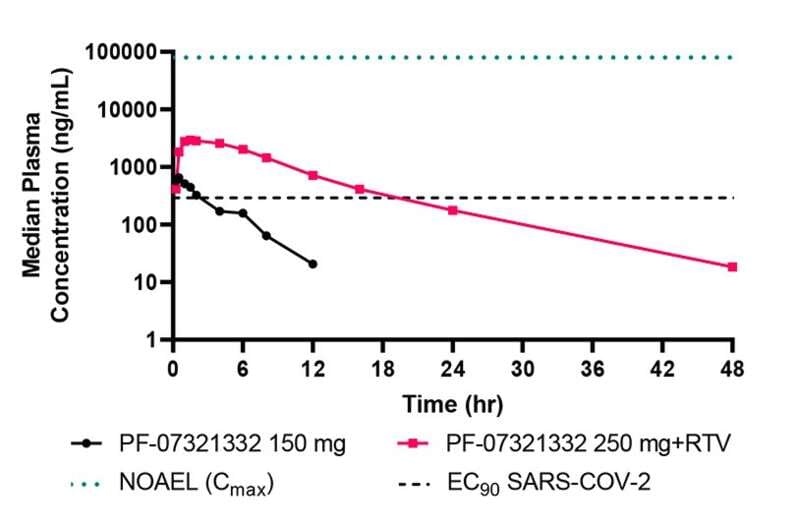 PF-07321332(黑)与 PF-07321332+利托那韦(红)(图源:参考资料 1)
PF-07321332(黑)与 PF-07321332+利托那韦(红)(图源:参考资料 1)住院或死亡风险降低 89%
那么,PAXLOVID 的效果究竟如何?让我们回到辉瑞的 II/III 期临床试验。
该临床试验今年 7 月开始入组,中期数据来自 9 月 29 日前的 1219 名患者分析。这些患者来自北美、南美、非洲、亚洲、欧洲等多个国家的临床试验点,其中 45% 的患者来自美国。
在不良反应方面,药物组和安慰剂组的不良反应发生率分别为 19% 和 21%,大多数不良反应是轻微的。相比于安慰剂组,药物组的严重不良反应率(1.7% vs. 6.6%)和由于不良反应而终止临床试验的发生率(2.1% vs. 4.1%)都更低一些。
而在最重要的有效性方面,在症状出现后 3 天内开始治疗的患者中,由于新冠导致住院和死亡风险降低了 89%。
在 PAXLOVID 药物组,只有 0.8%(3/389)的患者在分组后 28 天内需要入院,无死亡事件发生;而安慰剂组的这个比例是 7%(27/385),差异显著(p

