本文来自微信公众号:集智俱乐部(ID:swarma_org),作者:熊一蓉,审校:梁金,编辑:邓一雪,原文标题:《脑的进化:更大的脑容量预示更高的智能水平?》,题图来自:unsplash
脑常常被认为是思想的物质载体,奇妙的想法、英明的决策都在脑中形成。36亿年的历史长河中,生命从蓝藻这样的单细胞生物演化成了多种多样拥有智能的物种。而要探索“智能”这一抽象概念的进化历程,脑这一具象器官作为思想的“容器”,为研究提供了出发点。
一、大脑的进化
成年人的大脑重量约为1.5kg,在动物王国中算是数一数二的“大脑袋”。相比娇小的身躯,人脑的异速增长引发了一种朴素的猜测:更大的脑子可能更加复杂,从而拥有更多“智能”。
为了检验了这一假设,一项发表在《科学·进展》上的研究使用1400种哺乳动物(根据物种相似程度,分为30个演化极)的脑、身质量数据,分别对每个演化极上的脑身质量关系进行拟合,重建了1.5亿年来大脑的进化历程。
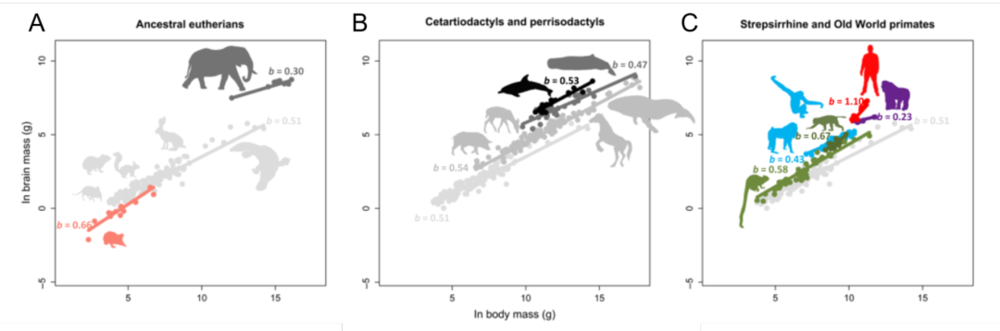
如图1所示,对于五种脑身质量比较大的动物(大象、猿类、古人类、齿鲸和海豚),研究者们分析了它们在进化过程中获取“大脑”的途径。这些大脑袋动物基本都出现在古新世到新生代的过渡期,但采取的策略却各不相同:有的在身体长大的过程中优先长脑(图1A,大象),有的减小了身体重量却尽量保持了脑重(图1B,齿鲸和海豚)。值得一提的是,在除古人类以外大部分拥有大脑袋的动物中,脑重的增加都是体重上升的副产品;而猿到人的跃迁中,脑重迅速增加,身体质量却在减小(图1C)。
人类的特别不仅体现在这一次脑质量的跃迁,还体现在物种内部对脑和身体质量变化的接受度。在除人以外的大部分物种中,个体间的脑重变异度较低,体重的变异则很高。但古人类不同个体间的脑重变异很大,甚至达到了猿类变异的6.45倍。
研究者认为,要把脑的增重规律线性推广到智能的增长,一个必要的基础假设是不同脑区以相同的速率增长。而多项研究已经证实了不同脑区在进化中是异速生长的。因此,研究者们认为,认知能力的变化规律并不能直接通过脑身比进行预测。
二、深入大脑的内部结构
如果把脑作为一个整体,所能探索的指标有些局限。大脑是一个复杂的系统,当我们深入到大脑的构造,就会发现,能刻画脑进化的指标远不止质量、体积和直径,还有大脑皮层面积、神经元数量等。更多指标在进化上的变化规律以及它们之间的联系,能够让我们从更多角度对进化中的脑这一命题进行观察和思考。
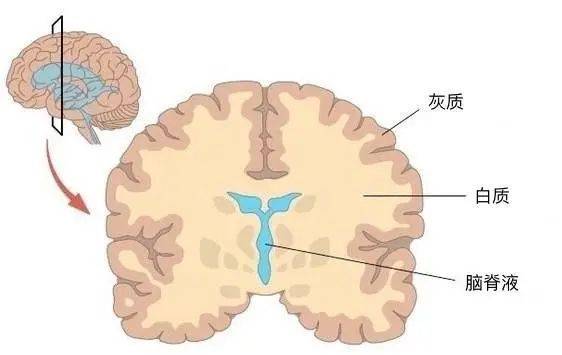
(1)大脑皮层
在进化中,为了尽量保证膨胀的大脑内神经元间的连接,大脑皮层开始出现越来越复杂的折叠模式。就像揉皱一张A4纸,随着折叠程度的增加,纸的外表面积不断缩小。这种折叠方式将欧几里得空间的二维平面引向了分形几何,从而在有限的颅内空间塞入了更多的计算单元。
Mota等人对皮层总表面积(total surface area, Ag)、外表面积(exposed surface area, Ae)和厚度(thickness, T)的变化规律进行了模拟,发现 Ae 与 T1/2Ag 之间满足1.25的幂律关系:
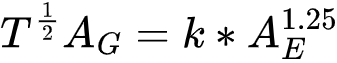
他们使用了6个物种的相关指标,对发现的规律进行验证(图4A)。发现在不同物种间,这三个指标之间的关系都十分一致,皮层的外表面积和折叠程度(Folding Index, Ag/Ae)等指标由皮层厚度和皮层总面积共同决定。
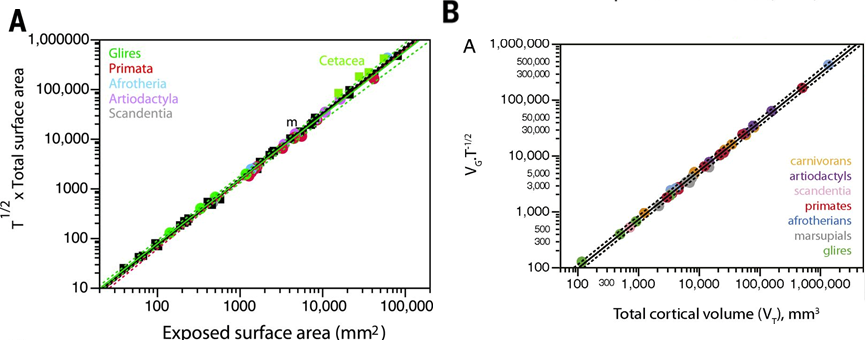
此后,Mota在更大的样本集和更多的指标上对这一结论进行了检验。如图4B所示,他们获取了38个物种上的皮层总表面积、外表面积、厚度、灰质体积和白质体积等指标。如果此前得到的面积(Ag、Ae)与厚度(T)的关系在所有物种中普适,那么,将其推广到体积应该也成立。所以,基于Ag和T与Vg的关系、Ae与Vt的关系,VgT-1/2将与Vt存在0.83的幂律关系。结果显示,不同物种间的实验数据普遍符合该规律。
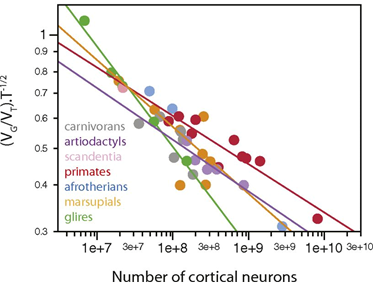
(2)神经元数量
进一步地,Mota等人探索了神经元数量与皮层厚度、体积等宏观指标的关系。在每个演化枝(clade)内部 ,
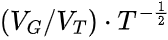
与神经元数量之间存在幂律关系,但这种关系不是普遍存在的。
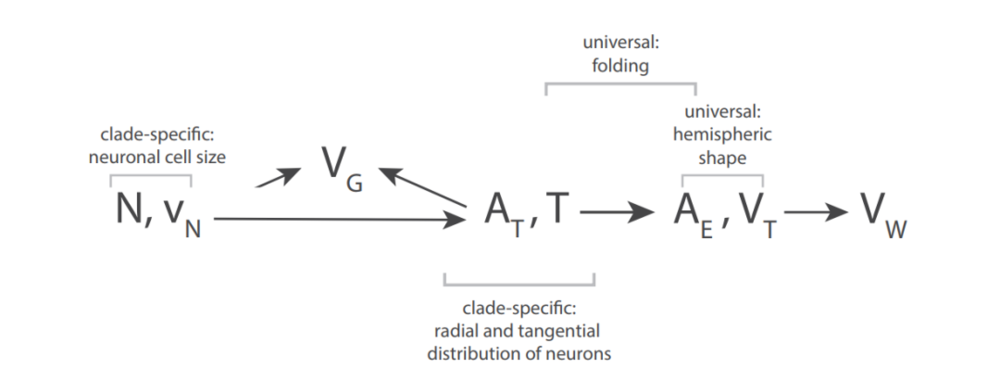
总结上述规律,研究者们发现在进化上,神经元指标(数量和体积)、灰白质指标(皮层表面积、厚度和体积,以及白质体积)间呈现出了一定的规律(图6)。每个演化枝上都有其特有的神经元指标和皮层面积、厚度,但皮层的折叠情况在不同进化枝上存在统一的普遍规则。因此,影响进化中大脑的主要是四个指标:神经元数量、体积、皮层面积和厚度。研究者认为,这些指标的变化主要受到基因的调控。
三、空间尺度上的进化
(1)不同脑区皮层面积扩张存在差异
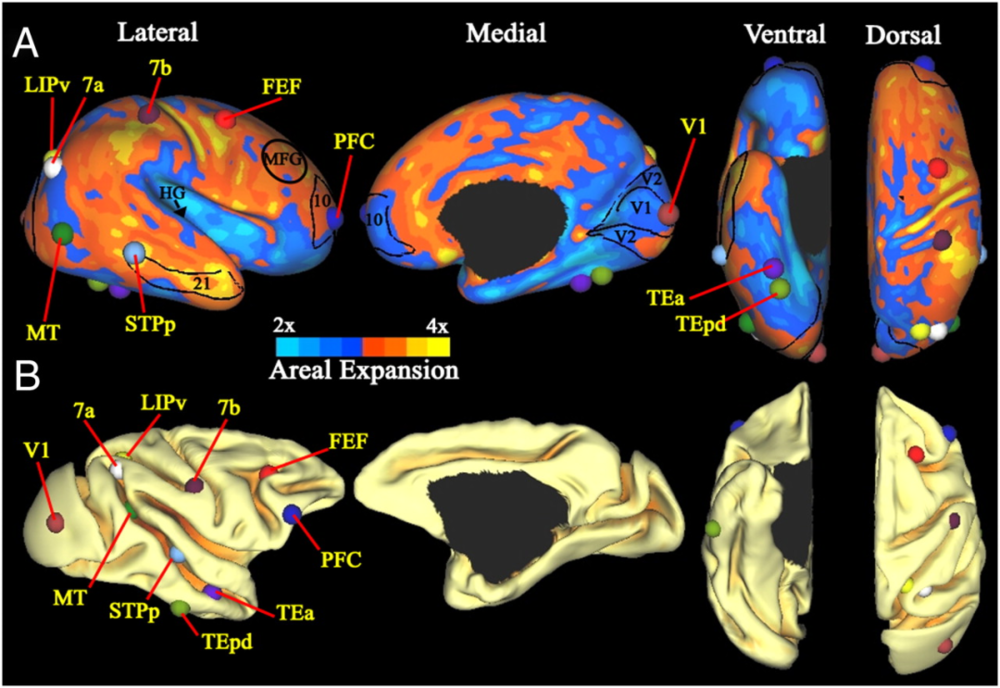
脑的进化不仅具有时间尺度,也有空间尺度。在进化过程中,不同脑区面积的扩张也存在差异。如图7所示,Hill等人对比了人类和猕猴的大脑皮层,发现侧颞(lateral temporal)、顶叶(parietal)和额叶(frontal)皮层的扩张几乎是岛叶(insular)和枕叶(occipital)皮层的2倍。这种扩张模式在人类自身的脑发育过程中可以复现。
这些膨胀率大的区域主要为负责多种功能的联合皮层,而功能较为单一的初级皮层在物种间和发育中的面积变化较小。研究者认为,这些在发育中膨胀程度较小的区域可能对生存更加关键,因此在生长早期就达到了成熟;而膨胀程度大的区域更多来自后天经验,用于处理更加复杂的信息。
(2)不同脑区神经纤维增速不同
除了神经元自身的数量、皮层面积的变化,进化还伴随着白质的改变。
Wang等人发现,随着大脑体积增大,为了使信息顺利、及时地在不同区域间传递,大脑对神经兴奋传递速度的要求提高了。但同时,更快的速度也意味着更粗、或长度更短的神经纤维。受到布线成本的影响,要让所有神经纤维同时满足“保持兴奋传递时间不变”是不现实的。在进化中保持哪些关键纤维的兴奋传递时间,成为了大脑增大过程中必须面对的决策。
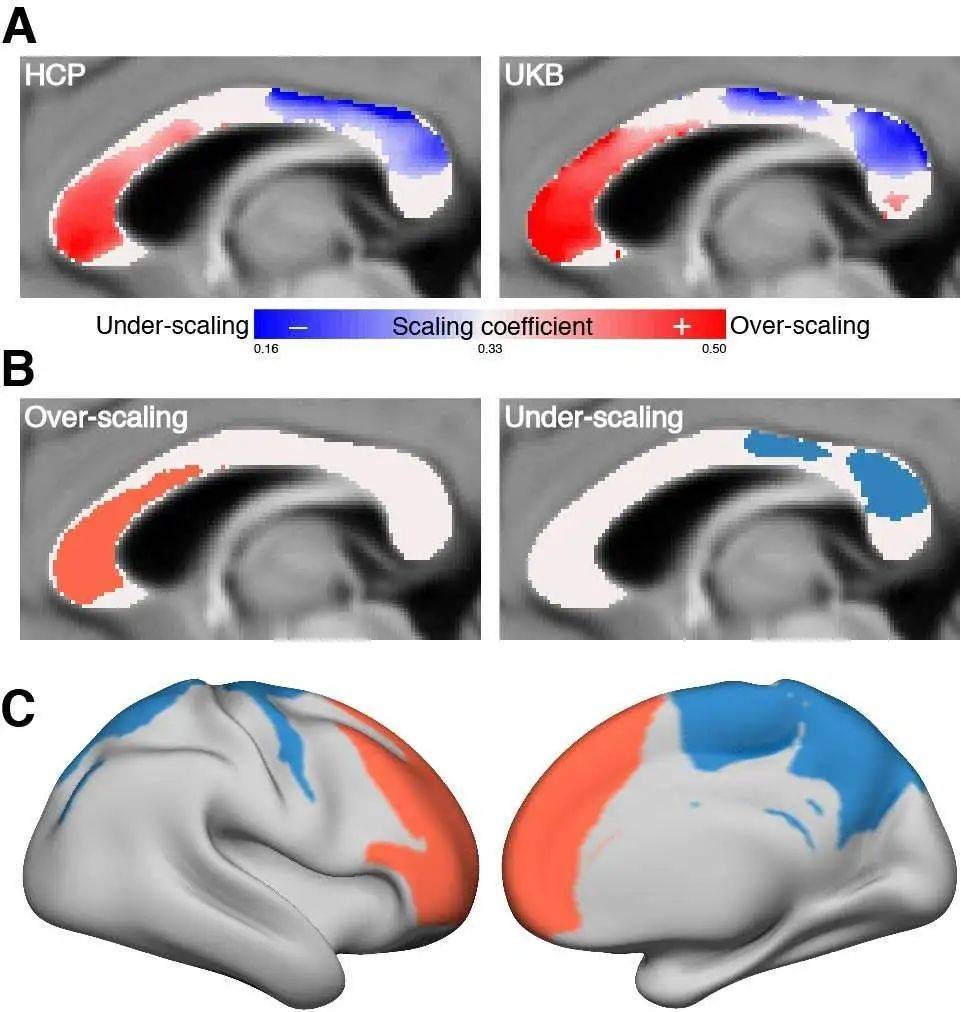
Gong等人基于大样本人群,探究了人脑体积增长与连接不同脑区神经纤维增长速度之间的关系,为进化上的布线原则提供了一种可能的答案。假设神经纤维与脑体积增长等速,神经纤维长度的增长速率应该是体积增长速率的1/3。如图8所示,他们发现,随着脑体积的增长,连接额叶的神经纤维呈现过增长(over-scaling)趋势,而连接大脑左右两侧躯体感觉和运动区的神经纤维则呈现出低速增长(under-scaling)。
四、结语
在进化中,脑袋相对大的物种主要出现在古新世到新生代的过渡期,不同物种达到大脑袋的方式有所不同。物种特征间的斜率与截距能够有效地捕捉到进化的规律和自然选择的作用。同时,随着脑体积的增长,一些脑指标间存在共变。对于一个物种来说,至关重要的信息可能是受到基因调节的神经元数量、体积、皮层面积和厚度。而在空间上,皮层面积的增长和纤维长度的增长规律均表现为:在多模态皮层过增长,而在初级皮层增长速率较低。这从另一个角度提示我们,进化中脑的策略可能与皮层功能密切相关。
论文题目:
The evolution of mammalian brain size
参考文献
[1] Mota, B., Dos Santos, S. E., Ventura-Antunes, L., Jardim-Messeder, D., Neves, K., Kazu, R. S., Noctor, S., Lambert, K., Bertelsen, M. F., Manger, P. R., Sherwood, C. C., Kaas, J. H., & Herculano-Houzel, S. (2019).
[2] White matter volume and white/gray matter ratio in mammalian species as a consequence of the universal scaling of cortical folding. Proceedings of the National Academy of Sciences of the United States of America, 116(30), 15253–15261. https://doi.org/10/ggxdth
[3] Smaers, J. B., Rothman, R. S., Hudson, D. R., Balanoff, A. M., Beatty, B., Dechmann, D. K. N., Vries, D. de, Dunn, J. C., Fleagle, J. G., Gilbert, C. C., Goswami, A., Iwaniuk, A. N., Jungers, W. L., Kerney, M., Ksepka, D. T., Manger, P. R., Mongle, C. S., Rohlf, F. J., Smith, N. A., Safi, K. (2021). The evolution of mammalian brain size. Science Advances, 7(18), eabe2101. https://doi.org/10.1126/sciadv.abe2101
[4] Mota, B., & Herculano-Houzel, S. (2015). Cortical folding scales universally with surface area and thickness, not number of neurons. Science (New York, N.Y.), 349(6243), 74–77. https://doi.org/10.1126/science.aaa9101
[5] Hill, J., Inder, T., Neil, J., Dierker, D., Harwell, J., & Essen, D. V. (2010). Similar patterns of cortical expansion during human development and evolution. Proceedings of the National Academy of Sciences, 107(29), 13135–13140. https://doi.org/10/dzkpr6
[6] Yang, L., Zhao, C., Xiong, Y., Zhong, S., Wu, D., Peng, S., Schotten, M. T. de, & Gong, G. (2021). Callosal fiber length scales with brain size according to functional lateralization, evolution, and development (p. 2021.04.01.437788). https://doi.org/10.1101/2021.04.01.437788
[7] Wang, Y., Necus, J., Rodriguez, L. P., Taylor, P. N., & Mota, B. (2019). Human cortical folding across regions within individual brains follows universal scaling law. Communications Biology, 2(1), 1–8. https://doi.org/10.1038/s42003-019-0421-7
本文来自微信公众号:集智俱乐部(ID:swarma_org),作者:熊一蓉

