截至目前,我国已有 3 款灭活新冠疫苗获得附条件批准上市,分别是国药中生北京、国药中生武汉和科兴中维。
2 月 25 日,陈薇院士和康希诺共同研发的腺病毒新冠疫苗正式获得附条件批准上市。与灭活疫苗不同,这款腺病毒疫苗只需单剂接种。
同样是新冠疫苗,为什么有的需要打两针,有的却可以单剂接种?打一针的疫苗和打两针的疫苗,效果会有差别吗?
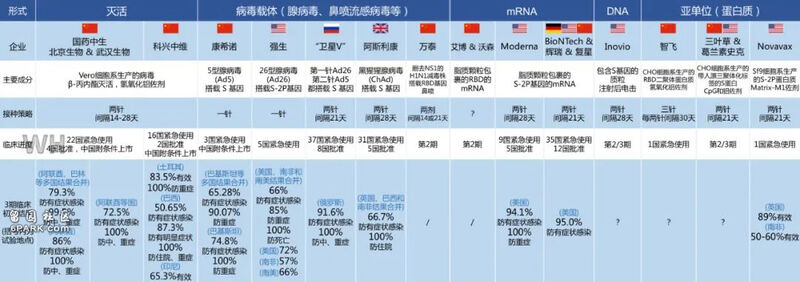
全球部分新冠疫苗研发进度
图源:作者制图
疫苗怎么打最合适?
去年 4 月,国药和科兴同时开始了第 I/II 期临床试验。如果遵循以往的疫苗研发进度,II 期试验需要在 I 期试验的免疫原性数据分析全部结束后才能开始,而这个过程需要至少几个月的时间。
为了加快进度,两家公司都在 I 期临床试验开始之前提交了 I 期和 II 期试验的全部设计方案,这样,II 期试验就可以在 I 期的安全性结果出炉后立刻开始,时间缩短到 7~14 天,为疫苗早日上市争取宝贵的时间。
但是,这同时也给疫苗的方案设计提出了更高的要求。
在疫苗方案设计中,几个最为关键的问题是接种剂量、接种次数和间隔时间。如果选择了不合适的方案,很有可能会让 I/II 期的心血付诸东流,甚至影响到最重要的 III 期临床。
因此,研发团队需要基于以往经验,综合现实条件,在试验开始前「预测」出成功率比较大的方案。
换句话说,疫苗怎么打最合适这个问题,在试验设计之初,是被「试」出来的。
我们拿国药中生北京的灭活新冠疫苗来举个例子。
疫苗保护率与中和抗体的滴度是评价一款疫苗的两个常见指标。疫苗保护率一般只能通过 III 期大规模临床试验得出,而在摸索剂量和流程的 I、II 期,检测每个志愿者体内的中和抗体滴度和 T 细胞反应,是更可控也更高效的指标。
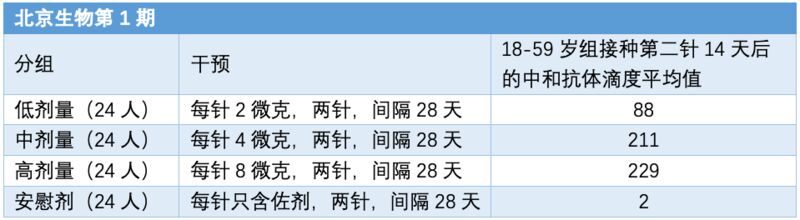
北京生物新冠灭活疫苗的 I 期临床试验中和抗体滴度(图源:作者制图)
从国药中生北京的 I 期数据可以看到,中高剂量组明显好于低剂量组,但高剂量组并没有比中剂量组有更明显的优势,因此,研究团队将中剂量(每针 4 微克)作为了 II 期临床试验的重点,这是三个剂量中有效而经济的最优选择。
国药中生北京的 II 期试验主要探索了接种疫苗的间隔时间问题。

北京生物新冠灭活疫苗的第2期临床试验中和抗体滴度(图源:作者制图)
试验结果显示,一天打两针的「无间隔」组,效果远远不如间隔 2~4 周的其他组,因此,这款灭活疫苗的说明书最终确定接种间隔为 2~4 周。
同时,间隔 21 天组的效果要略好于 14 和 28 天,所以现实中大部分接种点也把 21 天作为推荐的接种时间间隔。
灭活疫苗为什么要打两针?
如果说接种剂量和接种间隔是「试出来」的,那么,三款灭活新冠疫苗之所以不约而同地选择了两剂接种,则是出于经验和现实的分析。
灭活疫苗是一种非常经典的疫苗技术路线。在选取了合适的活病毒后,使用 Vero 细胞系对病毒进行扩增;再利用 β-丙内酯烷基化作用改变病毒核酸结构,使病毒失去复制能力,从而达到灭活的目的;最后浓缩纯化,与铝佐剂等辅料混合,制成疫苗 。
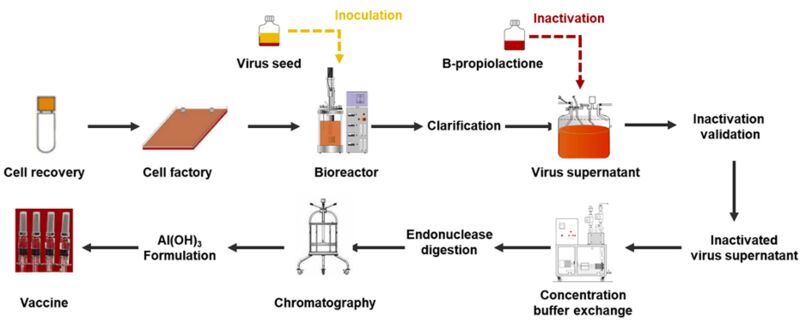
新冠灭活疫苗的生产流程示意图(图源:国药中生北京生物公司)
在整个制作过程中,佐剂起到了关键的作用。
佐剂是一类添加在疫苗中,能够辅助抗原应答、调节免疫反应强度和类型的物质。铝佐剂是迄今为止使用最广泛的人用疫苗佐剂,包括氢氧化铝佐剂,磷酸铝佐剂等,有着近百年的使用历史,在产能、成本和安全性上都有研究印证。
铝佐剂的主要功能之一是吸附和缓释抗原,并可以招募巨噬细胞和树突状细胞等抗原呈递细胞,促进抗原的吸收和呈递。在固有免疫方面,近年来有研究认为铝佐剂能促进巨噬细胞的 NLRP3 炎症小体通路诱导 IL-1β 的分泌,最终促进炎症反应。
而在获得性免疫方面,B 细胞产生高亲和力的浆细胞和记忆 B 细胞需要几天甚至几周的时间,在此期间,抗原的长时间激活可能是必需的。
也就是说,单独一针的铝佐剂疫苗能提供的刺激时间可能不够充足,而现实也印证了这种猜测:目前,没有任何一款铝佐剂灭活疫苗能够实现单针免疫。
而在第二次接种疫苗时,上一次接种诱导出的记忆B细胞会被激活,分化成浆细胞开始分泌抗体;同时,还会有从来没有接触过抗原的幼稚B细胞加入这个队伍,进入淋巴结生发中心开始高频突变,产生新一批浆细胞和记忆B细胞。随着接种次数的增加,抗体反应的质量越来越高。
因此,新冠灭活疫苗也选择了保持接种间隔的两剂接种。
既然两剂比一剂更好,打三针会更有效吗?
武汉生物灭活疫苗的 I 期试验同时也进行了三针的免疫试验。结果显示,三针确实会增强疫苗的效果。
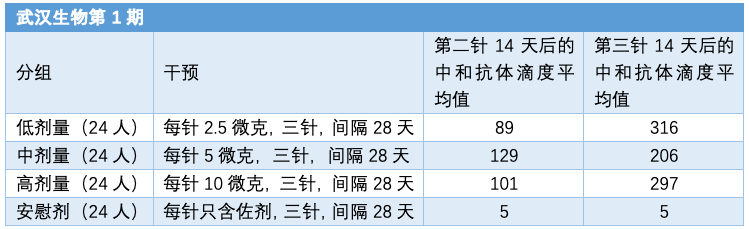
武汉生物新冠灭活疫苗的 I 期临床试验中和抗体滴度(图源:作者制图)
在新冠疫苗产能充足的未来,我们可以通过增加接种次数,获得更优秀的免疫保护,但目前,两针接种显然是现阶段最经济有效的选择。
腺病毒疫苗的挑战:预存免疫
和灭活疫苗相同,腺病毒载体新冠疫苗的设计同样综合了以往经验和现有研究数据。在此次研发新冠疫苗之前,陈薇院士和康希诺公司就曾合作研发过的重组埃博拉病毒疫苗,同样采用了 5 型腺病毒(Ad5)。
5 型腺病毒(Ad5)是一种相对无害的 DNA 病毒,不能整合到宿主的基因组上。在删去基因组的 E1 和 E3 片段使腺病毒失去独立复制能力后,再把一段目的基因插入其基因组,腺病毒就会被改造成一个「载体工具」,把目的基因传递进细胞。
腺病毒可以感染树突状细胞和巨噬细胞,直接帮助抗原呈递。同时,作为一种 DNA 病毒,它本身就是一种很强的佐剂,可以激活这两种细胞的 TLR9 通路,促进 I 型干扰素的分泌,激活 T 细胞(CD4+ T 细胞和CD8+ T 细胞)的反应。
和几乎不能诱导 CD8+ T 细胞免疫的铝佐剂灭活疫苗相比,腺病毒疫苗能更有效地诱导出细胞免疫反应。
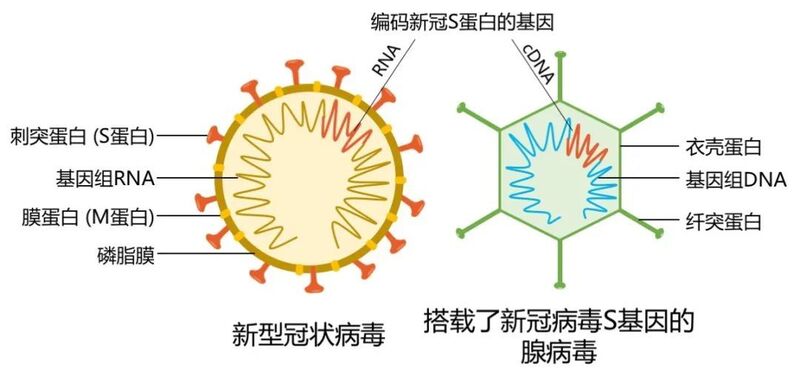
腺病毒载体疫苗图源:作者制图
重组新冠病毒疫苗的 I 临床试验设计全部为单剂接种,并分为三个剂量组。实验最终发现,低中高三个剂量组的志愿者均能产生良好的抗体和 T 细胞应答。
但是,高剂量组 36 人中有 6 人出现了 3 级不良反应,因此,II 期试验就放弃了高剂量的组别,只保留中低剂量两组。
去年 4 月,康希诺新冠疫苗启动 II 期临床试验,数据显示,中低两个剂量组的抗体和 T 细胞反应都显著好于安慰剂组,而且低剂量组的不良反应明显更少。综合考虑,康希诺单针低剂量的方案被确定下来。
但是,腺病毒载体疫苗也面临着另一重挑战:「预存免疫」。
与冠状病毒和流感病毒不同,腺病毒是非包膜病毒,其表面没有磷脂膜的包裹,因此无法将新冠病毒的 S 蛋白展示在自己的表面。也就是说,搭载了新冠病毒 S 基因的腺病毒想要发挥功能,必须先感染人体细胞,把新冠病毒的抗原表达出来,再提交给免疫系统识别才行。
而在这个过程中,作为载体的腺病毒本身也被免疫系统识别和防御。如果疫苗接种者的体内已经有了针对腺病毒的中和抗体,那么,腺病毒的感染能力就会降低,疫苗的效果也会大打折扣。这就是「预存免疫」的原理。
2012 年的一项 Ad5 血清学调查显示,有 46% 的中国人对 Ad5 的中和抗体滴度超过 200。而在康希诺此次的临床试验中国呢,同样有约一半的志愿者对 Ad5 的中和抗体滴度超过 200,存在「预存免疫」的情况。
不过,在新冠 Ad5 疫苗的临床试验里,尽管对 Ad5 载体有预存免疫的志愿者的抗体和 T 细胞反应都明显弱于其它志愿者,但他们的免疫反应仍然明显高于安慰剂组。也就是说,尽管存在「预存免疫」,腺病毒疫苗仍然能对接种者起到显著的保护作用。
哪款疫苗最好?
目前,全球有四款腺病毒疫苗获批上市,除了康希诺外,还有强生的 Ad26.COV2.S、牛津大学/阿斯利康的 AZD1222 和俄罗斯 Gamaleya 研究中心的卫星 V。
其中,强生公司的 26 型腺病毒(Ad26)新冠疫苗同样使用了单针接种的策略。值得一提的是,Ad26 在人群中的血清阳性率远低于康希诺使用的 Ad5,但两款疫苗的保护效力却很接近,似乎说明了,腺病毒载体的预存免疫在某种程度上可以被克服。
而俄罗斯的卫星 V 腺病毒疫苗则采用了异源两针免疫策略,结合了强生和康希诺两款产品的优势,先打一针 Ad26 载体疫苗,再打一针 Ad5 载体疫苗。由于采取了两种不同血清型的病毒载体,同时对两种腺病毒都有中和抗体的可能性比较小,而且不必担心第一针诱导的中和抗体削弱第二针的效果,最大限度地克服了「预存免疫」这个问题。
卫星 V 的 III 期试验的保护率为 91.6%,是这四款腺病毒疫苗里最高的。
而据 ClinicalTrials.gov 消息,牛津/阿斯利康与俄罗斯卫星 V 已注册临床试验,评估两种疫苗混合接种的安全性和免疫原性,以此来规避第一针疫苗带来的 Ad 载体预存抗体对第二针疫苗效果的影响。
图源:ClinicalTrials.gov
哪款疫苗最好?打一针还是打两针好?事实上,这些问题很难得到确切的答案,我们在疫苗接种上也没有太多选择的空间。
接种策略的制定需要综合考虑诸多因素,包括疫苗产能、抗疫压力、毒株、保护率等等。根据目前中国的形势,采用现有的接种策略是比较合适的。
我们整理了获批上市的 4 款国产新冠疫苗接种方案,希望对你有帮助。
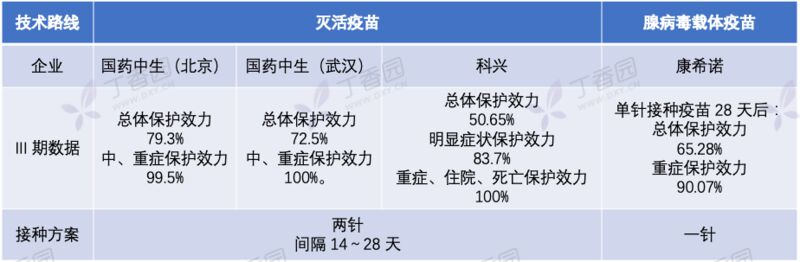 国产疫苗 III 期数据和接种方案
国产疫苗 III 期数据和接种方案致谢:本文由 中科院上海巴斯德研究所免疫学博士 @最后一次吃糖 专业审核

