年底,全球首款CRISPR基因编辑药物先后在英国与美国获批,预示着药物研发“可编辑”的时代,已经正式到来。第二场革命也早已酝酿。它重塑着人们认识疾病与认识药物的方式。它治疗疾病的根本原因,而不是治疗它引起的症状。
它也是技术、资本与监管合力创新的典范。全球首款基因编辑药物的出现,比任何人预期的都要快。从技术在实验室里发现,到应用获批上市,仅11年时间。
它的获批开启了下一个十年。今天,它只是治愈了镰状细胞病与地中海贫血,接下来可能是囊性纤维化、杜氏肌营养不良症等很多人没听过的罕见病,还可能是患者众多的癌症或阿尔茨海默症,甚至还可能是可以安全移植到人体内的动物器官。
只要它能在基因组的某个位置编辑,那么就有理由相信它的成功可以复制。何况测序硬件、基因组数据、人工智能算法的创新,仍在迅速扩展基因编辑的工具库。
描述CRISPR编辑应用潜力的论文,可以追溯到2012年。它原本是来自古细菌的不断重复的基因片段,发现之初,人们不知道它到底起到什么作用。科学家Emmanuelle Charpentier和Jennifer A. Doudna发现,它可以由一段“引导RNA”与Cas蛋白连接,精确定位并剪切任何物种的任何基因。它比以往的任何一种基因编辑工具更简便。2020年,科学家Charpentier和Doudna因此获得了诺贝尔奖。张锋证明了它在实验室中的惊人能力,但无缘诺奖。
它们价值巨大,应该走出实验室。三位科学家各自迅速成立公司,改进技术,寻找应用场景。资本也积极响应。十年来,张锋旗下公司至少达到了7家,Doudna达到了4家,尝试用它来满足药物递送、临床诊断、治疗的需求,甚至农作物改良。
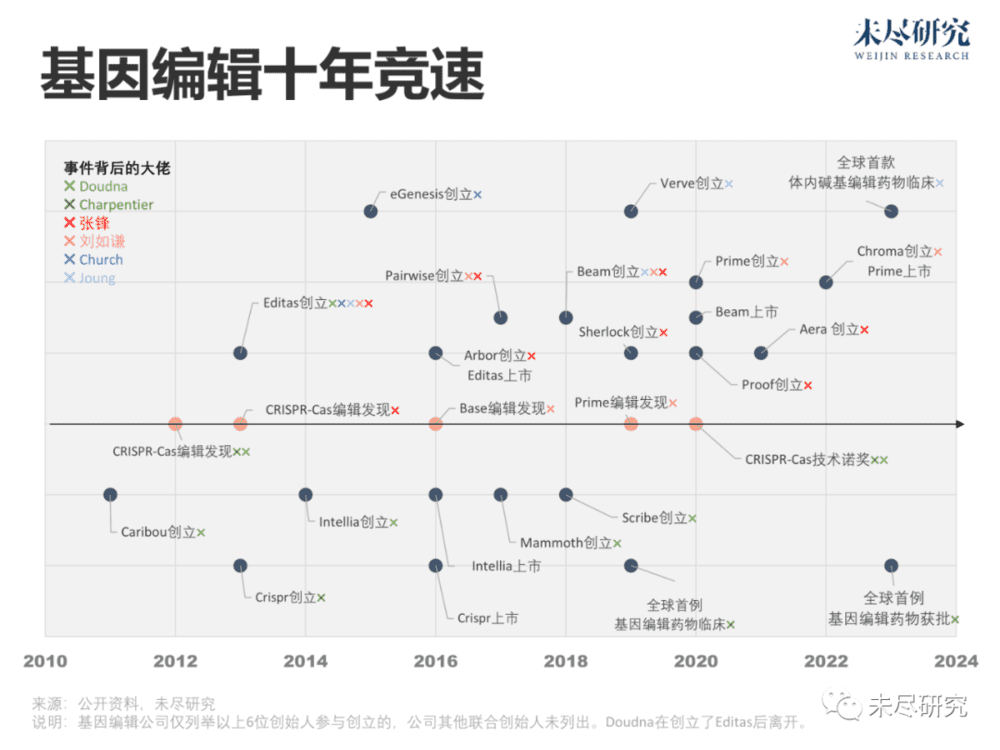
2013年成立的Editas Medicine,汇聚了最多的大佬,除了Doudna与张锋,还有基因编辑学界的刘如谦(David R. Liu)、J. Keith Joung和George Church。次年,Doudna出走,创办了Intellia Therapeutics。Charpentier则同期创办了CRISPR Therapeutics。2016年,三家成立三年左右的公司,先后在同一年上市。
CRISPR Therapeutics赢得了竞速的第一程。它背后的合作方是《十亿美元分子》的主角福泰制药(Vertex),成立于上世纪八十年代末,提出要“理性设计药物”,当时,“撞大运”式的药物研发模式难以为继,医药行业陷入资本寒冬。基因编辑是“理性设计”的典范,福泰制药早早布局。
监管也开了绿灯。CRISPR-Cas技术发现才过去10年,药物临床研究也仅4年。人们缺少对它的长期风险的认识。“脱靶”风险一直是人们最大的担忧,也就是切错位置,可能引入其他突变,导致癌症或其他疾病。最终,在权衡风险与收益后,FDA表示谨慎乐观,但至少临床随访15年。
与CRISPR新药同时获批的,还有蓝鸟生物(Bluebird Bio)基于慢病毒载体的基因疗法,它也针对同一患者群体,但接到了FDA提示癌症风险的黑框警告,获批当日,股价暴跌40%。
医药市场的逻辑,已经彻底改变。单次给药,终生治愈,意味着一旦获批,就会完全占领市场,除非后来者效果更好,或者风险更低。今年早些时候,除CRISPR Therapeutics外,还有类似瞄准同一患者群体的8个临床项目进行中,很快,三个竞争对手的项目关闭了。
第一款获批的基因编辑药物,迈出了重要但不完美的第一步。标准的CRISPR-Cas9方法,实质上是对靶向基因的破坏,相当于将“编辑”功能限定在“删除”上。正如只有很少的情况下,才能通过划掉某几个单词,来纠正整个文本的错误,治疗大多数遗传性疾病,仍然需要更广泛的“编辑”功能,增加或替换某些单词。
2016年,刘如谦发明了基于CRISPR的碱基编辑(Base Editor),能将四种DNA字母(每个字母代表一种碱基)中的一个,直接转换为另一个,无需任何切割。两年后,他成立了Beam Therapeutics公司。2019年,还是刘如谦,发明了基于CRISPR的先导编辑(Prime Editor),实现了多个字母的精准插入与删除。次年,他成立了Prime Medicine公司。
另一种缺陷是药物的可及性。这款新药非常昂贵,高达220万美元。它需要从患者体内获取细胞,然后在患者体外,用CRISPR工具编辑纠正它,再注入患者体内。为了给新细胞腾出位置,患者往往还需要先进行化疗,破坏骨髓。整个流程环节复杂,难度巨大。
降低成本的一种思路,是在更“通用”的细胞上,进行基因编辑,以便它们可以用于治疗许多不同的患者。但任何基于细胞的疗法,仍然很昂贵,因为在确保其纯度和安全性的同时,在体外生长和维持细胞仍耗费巨大。
更直接的思路是在患者体内编辑基因。体外编辑通常用于编辑造血干细胞和祖细胞,以及白细胞,体内编辑可以大幅度扩展基因编辑的细胞类型。难度在于CRISPR药物必须被递送到这些目标细胞。人们已经在开发mRNA疫苗的时候,成功尝试过LNP递送技术了,它在这里也有用武之地。科学家还在不断尝试新的递送工具。
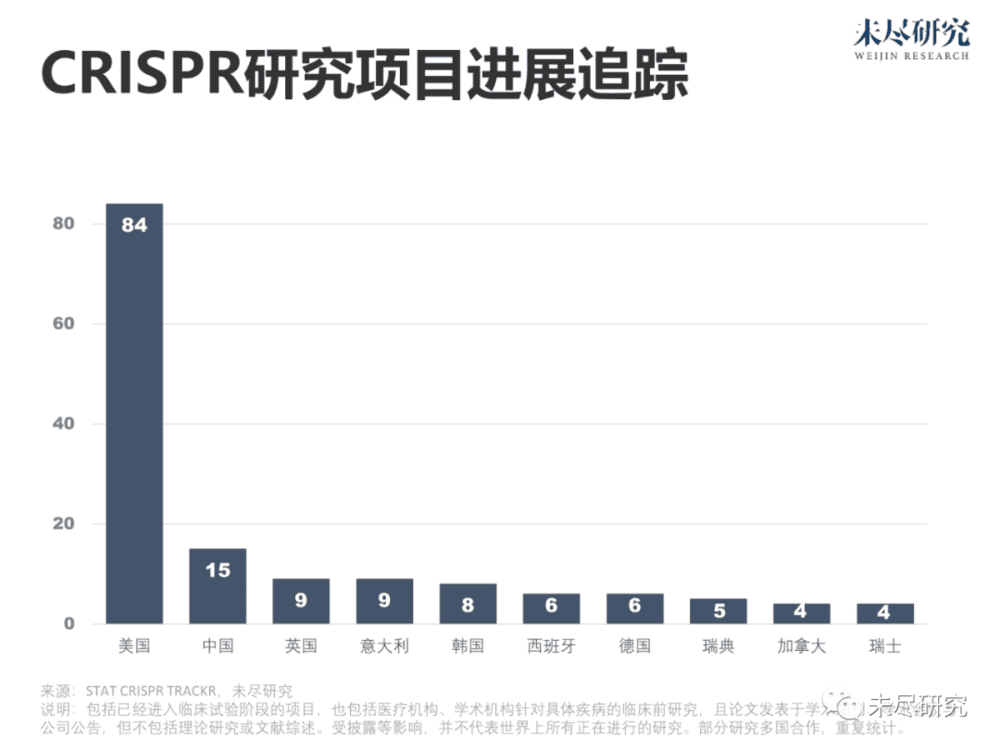
统计研究期刊、预印本和公司公告,目前,全球近百项涉及CRISPR疾病治疗应用的重要研究正在进行或已经结束。美国占了绝大多数,中国居于第二。据药明康德统计,全球十余款由企业推动的基因编辑,也进入了临床试验阶段。中国的博雅辑因、邦耀生物、瑞风生物,同样瞄准地中海贫血。在中国,约30万人罹患该病,且病程严重,主要位于两广地区。本导基因与中因科技主要聚焦于眼部疾病。
大多数基因编辑临床试验,都聚焦于罕见病或遗传病,它们多由基因问题导致。但这样的患者往往分散、有限。收入捉襟见肘的企业,有时候不得不因外界风吹草动调整研发节奏。Church将目光投向了遥远的地平线,认为CRISPR的真正用途,包括基因编辑动物,以便它们的器官可以安全地移植到人类身上。2024年,异种移植的尝试还会继续。
在今年年初,诺奖得主Doudna畅想,在十年后,CRISPR编辑会适用于所有人,会先在农业世界中体验它。她设想的稍近的未来,“FDA批准治疗镰状细胞病”,已经在今年年底实现。
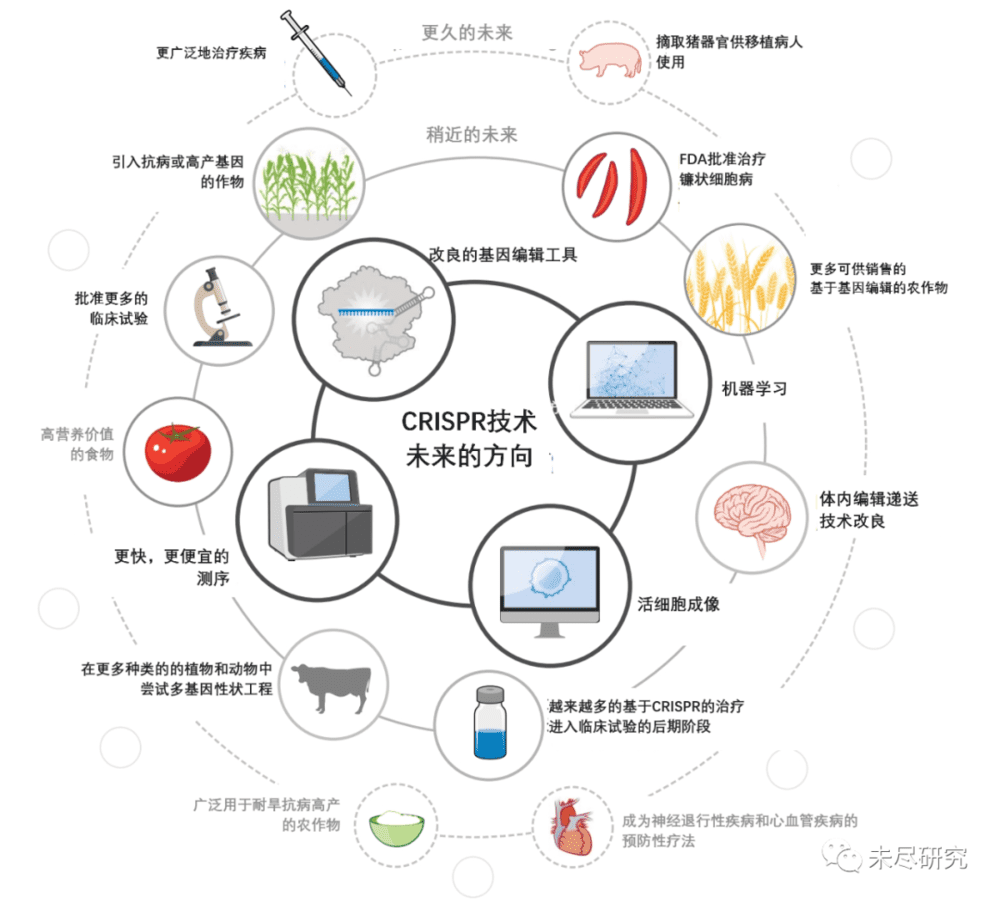
AI+CRISPR:下一个十年
来源:Science. 2023 Jan 20
CRISPR编辑正在进入2.0时代。这将主要由前述碱基编辑、先导编辑与表观基因组编辑(Epigenome Editing)引领。机器学习也在发力,张锋研究了新算法,搜索海量基因组数据,一下子发现了188种新型CRISPR系统,丰富了工具库。 此前,研究人员确定了6种CRISPR系统,CRISPR-Cas9是最常用的一种。
《自然》杂志选出了2024年最值得关注的临床试验。其中,Verve Therapeutics的一款基因编辑药物,将对未来产生重要影响。这是首例进入临床的体内的碱基编辑药物,旨在治愈一种称为家族性高胆固醇血症的遗传性疾病。Verve希望它能取代日常服用降胆固醇药物。手握爆款降糖减肥药物的礼来,是这款“终极”降脂药物的合作方。Prime Medicine也计划在明年寻求针对慢性肉芽肿病这一致死性遗传疾病的临床试验。表观基因编辑的Tune Therapeutics,刚展示了乐观的临床前实验数据。
2024年将是CRISPR编辑2.0时代的开端,大佬们的竞速将鼓舞更多创新者涌入,无论它们成功,还是短暂失利,都在推动行业“编辑”出更精准、更安全、更便宜的药物。
参考资料:
CRISPR technology: A decade of genome editing is only the beginning
CRISPR 2.0: a new wave of gene editors heads for clinical trial
本文来自微信公众号:未尽研究 (ID:Weijin_Research),作者:未尽研究

