当你凝视深渊时, 深渊也在凝视你。
基因是一段带有遗传信息的DNA片段,储存着生命的种族、血型、孕育、生长、凋亡等过程的全部信息,支撑着生命的基本构造和性能。
从发现基因的那一天起,人类就一直想要征服它,因为掌握了基因编辑能力,也就掌握了生命的无限可能,例如可以治愈很多药物无法治疗的基因疾病。自基因编辑技术诞生以来,围绕着其安全性、伦理等方面的争议就从未断过。
就在上个月,基因编辑在商业化领域的天平终于被打破,Vertex和CRISPR联合宣布CRISPR/Cas9基因编辑疗法(商品名:Casgevy)在英国获批上市,用于输血依赖性β-地中海贫血患者。
而在上周五,FDA(美国食品药品监督管理局)公告Casgevy上市。同一天,适应症与Casgevy具有重合性的,由bluebird bio开发的基因编辑疗法Lyfgenia,同样获批。
当基因编辑疗法开始逐渐获得最大的创新药市场审批许可,这意味着,2023年岁末,人类已在真正意义上打开了“基因编辑”的潘多拉魔盒。
天使的手术刀
基因编辑技术是一种定向改造DNA基因序列的技术。通过这项技术,人类理论上可以彻底掌握自身的命运。
这项技术的起点源于1953年,沃森与克里克提出了DNA双螺旋结构,由此拉开了现代分子生物学的序幕,第一次将人类认知引入到基因层级。
虽然人类发现DNA结构很早,但却在很长一段时间中对基因概念并无太多新的进展,直至20世纪70年代,人类才找到了基因编辑的可能性。在研究细菌如何防御噬菌体的过程中,科学家发现细菌中存在一种特殊的酶,它能够降解噬菌体的DNA,从而保护细菌免受噬菌体的侵害,这种酶就是限制性内切酶。
基于这一发现,人类开始尝试基因编辑的可能。
1996年,美国基因公司Sangamo Therapeutics推出了第一代基因编辑技术ZFNs,该技术可以修饰体细胞和多功能干细胞的基因组,但需要设计合成复杂的蛋白模块,构建周期长,步骤繁琐,并且无法实现对任意靶基因的结合。显而易见,如此繁琐的步骤是难以进一步商业变现的。
ZFNs出现的13年后,第二代基因编辑技术TALENs问世。与ZFNs相比,虽然蛋白设计进行了简化,但仍需要耗费大量的时间设计和组装。同时,因为过大的体积,在递送到靶细胞方面更为困难,也无法进行高通量基因编辑。
复杂的机制让基因编辑的进一步应用受到极大限制,这也为后续迭代路径指明了方向,那就是简便与高效。
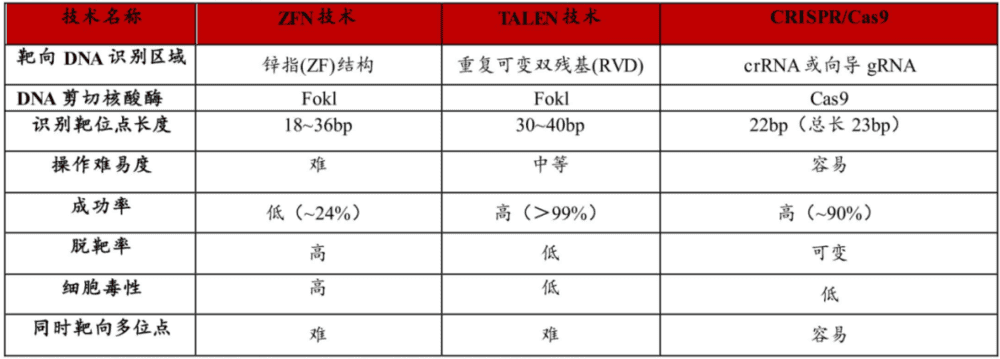
图:三代基因编辑技术对比,来源:华西证券
2012年,两位年轻的女科学家埃曼纽尔·卡彭蒂耶与詹妮弗·杜德纳开发了第三代基因编辑技术CRISPR/Cas。与前两代技术相比,CRISPR/Cas最大的变化在于效率的提升,系统简单、精准、编辑效率高,操作成本低,极大降低了技术门槛,并让基因编辑有望实现临床应用的可能。
基于CRISPR/Cas技术的平台价值,卡彭蒂耶与杜德纳在2020年被授予诺贝尔化学奖,而卡彭蒂耶更是在后来创立了CRISPR Therapeutics公司,并朝着临床应用场景进一步迈进。不久前上市的基因疗法Casgevy,正是CRISPR公司的核心产品,而其也成为全世界首款获批上市的CRISPR基因编辑疗法。
Casgevy疗法类似于CAR-T疗法,都需要先从患者体内收集细胞,然后送到实验室进行改造,再回输到患者体内,实现疾病的彻底扭转。Casgevy修饰的是患者的造血干细胞,让细胞能产生高水平的胎儿血红蛋白。
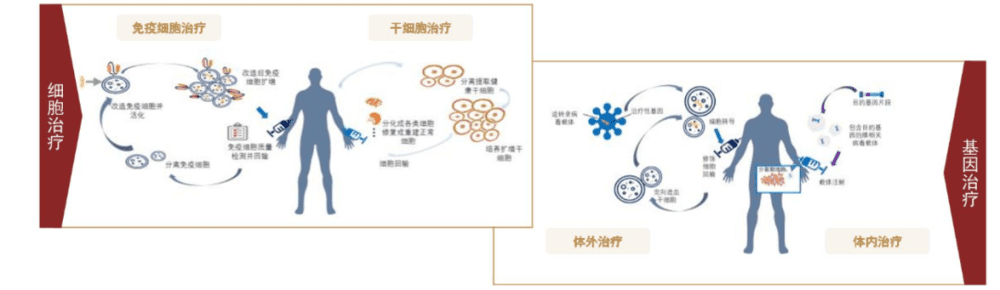
图:CAR-T疗法与基因疗法,来源:中金公司
毫无疑问,Casgevy仅是人类征服基因的开始,理论上通过基因编辑可以治愈所有类型的疾病,尤其是很多先天缺陷的基因疾病,让人们看到了治愈的希望。更有甚者,还曾提出通过编辑衰老基因,让人类返老还童。
掌握了基因编辑技术的人类,就好像握住了“天使的手术刀”,拥有了逆天改命的能力。
魔鬼的诱惑
突破自然的束缚,对于人类来说也未必就是一件好事,依然有太多未知需要探索。
基因编辑具有不可逆性,编辑后的细胞在正常分裂后,被编辑的基因也会被继承。也就是说,人类对于基因的改变会一直在后世中流传,如果编辑进了错误或当前看不出错误的基因,那么就会造成基因污染。
所以说,基因编辑不仅仅是一个学术问题,更是一个社会伦理问题。
在2018年的时候,我国曾发生了一起“基因编辑婴儿”事件。南方科技大学副教授贺建奎对外宣布,通过基因编辑手段,成功改造了一对新生儿,她们在出生时就拥有天生抵抗HIV病毒的能力。可是这并没有引起业界的轰动,反而遭到了国内外逾百名科学家联名发声反对。最终贺建奎以“非法行医罪”被判处有期徒刑3年,并处罚金300万元。
产业技术是为人类服务的。如果安全和伦理两大问题无法解决,那么基因编辑的应用势必受限。
抛开这两个问题不谈,现阶段想要全面推进基因疗法药物的商业化也有很多现实议题需要直面。比如在应用层面,如脱靶效应、转录效率、运输问题、适用性、长期安全性等问题亟待解决。此外,基因编辑治疗的成本也限制了它的推广,Casgevy的治疗费用可能高达200万美元。
总的来看,Casgevy的上市只是基因编辑疗法迈出的商业化第一步。毕竟CRISPR/Cas技术问世只有11年,未来还有很长的路要走。面对新的问题需要敢于直面,去攻克一个又一个难题,才是人类不断进步的动力。
又一场军备竞赛开场
基因编辑技术应用前景广阔,市场潜力巨大,吸引了不少优质的国内外生物科技企业投入研究。即使在2022年的创新药寒冬中,基因治疗领域依然有至少7家公司逆势获得超亿元的大额融资,Tessera Therapeutics更是完成了超3亿美元的超级C轮。
面对一级市场如此火热的投资热度,世界各国都在不断完善科技伦理审查制度,防止基因编辑技术被滥用。例如我国2022年发布的《关于加强科技伦理治理的意见》,就是国内首个对于基因编辑提出道德伦理规范的国家层面的文件。
可以肯定的是:基因编辑技术的开发及应用将使生物科学发展进入到一个全新的维度,该技术在基因功能研究、药物开发、基因治疗,包括癌症、阿尔茨海默氏症、心血管疾病等领域具有广阔应用前景。
但想要让这样的愿景实现,关键还是在于人类如何使用这种工具,限制这种工具,而不被它所驱使。
截至目前,我国已经有50余家公司涉足基因编辑技术,这其中以初创公司为主,管线研发也多在临床早期,但这些公司暂时都没有登陆资本市场。
由于我国基因编辑公司起步较晚,CRISPR技术的底层知识产权已被西方国家垄断,在技术研发方面依然会面临“卡脖子”的问题。轻则是支付高昂的技术授权费,重则又会被技术封锁。
鉴于基因编辑技术的强大功能,它极有可能成为下一种战略技术。因此不管我们愿不愿意,客观上,创新药赛道又一场重量级军备竞赛,开场了。
本文来自微信公众号:医曜(ID:yiyao-jinduan006),作者:青栎

