8岁的小明,他对与其他孩子一起玩毫无兴趣,要玩也是一个人独自玩耍。不过,也有让他整日痴迷的特定主题,如对恐龙或火车玩具常常表现出极高的兴趣,经常冒出让爸妈都大吃一惊的小知识。小明平常话很少,和人交往时主动交流少到几乎没有,小明有明显的语言和沟通困难,家里人也经常会听到小明重复地说相同的话或反反复复做一样的小动作。
15岁的小莉,她不擅于表达也不能融入人多的场合,却对数学、计算机表现出浓厚的兴趣。尽管她在某些方面非常聪明,但她也经常表现出焦虑不安,人多的场合更是如此。
3岁的阿本,几乎不会说话,语言表达能力明显不足。他对周遭的人和事物都毫无兴趣,更喜欢一个人独自玩耍,埋头整理玩具。他和小明、小莉都是一旦进入陌生的环境就局促不安,也对环境噪声等格外敏感,常常会莫名其妙地发脾气甚至情绪失控。
这样一群孩子,他们对身边的其他事物漠不关心,不爱与其他人交流,却能长时间专注于自己喜爱的哪怕是外人看来极其平常枯燥的事物,沉浸其中的时间远超一般孩子。非常突出的一点:男生占这群孩子的大多数(70%~80%)。他们仿佛只活在自己的世界中,就像天上一闪一闪的星星,和他们周围的世界格格不入,因此被称作“来自星星的孩子”,这些孩子就是我们身边的自闭症儿童。
什么是自闭症呢?
自闭症谱系障碍(ASD),简称自闭症或孤独症,是一类常见的早期神经发育性障碍。患病儿童都表现出共同的临床行为即所谓“自闭症核心症状”:对简单刻板行为的显著偏好性,而几乎无一例外都缺乏社交兴趣;尽管很多这类孩子生下来的前6个月就表现出与一般正常儿童的不同,但是公认能够给出明确诊断的是两岁或两岁以后。
人群中自闭症发病具有高度的家族遗传性,比如说同卵双生的孩子中的一个有自闭症,另一个几乎肯定会有自闭症症状。然而,超过50%患儿的基因组中并没有发现明显的致病基因变异。
患者个体间除上述核心症状外,具有差异性,因患病严重程度不同称为谱系障碍。自闭症患者会伴有情感异常、多动症、焦虑症、抑郁症以及智力障碍等共患病症的出现。一些患者可能智力较低同时伴随有语言障碍,而另一些患者可能智力和语言能力明显高于平均水平。因此有专家建议从神经系统多样性的角度来定义和探讨这类人群的临床表现。
到目前为止,还没有公认的有效的生物学诊断指标用于诊断儿童自闭症,临床医生主要通过患者的行为进行量表评估和诊断。
根据最近的美国国家健康访谈调查(NHIS)的统计,美国自闭症的患病人数从2016年的2.29%增加至2020年的3.49%,呈现逐年增加的趋势。
全球疾病负担研究(GBD)统计则显示,全球5岁以下患自闭症的儿童人数超过60.375万人。2022年发布的《中国孤独症教育康复行业发展状况报告IV》显示,中国新生儿自闭症发病率约为1%,然而考虑到研究中统计的地域因素和传统的病耻文化等,业内专家普遍认为中国新生儿的自闭症谱系障碍实际发病率可能为1.0%~1.2%,患病总人数超过1000万,其中12岁以下的儿童约有200多万人。
不同地域、不同国家的自闭症患病率几乎没有显著差异,文化、政治、经济等因素对自闭症的发病率并没有显著的影响。不过自闭症患儿的性别分布却表现出明显的偏好:男性自闭症的发病率要明显高于女性,最高可达5:1。
研究表明家庭社会经济状况、父母的职业及产子年龄都可能会影响新生儿的自闭症发病率。
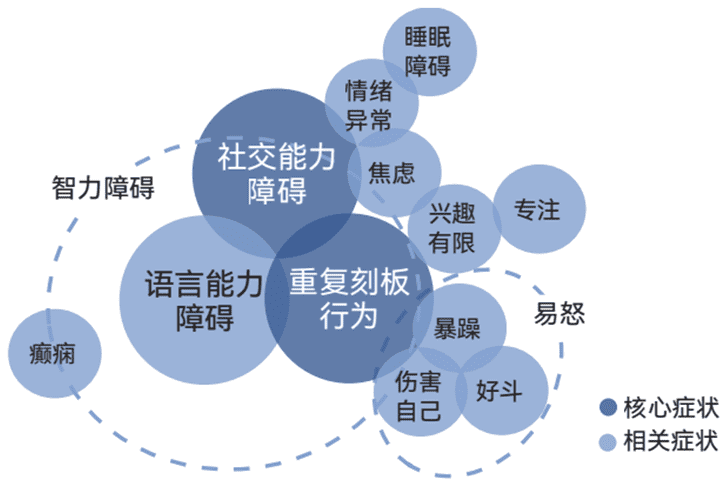
自闭症儿童的核心症状及其多样的临床表现
一、人类对自闭症的认知和研究
时至今日,自闭症这个词汇进入人类的视野已经有两百多年。跨越数个世纪的历程中,人类对自闭症及其谱系特征的认识等发生了数次跨越式的变化(如图所示)。

人类自闭症研究历程中的若干重大时间节点
早在1799年,人们在法国的森林里发现了这样一个孩子,他不会说话,有智力缺陷,不习惯于人类社会的生活,对其他人漠不关心,行为更像一只野兽,他的身世不详。他的父母可能在他两岁的时候就将他遗弃在森林,人们称他为“阿韦龙野孩”。法国医生伊塔德(Jean Marc Gaspard Itard)对他产生了浓厚的兴趣,希望能够通过再教育,让他成为一个正常的男孩。当时的人并不知道,“阿韦龙野孩”的种种表现正是我们今天自闭症的症状。
1911年,瑞士的精神病学家布洛伊勒(PaulEugenBleuler)根据临床经验,最早提出“自闭症”的概念,并用它来描述精神分裂症病例的症状。
对自闭症的科学认识开始于1943年,这一年,美国医生坎纳(Leo kanner)发表论文《情感接触与自闭障碍》对自闭症进行了十分全面的介绍,并将其命名为“早期婴幼儿自闭症”。
1944年,奥地利医生阿斯伯格(Hans Asperger)发现了人群中的高功能自闭症并将其命名为阿斯伯格综合症。坎纳与阿斯伯格医生也由此成为人类自闭症研究当之无愧的先驱。
之后,人们对自闭症的认识从发现、定义阶段进入到诊断治疗阶段。1960~1980年间,伯纳德·伦姆兰(Bernard Rimland)等人提出了自闭症诊断的标准,并尝试对自闭症进行干预和治疗。
1980年,在拉特(Michael Rutter)推动下,《神经障碍诊断统计手册》首次将婴儿自闭症纳入广泛性神经发育障碍这一大类疾病的范畴,关注其早期发展。
再往后,学界开始研究自闭症机制,从分子水平认知这一疾病。拉特等人发现,自闭症在双胞胎中具有高度遗传性,受到基因调控。
国内对自闭症的研究始于1980年代,陶国泰教授发表了目前可查的中国第一篇自闭症相关研究论文(文章称之为孤独症)。这标志着我国科学家和临床研究人员开启了攻关自闭症的漫漫征途;陶国泰教授也被誉为“中国儿童精神研究之父”。
随着中国经济发展和科技投入增长,投身于自闭症研究的科研、临床及社会人员数量逐年增加,中国自闭症患者受到越来越多的关注和支持,相关研究取得显著进展。
二、自闭症的治疗方法
自闭症治疗主要分两大类:非药物治疗与药物治疗。
非药物治疗主要是通过对自闭症儿童进行特殊教育达到教育矫正的目的,通常在早期对儿童提供治疗。
其中包括音乐疗法、认知行为疗法以及社会行为疗法等,旨在帮他们提升自理能力与社交能力,其中音乐疗法取得了较好效果。这种疗法期望在早期发育阶段通过艺术教育改变大脑皮层之间的结构与连接,从而达到治疗的目的。
音乐疗法可以提供一种非常有益的方式来与世界互动,因为音乐可以超越言语和社交障碍,帮助他们表达情感并进行沟通。
认知行为疗法则更加侧重于心理干预,改善焦虑、抑郁等症状。社会行为疗法更多地关注情绪调节,强调自闭症患者的自我独立。综上,非药物治疗有一定的改善自闭症症状的潜力,但其有效性又表现出很大个体差异。
药物治疗主要是通过药物直接治疗或改善自闭症。由于自闭症机制尚不清楚,也缺少有效药物靶点,目前自闭症药物研发和应用都阻碍重重。目前用于患者的主流药物针对自闭症相关症状,如情绪、睡眠、肠道问题等。
常用药物如利培酮,是一种常见的非典型性抗精神类药物,已获得美国食品药品管理局(FDA)批准,能有效缓解自闭症患者的易怒等症状。需要注意的是,利培酮具有一定副作用,需在医生指导下使用,并定期进行评估和监测,以确保最佳疗效和最小副作用。
滴鼻给药的催产素因其在动物实验中的显著有效性曾一度被业界热切期待,然而临床试验的突然中止说明,我们离发展真正普遍有效的自闭症药物还有很遥远的距离。
三、自闭症发生发展的机制:遗传or环境?
自闭症的发病分子机制目前尚不清楚,自闭症儿童典型的核心症状提示我们,这一群体可能有些共同核心神经回路或信号通路发生异常,但至于哪些神经回路或信号通路异常了,科学家并不了解。
长期以来,自闭症病人呈现的高度遗传性一直驱动科学家探究遗传因素。对双胞胎家庭的研究表明,自闭症的遗传率高达40%~90%。
借助全基因组测序等现代生物学研究方法,研究人员发现了超过600个自闭症风险基因,其中FMR1等基因的单核苷酸多态导致至少5%的自闭症,另有接近10%的自闭症由染色体拷贝数变异引起。染色体拷贝数的变异会造成相关基因表达量变化,其中常见的疾病有15q11-q13拷贝数增加(导致后文提到的UBE3A基因表达上调)等。
后续实验证明了这些变异在自闭症类似行为发生发展中的重要作用。
已知的自闭症相关基因变异关系到的生物过程主要有细胞转录与翻译、突触形成、表观遗传学、免疫与炎症等。研究发现,TSC1/2、FMR1等自闭症相关的风险基因能够通过Wnt信号通路等途径影响细胞转录,通过mTOR信号通路、MAPK信号通路等途径影响细胞翻译。
FMR1基因是最为人熟知的自闭症单基因成因,其编码的FMRP蛋白是一种在脑部富集的RNA结合蛋白,FMRP能调节超过1000种基因的表达,也能靶向LGN3、TSC2等多种自闭症风险基因,调节其mRNA的稳态进而对神经突触的可塑性产生影响。这也增强了人们发现自闭症相关的核心基因或通路的信心和希望。
突触相关蛋白基因变异会导致神经突触的功能异常,特定脑区的结构和功能异常都被认为与自闭症的发生发展有紧密的联系。例如,NLGNs、NRXNs能形成贯穿前后突触的复合物,复合物功能异常会影响到突触的稳定、可塑性以及神经递质释放。SHANK3基因敲除后,NMDAR依赖性的兴奋性神经元功能缺陷以及突触的可塑性会受到影响。
神经系统免疫与炎症反应是自闭症形成的重要因素。早期研究发现自闭症患者相比正常人有超过150个差异表达基因,其中超过85%的上调的通路涉及免疫反应通路。在临床表现上,自闭症患者还会出现胃肠道炎症反应,肠道中梭菌属、脱硫弧菌属等微生物的丰度均出现显著变化。目前已经建立的自闭症小鼠模型,也表现出肠道微生物群紊乱。
值得一提的是,人们发现超过50%被诊断为自闭症的患者,其基因组中并无明显的致病变异,这就提示了非遗传的因素,又称环境因素在自闭症发生发展中可能发挥特别重要的作用。
很显然对患病儿童来说,这些环境因素起作用的主要时间窗口就是他们在母体中的胎儿阶段和产后新生儿时期。那么问题是,到底是哪些因素可能导致儿童精神发育的异常呢?
四、我们团队的自闭症研究发现
笔者的团队长期研究蛋白质稳态调控与自闭症等人类重大疾病的机制。我们长期关注的UBE3A蛋白,从生物化学活性来说是一类E3泛素连接酶,它调控细胞内多种蛋白质的功能和稳定性,同时也是一个自闭症重要风险基因。UBE3A基因缺失是天使综合征的重要原因,而它所在的15号染色体长臂15q11区域的拷贝数扩增又与自闭症密切相关。
2017年我们首次报道UBE3A可以直接介导视黄醛脱氢酶家族蛋白的泛素化修饰,并抑制后者活性。
我们知道,维生素A是人类生存不可或缺却又无法自身合成的重要维生素之一。维生素A首先被氧化成视黄醛直接参与视觉感光过程,之后要再转化成视黄酸(RA)——视黄酸才是维生素A行使生物功能的最主要形式和产物。而视黄醛脱氢酶催化视黄醛向视黄酸转变的唯一酶类。
已知视黄酸与血液、骨骼、生殖系统的发育和成熟密切相关,在神经系统中则直接参与调控神经元前体的分化和脑组织(特别是皮层)发育。近期斯坦福大学的陈路教授课题组还发现视黄酸在维持和调控神经突触可塑性中发挥不可替代的作用。
因此,当发生与自闭症相关的UBE3A基因表达上调后,视黄醛脱氢酶的酶活性会大幅度下降,体内视黄酸的合成也被明显抑制。
模拟自闭症中UBE3A过表达的小鼠脑组织中视黄酸水平也确实被明显下调了。而口服补充视黄酸可以缓解小鼠自闭症行为的发现,进一步说明视黄酸下调可能是自闭症发生发展机制之一。
这项研究的核心发现发表后很快被多家实验室证实。补充全反式维甲酸(医用视黄酸的主要形式)的临床试验目前正在进行中。
值得一提的是,2021年,我们发现多种模拟人类自闭症的致病基因变异都会影响视黄酸代谢和信号通路,相关小鼠模型研究也证实了这一点。模拟人类脆性X综合症的FMR1基因敲除(FMR1-/-)的小鼠像人一样表现出类似自闭症的行为。我们发现口服全反式维甲酸,能够显著增强FMR1-/-小鼠的社交新奇性,服药小鼠至少部分恢复了对陌生小鼠的兴趣。
进一步分析表明,用药组小鼠体内的糖代谢,谷胱甘肽代谢等被显著影响,与记忆、认知相关的通路也有所上调。视黄酸可能在一定程度上恢复了因FMR1基因敲除而改变的生物过程。
接下来我们进行了广泛的针对视黄酸代谢和信号通路的化学筛选。初步的研究结果表明:很多日常用品中的化学物质以及药物的主要成分都会在细胞和动物水平影响视黄酸代谢和信号通路。个体通过母婴途径或新生儿阶段接触到这些化合物超过安全剂量,就有可能因为神经系统中的视黄酸代谢稳态和通路受影响而导致某些自闭症行为。
以三氯生(TCS)为例,TCS是一种广泛用于医疗保健、化妆品、个人洗护用品的杀菌剂,我们日常使用的洗手液、肥皂、牙膏等均含大量TCS。TCS结构相对稳定,能长期存在于自然环境、生物链中。TCS能够通过口腔或直接穿透皮肤进入人体,在血液、母乳、尿液中残留。我们和李廷玉教授团队合作研究发现基因组完全正常的大鼠如果怀孕期间暴露在TCS中,其子代大鼠会表现出典型的类似自闭症核心症状的行为。
国内的多中心流行病学研究发现,自闭症儿童的血液中TCS含量比正常孩子显著增加。这些数据表明,个体发育早期接触到大量TCS也可能增加新生儿自闭症风险。
十多年前美国的超大队列研究也发现,收入越高的人群,其家庭成员体内TCS残留的浓度越高,这也似乎与社会经济地位越高的家庭儿童自闭症发病率偏高的现象相符。
因此,可以根据自闭症相关的基因变异是否影响视黄酸代谢稳态或信号通路,对遗传因素相关的自闭症病人进行分型。针对其中视黄酸代谢稳态或信号通路确实被影响的自闭症亚型的病人,或许可以进行以视黄酸或类似物为基础的靶向药物干预,至少部分改善自闭症症状。
这些数据(如下图所示)也提示我们对未来食品、药品等的安全评估中需要关注其主要成分是否通过影响视黄酸代谢稳态或通路等对子代精神健康产生影响;而且,鉴定和明确自闭症风险因素,就可能从源头遏制新生儿自闭症发病率逐年增长的趋势。
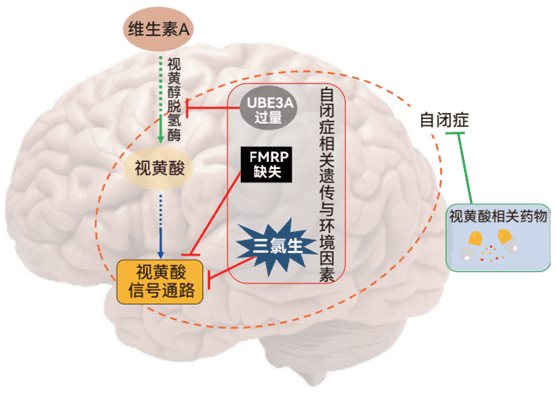
视黄酸代谢稳态与信号通路相关的自闭症发生发展机制以及靶向干预策略
五、结论与展望
过去两个多世纪,人类对包括自闭症在内的精神类疾病从认识、诊断到机制研究甚至药物治疗都取得了相当程度的进展,但距离真正全面理解它们的发生发展机制还非常遥远。
与此同时,我们既要面对一个存量巨大的自闭症群体对家庭、社会带来的严重负担和挑战,又不得不面对全球范围内新生儿自闭症发病率逐年增长的威胁。
我们对视黄酸代谢和信号通路生理作用的认识,特别是其在神经系统方面的作用才刚刚起步,对基于视黄酸及其类似物在治疗特定亚型自闭症的药物潜力的研究和开发也刚刚开始,离真正实现临床应用还任重道远。
希望未来能通过在全社会进行基因筛查,提高日用品、食品及药物的安全性等方面的努力,降低自闭症相关遗传与环境两方面的风险因素,从根本上预防新生儿中自闭症发病率的增加趋势。同时,随着全社会对自闭症谱系障碍重视程度的不断提高,对自闭症的基础和临床研究的投入和支持持续增加,未来人们可以发展出针对自闭症谱系障碍的个体化精准治疗,为自闭症病人、家庭和社会带来真正的福音。
在本文成文之际,从深圳传来非常令人鼓舞的消息,《深圳市孤独症全程支持服务实施方案》正式作为政府政策发布。可以乐观预见,随着更多有条件的地方政府的跟进,中国自闭症患者和家庭群体,甚至其他罕见病群体将陆续得到全社会更多的关注和支持,中国自闭症人群将会迎来美好的未来。
注:本文根据笔者在上海市科学技术普及志愿者协会主办的“海上科普论坛”上的报告撰写而成。笔者课题组获科技部科技创新2030—“脑科学与类脑研究”计划“社交障碍的神经环路机制与干预研究”(2021ZD0203900)项目资助
本文来自微信公众号:世界科学 (ID:World-Science),作者:胡荣贵(中国科学院分子细胞卓越创新中心研究员国家杰出青年基金获得者)、魏襄祺(上海世界外国语学校国际高中部学生)、张文阳(中国科学院分子细胞卓越创新中心生物化学与分子生物学研究生)

