出品丨虎嗅科技组
作者丨苏北佛楼蜜
编辑丨陈伊凡
题图丨电影《我不是药神》
你是否思考过一个问题,即便“狡猾”如癌症,也会有“药神”格列卫雄霸多年,但船头一旦倒转,等待人类的总是无法逃离的死亡天堑——有的癌症就是药石无医。
如今,有一项技术,它可以解决上述难题,消灭并治疗绝大多数无药可医的癌症,它就是蛋白降解技术PROTAC。
近日,顶级学术期刊Nature上发布了一篇介绍该技术突破进展的文章,获得产业界的巨大关注,并被诺奖获得者“点赞”,也被誉为蛋白降解技术“年度论文”。

当我们揭开这“万能钥匙”般前沿技术的神秘面纱,人类将癌症完全击败的时代要来了吗?
癌细胞为什么如此猖獗?
如何战胜癌细胞?基本方针就是抑制癌细胞的生长、促进癌细胞的凋亡。
基于此,学者们开始探索是什么原因让癌细胞如此顽固,并拥有异常的增值速度。研究发现,癌细胞表面存在众多蛋白质,他们称作”受体”蛋白,癌症种类不同,受体蛋白的种类与含量也会出现特异性差异。
这些受体蛋白是影响癌细胞异常增值及活性的重要物质。它们通过参与癌细胞生长中代谢过程,让癌细胞的增值速度激增。
但随着研究的递进,人们发现某些小分子药物与癌症某些部位结合,受体也是其中一种,除此之外还包含酶、离子通道、转运体、免疫系统、基因等物质。如今,它们被统称为“靶点”。
顾名思义,靶点就是一个目标,通过小分子化学药物、或生物制剂的参与,阻断受体蛋白所激化的代谢路径、抑制受体蛋白的功能,间接控制癌症的增值速度,以此达到治疗癌症的目的。这里的小分子和生物制剂,分别指代我们熟悉的抗癌药和单克隆抗体。
这么看来,消灭癌症似乎并不难,只要针对不同的靶点,设计开发不同的药物就大功告成,可现实却给了人类一记重拳。
由于靶点结构十分复杂,且大多数还会和我们“捉迷藏”——他们并非单纯蛰伏在细胞表面,更多的则藏在癌细胞内部参与代谢催化。
因此,在传统的小分子抑制剂开发过程中,人们往往发现与疾病相关的目标蛋白质不可成药,究其原因有两个方面,第一,活性位点太多导致单一小分子难以发挥功能;第二,分子“口袋”太浅小分子结合能力差;第三,蛋白质表面“平滑”没有小分子结合位点。
这无疑加大了识别难度,导致无法进一步设计药物;另一方面,即便研发出药物,也无法直达目标发挥作用,严重影响着治疗效果。
因此,人体内有大约85-90%的蛋白就这么成了“不可成药靶点”,特别是有70%的激酶家族都是难成药的靶点。也就是说,药物开发只能“读条”10%,剩下的均处在无人之境。
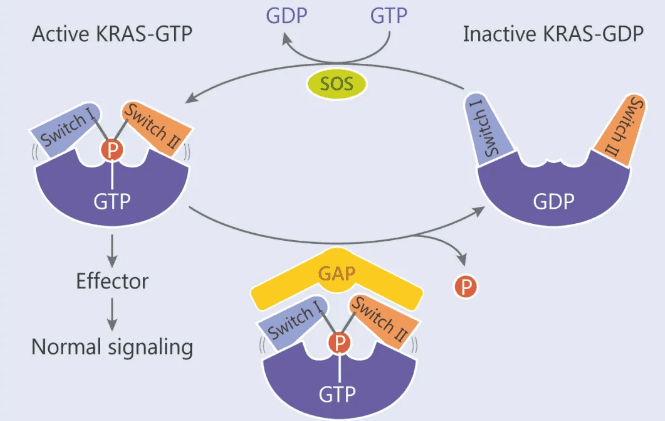
面对难题,人类开发了另一种武器,蛋白降解PROTAC(Proteolysis-Targeting Chimera)技术:如果我们可以通过某种方式,将参与癌症生长的重要蛋白彻底“清除”,无法成药这道难题是否就不再是扼住患者命运的恶魔之手?
清道夫:PROTAC
2001年,PROTAC相关学术论文首次发表,希望利用体内蛋白酶降低靶点受体蛋白水平,而非抑制蛋白功能,被称为Protac-1。
其由两部分组成:靶向METAP2的卵磷脂,用于抑制血管增殖;和来自核因子活化B细胞κ轻链增强子(NF- κBIα,nuclear factor- κB inhibitor- α)的多肽。
因此,这一早期技术如今被称作“bioPROTAC”,但多肽本身稳定性较差,且多肽的分子量大,在体内代谢缓慢,进入细胞也十分困,所以“bioPROTAC”的成药性受到限制。
彼时,上述原因也让PROTAC并未得到太多关注。
为了解决上述问题,科学家将目光转向比多肽更加稳定的“小分子”。
相比传统的小分子药物和基因靶向药物,新一代全小分子PROTAC不仅保持了小分子药物的低生产成本、高效等优势,还能作用传统小分子药物“不可成药的靶点”。
本质上,它一个双功能的小分子,包括两个功能配体和中间的连接子:一个配体负责结合目标蛋白(protein-of-interest,POI),另一个配体负责结合泛素连接酶 (ubiquitin–protein ligases,以下简称 E3)。
简单理解,这一工具主要由三部分组成:E3连接酶配体(清道夫)、连接体(枢纽站)、靶蛋白配体(GPS导航仪)。
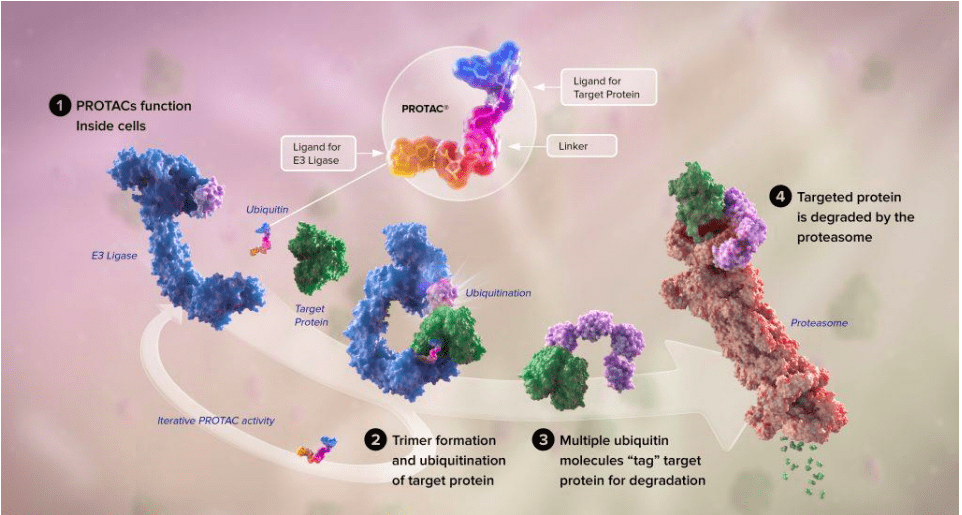
这里需要了解“泛素”这个概念。经过长久以来的进化,真核细胞内逐渐产生了某种“小蛋白”,可以标记需要分解掉的蛋白质,这一过程被称为“泛素化”,被泛素化的蛋白质的蛋白质被标之后,就可以被蛋白酶体所识别的,实现对目标蛋白的靶向降解,理论上就能彻底解决“不可成药”问题。
这个小蛋白就是泛素。它是靶点蛋白降解过程中重要的一环。
如何将体内的泛素“唤醒”并让其加入抗癌大军,是PROTAC工具最关键的部分(E3结合配体)。它相当于一个召唤器,特定的配体才能“招募”泛素的链接酶,进而去水解靶标蛋白,剩下的PROTAC则能够多次循环发挥作用。
不仅于此,由于PROTAC从源头水解蛋白的这一特性,也让它没有了常常掣肘小分子药物效果的“耐药性”。
以上,就是PROTAC这一工具的基本原理。
可惜,寻找E3连接酶配体过程并非一帆风顺,在首次提出概念的七年后,2008年,同样是Crews团队才合成了首个小分子PROTAC(靶向MDM2,一种降解抑癌基因P53蛋白的E3连接酶)。
好事多磨,即便如此,PROTAC技术的发展仍然十分缓慢,其中一个重要原因就是上文提到的关键因素“E3连接酶配体”的缺乏。
直到2019年FDA批准PROTAC首款药物进入临床,名称为“ARV-110”,用于治疗转移性去势抵抗性前列腺癌,PROTAC技术这才进入快速发展期。
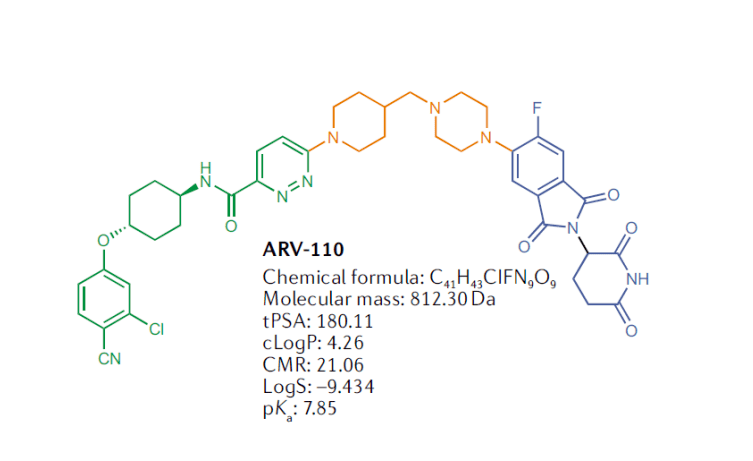
同年,又被Nature杂志专题评为“下一个重磅炸弹疗法”。3年过去了,目前至少有10-20款药物已经或将进入临床。
解决癌症的万能公式出现了?
清楚了解PROTAC的原理后,我们终于能够去探索文章开头提到的“年度最论文”的奥妙所在。
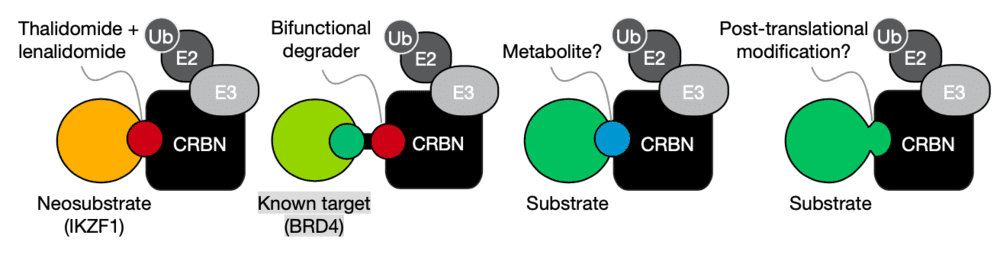
在血液癌症治疗过程中,有两款著名的药物“沙利度胺”和“来那度胺”。这两款度胺类药物都已获得FDA的批准,用于治疗多发性骨髓瘤。
2014-2015年间,有多项研究发现,这些药物能够与名为CRBN的E3连接酶结合,让多种与癌症相关的蛋白被泛素标记,并且被送到细胞中的蛋白酶降解。度胺类药物之所以能够对多发性骨髓瘤等多种血液癌症产生疗效也是源于此。
为什么会产生这一作用?科学家猜测,这些化合物可能是模拟了细胞中能够与CRBN结合的天然化合物的结构。然而,其模拟结构的庐山真面目又是怎样的?“年度论文”提出了自己的看法。
科学家发现,CRBN的E3连接酶主要是通过识别在蛋白上某些特定氨基酸序列,来让其被泛素标记并降解,这些特殊的氨基酸序列被称为“degron”。
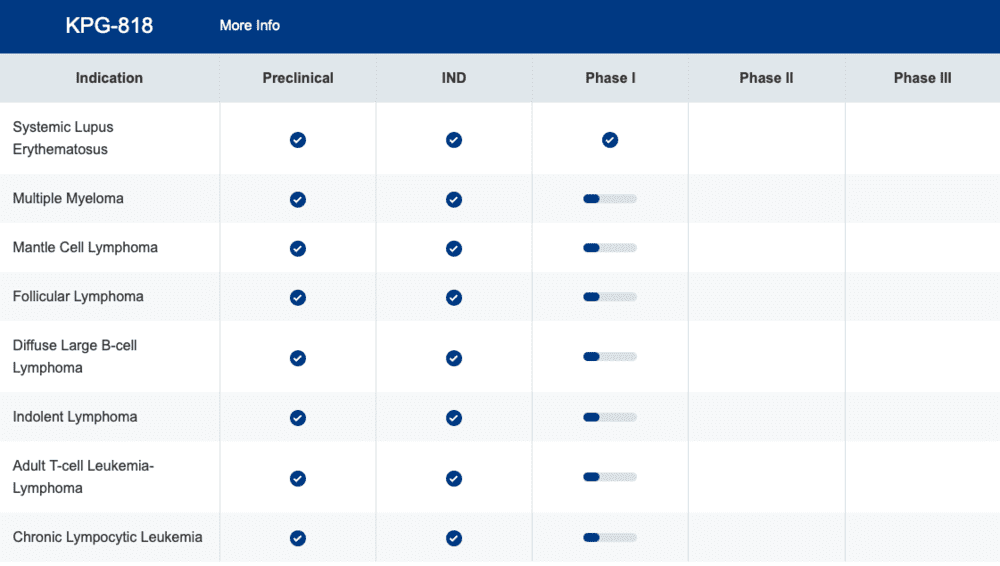
此外,还有6家公司的管线推进到临床I期,分别是冰洲石生物、百济神州、海创药业、海思科和正大天晴等。除此之外,国内抗癌药的“老大哥”恒瑞医药也建立了PROTAC平台,并有管线申报临床。
根据FDA及我国药品监督管理局所披露的数据显示,中国已经进入临床的10条蛋白降解管线中,PROTAC药物研发占据了7条,不止于此,有6条管线的靶点目前在国际上也有进入临床的PROTAC药物。
其中,珃诺生物的TNK05047靶向BRD4,在全球范围内属于First-in-class,用于治疗晚期实体瘤和淋巴瘤患者。同时,中国10款进入临床的药物中,8款药物的适应症集中于癌症,1款针对自身免疫病,1款针对雄激素脱发、痤疮。
即便如此,我们仍有难题有待攻克。
人类基因组中有600种E3,然而现有进入临床的PROTAC药物大多使用 CRBN,这无异缩小了PROTAC的用武之地。
因此,开发利用具有组织、细胞特异性的E3,不仅仅局限于CRBN这一亩三分地,才能让PROTAC拥有更加广阔的未来。
相应的,癌症患者和家属们才能看到更多的希望,由技术孕育的、关于生的希望。

