本文来自微信公众号:科学杂志1915(ID:kexuemag),作者:冯凯、魏铃、田梅,题图来自:视觉中国
表型组作为生命体所有特征的组合,涉及整个生命过程中各种微观和宏观特征及其在时间维度上的变化。表型组学包括基因组学、转录组学、蛋白质组学、代谢组学,以及器官、体质、心理、影像等多种组学。
表型影像学将研究对象的解剖结构、组织器官功能、细胞代谢与生物化学过程等从宏观到微观的各种特征,以二维或三维图像的方式展现出来。它既是表型组学中全面贯穿宏观与微观表型的重要线索和纽带,也是表型组学中将人体精密测量“数字化”后,实现“可视化”的重要方法和目标。
请各位读者想象一下,当您面前放一个装满东西的黑盒子,如何在不打开它的前提下知道里面装的是什么?这也许并不重要,但是当一个人身体中出现了病灶,您准备用什么办法去找到它?
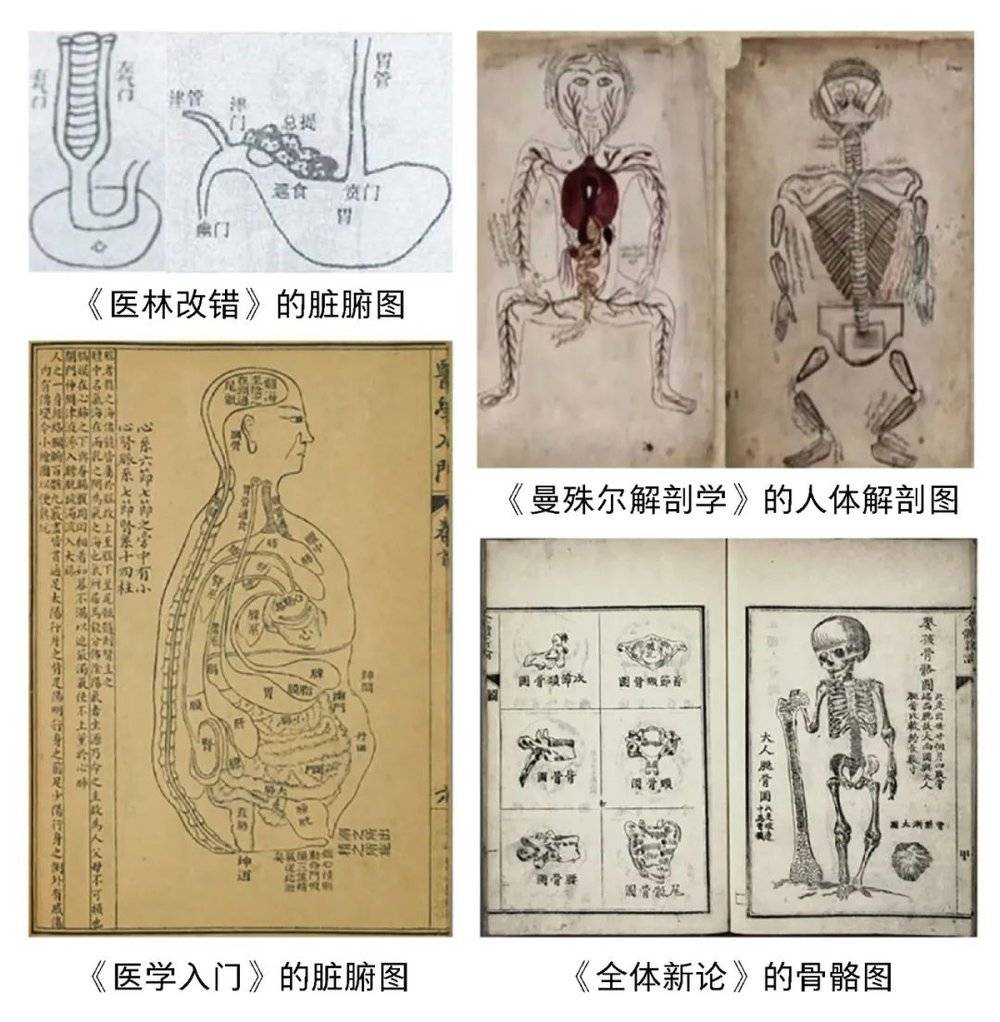
自古以来,人们一直都在尝试各种办法去了解自己身体内部的结构。人体解剖是人类最早了解自身结构的方式,并且在中西方都有较早的记载。早在我国的战国时期,医者通过尸体解剖,将人的五官、大脑、内脏、骨骼、肌肉等结构进行测量并绘制成册;而西方人体解剖的快速发展则始于文艺复兴时期。
如今,随着物理、化学等基础学科的综合发展,我们可以轻松做到人体的“可视化”,通过X射线、超声、磁共振等影像成像技术,“看穿”人体内部的结构,这些技术不仅促进了解剖学的进步,也衍生出医学影像学这门学科,使得解剖学从单纯研究尸体的解剖形态特征,迈向可获取更精细的活体影像的现代医学。
同时,随着人们对基因组学、转录组学、蛋白组学及代谢组学等组学的深入研究,表型组学研究应运而生。影像是现代解剖学的利器,也是表型组学的主要特征之一,表型组学也将进一步促进生命科学研究体系的系统化。
表型组学和表型影像学
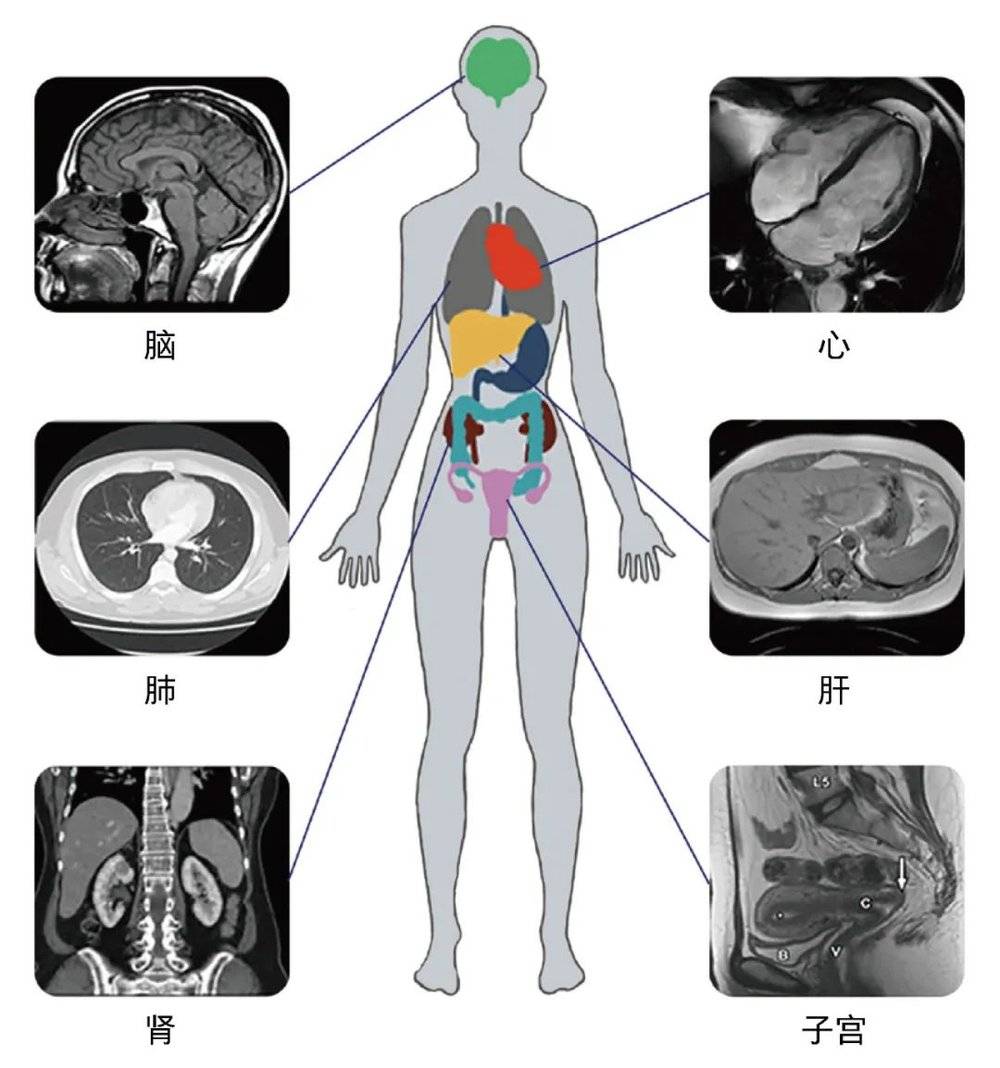
表型即表现型,是指一个生物体基因与环境相互作用下表现出的所有特征和功能,可分为微观表型和宏观表型。微观表型包括分子水平的RNA、蛋白质、代谢分子,细胞水平的血细胞、免疫细胞等;宏观表型涉及脑、心脏、五官、四肢等器官的结构和功能,以及影像、认知和心理表型。
表型组学这一概念由加兰(S. A. Garan)于1996年首次提出,用于表征和描述生物体从胚胎发育、出生、成长、衰老乃至死亡的过程中,个体或群体的物理、化学、生物性状,以及基因、表观遗传、共生微生物、饮食和环境暴露等复杂因素相互作用的集合。表型组学的研究范围涵盖基因组学、转录组学、蛋白质组学、代谢组学与免疫组学等高通量生物表型,还有体内各种组织、器官结构和细胞代谢功能等影像表型,以及生物电、心理、认知等功能表型的系统测量和分析。
表型影像学(phenomic imaging)是指通过利用一种或多种生物医学成像技术方法,对人体或生物体进行研究,并且使这些被研究的表型结果“可视化”。在医学发展之初,人们只能通过自身感官获取人体正常或异常的身体状态,比如中医沿用至今的望、闻、问、切。通过影像成像模态获得一种或多种表型的平面或立体图像,可以实现对该表型的精准定性、定位和定量。
利用表型影像技术方法,还可以对人体或生物体进行时空动态观察,发现各组织器官的形态、功能、生理特征和生物标志物的分布和动态变化,再对影像数据进行深入的特征分析和数据挖掘,可以发现生理或病理的精细改变,这样不仅可预测疾病的发生发展,也可开展疾病治疗过程中的动态可视化监测。表型影像学因其具有无创(非侵入性)、可重复性、时空动态等特点,能全面、动态评估生命体的发育、生长、衰老等生命全过程,也可反映各种疾病或亚健康状态下的组织器官局部微环境。
通过将影像组学与基因、转录、蛋白质、代谢、免疫等多种组学结合进行深入研究,可以进一步探索宏观表型与微观表型之间的关联相关性,将纷繁复杂的表型组学数据集合,以“可视化”方式呈现出来。
表型影像的成像模态——透视神器
17世纪,列文虎克(A. V. Leeuwenhoek)用自制的显微镜观察到细菌、血细胞、植物细胞等原来人类肉眼不可见的结构,开启了微观生命世界的大门。通过显微镜的目镜和物镜,我们认识了细胞的不同结构和部位及其功能,观察到不同疾病环境下各种组织细胞的细微变化,帮助我们更好地理解疾病的成因及其表现。例如,通过流式细胞术可将人体外周血细胞进行分类整理。
此外,人体体表特征也是重要的表型,如中医对于眼睛、面色、舌苔等的认识。离体解剖可对认识人体构造提供一定参考,但仍无法用于深入研究乃至临床治疗,尤其对脏器等重要器官来说,活体内的动态实时变化对于临床研究至关重要。现代科技的发展不仅使我们可对这些器官进行全面测量,而且可以看到以往在活体上无法呈现的世界。
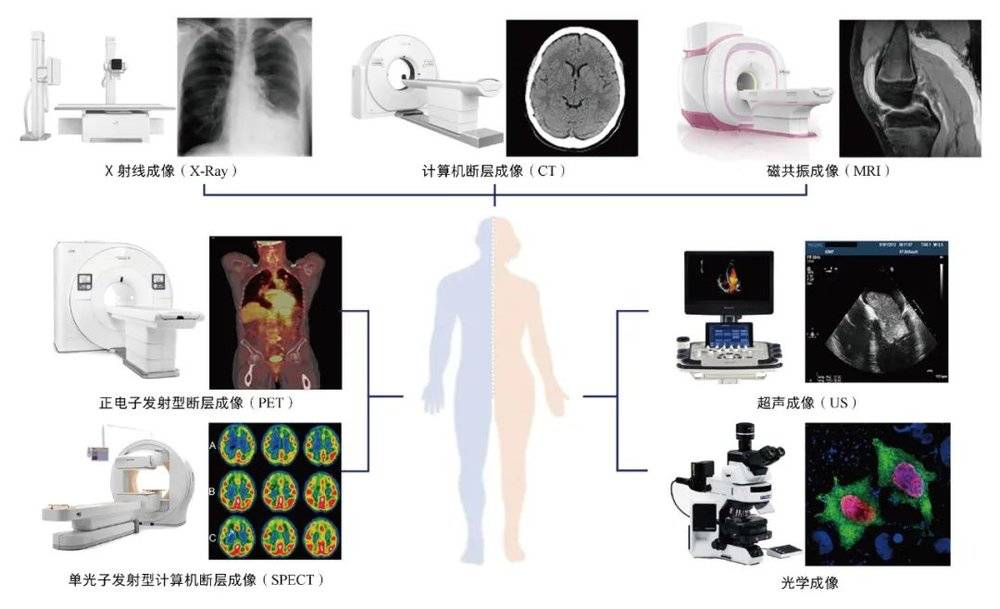
20世纪以来,以X射线、超声、CT、正电子发射型断层成像(PET)、磁共振成像(MRI)为代表的成像技术,正以其无创、实时、高分辨率等特点推动着影像组学的快速发展。通过从高通量成像数据中探索大量具有高度代表性、可量化的结构和功能特征,可发现影像表型与生物体其他表型之间的关系,并用于指导疾病的诊治和预防。
光学成像
1590年,荷兰人扬森(Z. Janssen)发明了光学显微镜,自此光学成像开始蓬勃发展,人类在生命科学领域的探索也进入了微观时代。光学成像通过可见光显示细胞和生物大分子及其代谢情况、人体内脏器的结构及病变等。荧光蛋白成像、光声成像利用短波激发光使组织分别产生多种短波的可见荧光、超声信号而实现可视化,在肿瘤细胞成像、基因表达、干细胞研究等方面发挥着重要作用。
X射线成像
X射线是一种高能电磁辐射,于1895年由伦琴(W. C. Röentgen)首次发现。波长较短的X射线能量较大,称为硬X射线;而波长较长的X射线能量较低,称为软X射线。射线的穿透性、可吸收性、荧光效应、感光效应等特性是X射线成像的基础。由于人体各组织结构固有的密度和厚度不同,当X射线穿过人体时,各组织对X射线的吸收强度也存在差异。
比如,骨骼会比肌肉吸收更多的X射线,在曝光胶片上就显示为更高的密度。在过去100多年里,X射线成像不断发展,已成为疾病诊断中不可或缺的工具。双能X射线骨密度测定就是基于X射线原理开发的骨密度测量的常用方法,已经成为临床上诊断骨质疏松的“金标准”,主要用于测定腰椎、股骨、腕骨等易骨折部位的骨密度,预测骨折风险。
计算机断层成像
计算机断层成像(computed tomography, CT)是基于X射线重建的断层成像,能三维立体地显示人体组织器官的空间结构与形态。第一台CT扫描仪由豪恩斯菲尔德(G. Hounsfield)于1969年发明。经过几十年的发展,第五代CT设备已经问世,检查范围从颅脑扩展到全身,包括非对比扫描及对比增强扫描。其中,对比增强CT可突出正常组织中的病变,被广泛应用于临床诊断。
磁共振成像
磁共振成像(magnetic resonance imaging,MRI)这一技术最早由2003年诺贝尔奖得主曼斯菲尔德(P. Mansfield)和劳特布(P. C. Lauterbur)在20世纪后半叶提出并发展起来。
在强外加磁场内,人体中的氢原子核在特定脉冲作用下会产生共振现象,脉冲停止后的恢复过程中,人体内各组织结构间弛豫时间(即恢复所用的时间)的差异,在磁共振图像上表现为不同强度的信号。MRI以其图像对比度高、无辐射、分辨率高等优点,在指导肿瘤切除、脑和心脏梗死分级、炎症评估等方面发挥了不可或缺的作用。
正电子发射型断层成像
正电子发射型断层成像(positron emission computed tomography, PET)成像技术于1975年由费尔普斯(M. E. Phelps)、爱德华(M. T-P. Edward)和霍夫曼(J. Hoffman)发明。发射正电子的核素被引入体内后,经湮灭辐射转换为γ光子,被符合探测器采集,并由计算机重建为图像。PET图像可反映核素在体内的分布情况,是提供正常或异常的代谢生化信息、评价患者全身状况的代表性影像技术。
目前,可用于临床检测的PET显像剂多达百种,涉及细胞层面的代谢、增殖、免疫、炎症等过程。例如,根据肿瘤细胞异常的能量代谢特征,氟-18(18F)标记的葡萄糖代谢显像剂氟代脱氧葡萄糖(18F-FDG)或细胞乏氧显像剂氟咪唑(18F-FMISO)能够在肿瘤细胞中优先富集,并被PET检测和成像。PET/CT和PET/MRI融合了放射学和分子影像学的优势,能够获取融合的解剖和功能信息,在同一平台上实现同时从两方面分析病灶,广泛应用于多种疾病的诊疗。
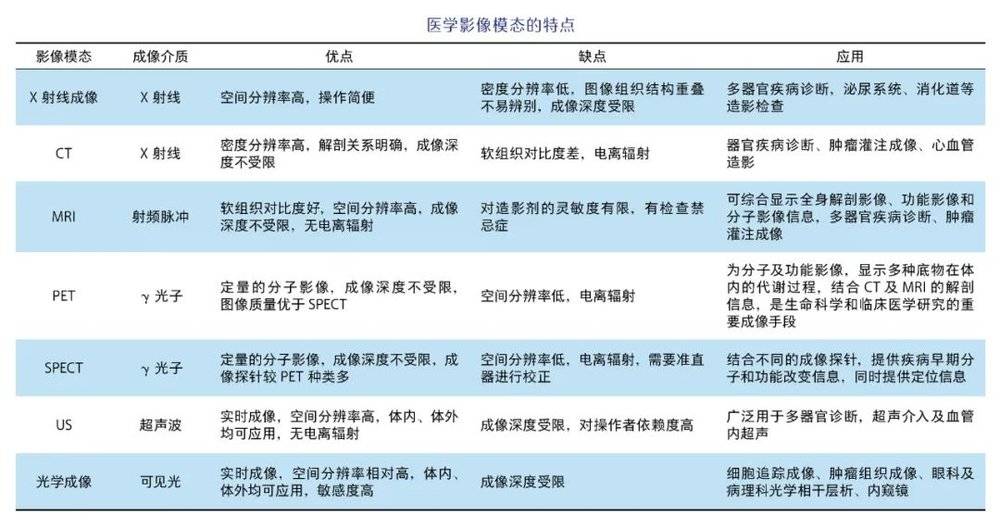
单光子发射型计算机断层成像
单光子发射型计算机断层成像(single photon emission computed tomography, SPECT)借助放射性同位素释放的γ光子在体内的示踪,实现断层成像与分子影像的结合,在临床上广泛用于骨骼显像、心肌灌注显像、肾动态显像、甲状腺显像,以及脑血流灌注显像等。近年来,单一的SPECT成像逐渐被SPECT/CT取代,SPECT/CT结合了SPECT和CT两种成像模态,相较于SPECT具有更高的图像分辨率,且高度互补,其联合应用能显著提高诊断的准确性。
超声成像
超声成像(ultrasound,US)是利用超声波在体内传播时,将不同组织器官对入射波的作用转化为声像图的成像技术。1942年,迪希克(K. T. Dussik)率先将超声波应用于医学诊断。凭借其无辐射、实时成像、操作简便的优势,超声成为妇产科临床诊断中重要的影像工具。目前,超声成像广泛应用于全身多脏器的疾病诊断,包括心脏超声、腹部超声、浅表器官超声、肌骨系统超声、骨密度超声检查及超声介入、血管内超声等。
其他成像模态
还有很多方法可以对人体各部分进行图像采集。通过人体三维外观影像技术,可以将人的面貌、体型等数字化;在医院,喉镜、支气管镜等传统内窥镜可以观察人体呼吸道和消化道组织;脑室镜、胸腔镜等甚至可以经外科手术切口获得人体内各种腔室的影像,这些可视化技术极大地提高了人体黏膜组织疾病的治疗水平;拉曼成像是一种无损伤、无标记的光谱成像技术,能够针对生物组织中的不同化学组分分别进行成像,提供单个细胞的分子组成和结构等信息,在手术和离体样本中协助区分肿瘤与正常组织;
而太赫兹波(THz)是波长介于微波与红外波之间的电磁波,太赫兹波成像可用于早期龋齿的发现,也可以识别离体组织样本及术中成像时识别肿瘤边缘,以及对烧伤严重程度进行判断。电镜(electron microscope,EM)技术能够展现病毒、肿瘤细胞、病变细胞的亚结构,在病理活检诊断中发挥关键作用。
表型影像学的应用
在传统科学研究方法中,科学家通过观察微观表型的变化来寻找对应的宏观表型,这种研究思路的准确性和可行性高,但是效率低、验证周期长,使得最终能够走向临床转化的研究成果九牛一毛。从微观世界到宏观世界,人体包含海量可测量的表型,而这些表型之间的关联数目更是呈指数增加。
表型组学研究的目标之一是尽快发现宏观和微观表型之间的联系,从另一个方向和传统研究对接,从而进一步缩短从科研到临床转化的周期。表型影像学与微观分子表型的整合,涵盖影像—基因组学、影像—转录组学、影像—蛋白质组学、影像—免疫组学和影像—代谢组学等领域,涉及神经系统、循环系统、呼吸系统、消化系统、免疫系统、内分泌系统,以及泌尿生殖系统在内的人体各个系统。
表型影像学研究中,通过对表型组数据进行深度分析,探究基因、表型与环境的内部因果联系,从而快速发现疾病的发病机制、推动靶向药物的研发,最终实现疾病的预测、诊断和精准治疗。
影像基因组学
影像基因组学是一种建立影像表型与基因型之间相关性的新技术,目标是发现新的结合影像表型与基因型的影像生物标志物,实现对疾病发生和发展的风险预测,从而更好地对患者进行分层,实现更精准的治疗。
通过验证的影像基因组学生物标志物,能够在治疗前对患者进行分层评估、治疗中动态监测病情变化,以及预测治疗后的患者生存率。与MRI影像特征相关的多种基因突变标志物,如基因IDH、TP53、EGFR和染色体1p/19q缺失,能够有效地预测脑胶质瘤患者的预后 [1]。
通过构建预测模型、聚类分析等机器学习方法,可以从心血管影像中识别和表征影像功能和解剖表型的遗传变异,这在心血管疾病的研究中显示出巨大的潜力。在一项纳入了1124名健康志愿者的研究中,高分辨率的心脏磁共振图像经自动分割后可用于构建心脏的3D可视化模型,以模拟遗传变异在整个心脏中的影响,从而推导出临床、遗传参数与心脏表型之间的关联 [2]。
影像转录组学
影像转录组学通过结合影像表型与转录组信息,分析基因表达到蛋白质翻译的中间阶段即转录组学的特征,如基因表达和亚型变异,表征关键基因的表达变异及其调控机制,从而更好地了解病理生理学过程中的遗传变化。科学家通过全转录组关联分析,发现33个与痴呆MRI影像标志物(脑白质高信号、平均弥散度、各向异性分数)相关的mRNA。
另外在20名肾透明细胞癌患者的增强CT影像数据纹理分析的回顾性研究中发现,从影像中提取的定量数据与miRNA的表达相关,且肿瘤组织的熵与miR-21-5p(第21个被发现的微小RNA的5’端臂加工产物)之间有更高的相关性 [3]。利用PET测量胰腺癌的代谢肿瘤体积,结合肿瘤组织的转录组分析,可揭示PET图像中代谢表型差异的遗传背景,发现可通过手术安全切除的胰腺癌类型的代谢肿瘤体积,可能与其侵袭性生物学行为有关 [4]。同时,转录组分析也揭示了多种肝细胞癌亚型与18F-尿嘧啶-PET/CT扫描的影像表型之间的关系。
影像蛋白质组学
影像蛋白质组学通过整合蛋白质表达信息与影像中提取的定量特征,进一步分析遗传学、蛋白质组学和影像标志物之间的复杂关联。蛋白质组质谱法可以寻找潜在的蛋白质靶标和异常信号通路,并与MRI、CT、PET等成像模态提取的结构和功能特征建立相关性。
例如,一项研究表明苯巴比妥成瘾的大鼠在停药后出现严重的戒断症状(停药或减少药物摄入引起的症状),并且18F-FDG-PET/CT扫描图像也显示大鼠脑中葡萄糖摄取量显著增加,证明药物成瘾后大脑会受到严重损害。蛋白质组学分析表明,苯巴比妥给药后有大量差异表达的蛋白质富集,引起胰岛素通路下调并引起胰岛素抵抗,导致了脑损伤 [5]。
另一项研究通过82Rb-PET评估了97名心血管系统异常患者的心功能和心肌血流储备,并结合血液蛋白质组学分析找到了潜在靶点,表明蛋白质标志物与非内皮依赖性冠状动脉微血管功能障碍之间存在相关性 [6]。
影像免疫组学
影像免疫组学通过确定影像生物标志物,来评估疾病及其治疗过程中的免疫组学变化。用于评估的成像模态包括CT、MRI、PET,还有放射性小分子、抗体和抗体片段,通过这些方法对肿瘤微环境、免疫状态和治疗过程中的变化进行成像。由于个体疾病、治疗及外界环境因素的影响,人体免疫细胞的数量和功能都在不断变化的过程中,因此细胞免疫检测对于某些疾病的诊断和发病机理研究、机体对环境的免疫反应具有重要意义。
常规的临床检查项目,包括血液白细胞、T细胞、B细胞以及免疫球蛋白的分类计数等。抗CD8免疫PET是探测同系肿瘤免疫治疗模型中,全身和肿瘤浸润CD8表达变化的敏感工具,包括抗原特异性过继T细胞转移、激动性抗体治疗(抗CD137/4-1BB)和检查点阻断抗体疗法(抗PD-L1)[7]。CA199是多种恶性肿瘤的重要特异性标志物,基于CA199特异性抗体的PET示踪剂——89Zr-DFO-HuMab-5B1(MVT-2163),可用于尿路上皮癌的可视化,能够在全身治疗过程中提供肿瘤的特异性信息。
影像代谢组学
不同组织甚至肿瘤的代谢特征都有所不同,对组织生物学变化高度敏感的影像代谢标志物,可以根据代谢特征区分肿瘤亚型,也可应用于疾病分期。例如,通过心脏MRI成像特征评估人体代谢物与心脏形态参数的研究发现,丝氨酸、柠檬酸盐和缬氨酸是左心室参数的独立预测因子;
用18F-FDG-PET测量肝脏脂肪含量,发现肝脏多发性硬化与酪氨酸和溶血磷脂酰胆碱呈负相关 [8]。结合脑脊液的生化指标分析发现,鞘脂可作为阿尔兹海默症的早期诊断标志物,并确定了一些潜在的多发性硬化症标志物,如半乳糖凝集素、单核细胞趋化蛋白的异常表达 [9]。影像组学和代谢组学的结合不仅可以看到组织代谢异常,也促进了特异性靶向药物的开发,提高了临床诊断治疗的效率和潜能。
展望
作为获取宏观人体表型的技术之一,影像学在临床中扮演着不可替代的角色。通过显微镜我们在可见光下看见了细胞;X射线的发现让我们第一次非侵入地观察到了人体内的骨骼;超声成像、磁共振成像让我们窥见了器官和组织的精细结构及其生理功能;核素的利用使代谢分子在器官或病灶中的空间动态分布可视化;电镜使得更小的细胞器甚至分子和原子的结构展露无遗。高通量测量和更多成像技术的出现和不断进步,促进了新一代组学研究的发展,大数据可用性、高效性的进一步发展也不断突破人类的观察维度,提高了人类对自身和生命的认识。
近30年来,宏大的“基因组计划”引领和促进了21世纪人类科技、健康和医疗的飞速发展,并为其他组学奠定了坚实的基础。随着动物表型组计划的逐渐成熟,“人类表型组计划”也在世界各地开始发展。
同时,在接下来的30年里,“人类表型组计划”有望成为继“人类基因组计划”之后,引领生命科学和全人类健康事业发展的下一个原始创新策源地。影像特征与“组学”特征相关联的高通量分析方法的快速发展,也预示着表型影像学的新前景,成为实现“人类表型组计划”在科学研究、产业应用、社会效益等方面产生多重成效的重要手段。
同时,随着人工智能技术的兴起和广泛应用,表型影像学与各组学、表型以及数据源结合的复杂模型,可以克服表型和临床之间的诸多挑战,成为真正的探索人体内部奥秘、实现人体“数字化”和“可视化”的科学动力。
冯凯,博士研究生;魏铃,博士研究生;田梅,教授:复旦大学人类表型组研究院,上海,201203。[email protected]
Feng Kai, Doctoral Candidate; Wei Ling, Doctoral Candidate; Tian Mei, Professor: Human Phenome Institute, Fudan University, Shanghai 201203.
参考文献:
1. Hsieh K L, Chen C Y,Lo C M. Radiomic model for predicting mutations in the isocitrate dehydrogenase gene in glioblastomas. Oncotarget, 2017, 8(28): 45888-45897.
2. Biffi C, de Marvao A, Attard M I, et al. Three-dimensional cardiovascular imaging-genetics: a mass univariate framework. Bioinformatics (Oxford, England), 2018, 34(1): 97-103.
3. Marigliano C, Badia S, Bellini D, et al. Radiogenomics in clear cell renal cell carcinoma: correlations between advanced ct imaging (texture analysis) and microRNAs expression. Technol Cancer Res Treat, 2019, 18: 1533033819878458.
4. Lee S H, Hwang H K, Lee W J, et al. Preoperative metabolic tumor volume (2.5) associated with early systemic metastasis in resected pancreatic cancer: a transcriptome-wide analysis. Gut Liver, 2019, 13(3): 356-365.
5. Wang M, Pu X, Feng B, et al. Alterations of glucose uptake and protein expression related to the insulin signaling pathway in the brain of phenobarbital-addictive rats by (18)F-FDG PET/CT and proteomic analysis. J Proteome Res, 2021, 20(1): 950-959.
6. Schroder J, Zethner-Moller R, Bové K B, et al. Protein biomarkers and coronary microvascular dilatation assessed by rubidium-82 PET in women with angina pectoris and no obstructive coronary artery disease. Atherosclerosis, 2018, 275: 319-327.
7. Tavaré R, Escuin-Ordinas H, Mok S, et al. An effective immuno-PET imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Res, 2016, 76(1): 73-82.
8. Diamanti K, Visvanathar R, Pereira M J, et al. Integration of whole-body [(18)F]FDG PET/MRI with non-targeted metabolomics can provide new insights on tissue-specific insulin resistance in type 2 diabetes. Sci Rep, 2020, 10(1): 8343.
9. Varma V R, Oommen A M, Varma S, et al. Brain and blood metabolite signatures of pathology and progression in Alzheimer disease: a targeted metabolomics study. PLoS Med, 2018, 15(1): e1002482.
本文来自微信公众号:科学杂志1915(ID:kexuemag),作者:冯凯、魏铃、田梅

