人类对客观世界的认知,始于感觉。两位美国生物学家,朱利叶斯和帕塔普蒂安因“发现温度和触觉感受器”获得2021年度诺贝尔生理学或医学奖。他们的研究不仅从分子层面为我们解释了身体内外环境中的温度和机械刺激如何转化为神经系统可识别的电信号,揭示了躯体感觉(痛觉、触觉、本体感觉、温度觉等)的分子机理,更新了我们对躯体感觉的认知,更有可能为我们带来治疗疼痛的新方法。
本文来自微信公众号:科学杂志1915 (ID:kexuemag),作者:范小治 谢阳 唐逸泉,题图来自:视觉中国
1932年的诺贝尔生理学或医学奖得主谢灵顿爵士(Sir C. S. Sherrington)在他发表于1906年的经典神经生理学著作《神经系统的整合作用》中,把感觉器官分为三类:外感受器,介导如视觉、听觉、嗅觉及触觉等感觉;内感受器,感知身体里各种内脏器官活动及变化;本体感受器,存在于肌、腱、关节等运动器官中感知身体的位置、姿态和动作。
感觉信息在被人体的感受器接收后,会通过神经通路传递到大脑中与感觉有关的区域,大脑再对感觉信息进行处理和整合,信息得以被感知。自1911年瑞典眼科医生古尔斯特兰德(A. Gullstrand)因阐述人眼成像的屈光原理获得诺贝尔生理学或医学奖开始,至今共有7次诺贝尔生理学或医学奖颁给了与感觉系统相关的研究,视觉、嗅觉、触觉等多种感觉的分子受体相继被发现,感觉系统的运作原理逐渐被阐释。
辣椒与热感受器
自古以来,中国人对饮食的口味常以“五味”概括——“酸、甜、苦、辣、咸”。辣味与其他四味有什么区别呢?早在1940年代,匈牙利科学家杨索(N. Jancsó)便发现了作为辣椒的活性物质——辣椒素在疼痛中的作用:如果给小鼠、大鼠、豚鼠和狗等动物抹辣椒素,可以让它们之后变得对包括辣椒素在内的可引起疼痛的化学刺激物不敏感,提示辣椒素可以特异性地影响负责感知疼痛的伤害性感受神经元,使其脱敏,因此辣椒素有作为镇痛药物的潜力。
杨索的发现很重要,可因为政治原因,那时来自东欧的科学研究很难在西方的学术期刊上得以发表,且因为他的发现在当时很有颠覆性(会引起疼痛的辣椒素可用来镇痛),他也有些疲于应付审稿人,所以在他生前,他的研究发现基本都是以会议报告的形式公布,直到他死后才由他的妻子和助手整理发表。
他的发现不仅证明伤害性感受神经元可以被药理学干预,而且揭示了这些神经元在疼痛感知之外的功能(因为可以通过辣椒素特异性清除伤害性感受神经元来研究它们的功能)。因此,辣,其实并不是一种味觉,而是一种痛觉。
那么,辣椒里的辣椒素是怎么引起痛觉的呢?这个难题就是由朱利叶斯解决的。朱利叶斯(D. Julius)1955年出生于美国纽约,1977年大学毕业于美国麻省理工学院,1984年博士毕业于加州大学伯克利分校,导师为索纳(J. Thorner)教授和因研究蛋白质囊泡运输而获得2013年诺贝尔生理学或医学奖的谢克曼(R. Schekman)教授。
谢克曼的导师科恩伯格(A. Kornberg)是1959年诺贝尔生理学或医学奖得主,以及导师的导师“科恩伯格的三位导师是1947年诺贝尔生理学或医学奖得主科里夫妇(C. F. Cori, G. T. Cori),和与他同年得奖的奥乔亚(S. Ochoa)”都是诺贝尔奖得主。朱利叶斯算是他所在学术谱系里第四代诺贝尔奖得主。随后,他加入哥伦比亚大学进行博士后研究,导师是因发现嗅觉感受器而获得2004年诺贝尔生理学或医学奖的阿克塞尔(R. Axel)教授。
博士后阶段,他利用一种DNA克隆技术——表达克隆(expression cloning)发现了五羟色胺受体1c [1],这也是他后来用于寻找辣椒素受体的方法。这种方法就是在细胞中通过基因表达的载体,来构建能产生基因编码蛋白的表达克隆文库,每个克隆表达一种蛋白质,然后筛选该表达文库的某种目标特性,以发现目标克隆用于进一步分析。
1990年,朱利叶斯加入加州大学旧金山分校建立了自己的实验室,开展独立研究工作至今。当时尽管已经知道辣椒素可特异性地作用于伤害性感受神经元引起的痛觉,可对辣椒素在伤害性感受神经元里的靶向受体是什么,依然未知。
我们的躯体感觉系统里面有一个很关键的结构叫背根神经节,皮肤下的神经末梢会把辣或者热的信号转化为电信号,传递到背根神经节。当时已经知道背根神经节的感觉神经元对辣椒素敏感,所以朱利叶斯和他的博士后卡特林那(M. Caterina)就把大鼠的背根神经节取出来,再把里面的RNA提取出来制备了一个cDNA文库,然后把这个文库里的DNA片段一批批放到一种原来对辣椒素不敏感的细胞里面去。
他们假设辣椒素反应是由单个基因介导的,只要把这个基因放到原来对辣椒素不敏感的细胞里,就可以让这些细胞变得对辣椒素敏感。他们测试了16 000多个DNA片段,最终发现一个辣椒素受体基因——VR1(vanilloid receptor 1)。进一步的研究发现,该基因编码的蛋白质属于TRP(transient receptor potential)通道蛋白家族(这是一类在外周和中枢神经系统中分布很广泛的通道蛋白,有超过30个成员),因此这个蛋白又称TRPV1。
虽然知道吃辣会带给我们一种“火”辣辣的感觉,但起初他们也没有想到热和辣的感觉会是由同一个受体分子介导的。他们试了各种各样的刺激,令人惊讶地发现,TRPV1这个蛋白不仅可以被辣椒素激活,还会被43℃以上的热温度激活 [2]。随后朱利叶斯课题组和英国一家药厂的进一步研究都发现,缺乏TRPV1的小鼠几乎没有炎症引发的热痛觉过敏,提示TRPV1对于炎症状态下的疼痛感知很关键 [3,4]。
不过,TRPV1的缺乏并没有导致正常状态下伤害性热感觉的完全缺失,这说明必然还有其他热感受器的存在。科学家把目光转向其他TRP通道蛋白,最终发现TRPM3和TRPA1与TRPV1共同介导了伤害性热刺激的感受 [5]。
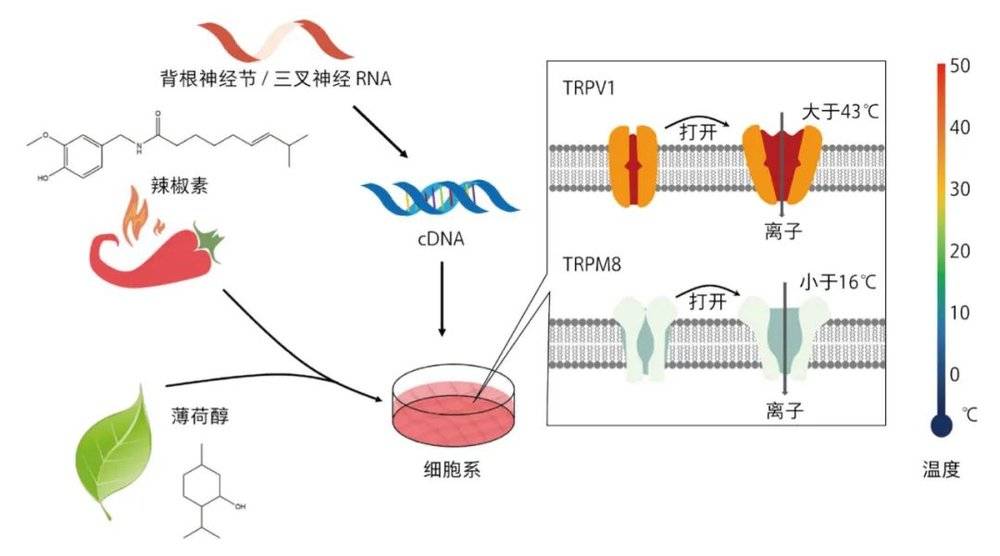
朱利叶斯的开创性工作揭开了人类感受温度和痛觉的分子机理。离子通道如同细胞膜上的一道闸门,它的开关控制着离子进出细胞。TRPV1受体作为一类特殊的离子通道,特异性表达于伤害性感受神经元,当有辣椒素或者高温刺激时,TRPV1通道的闸门就会打开,细胞膜外的阳离子通过其进入细胞,造成细胞膜内外的电压变化。这便会产生神经冲动,沿着神经纤维传导,最终把信号传递到大脑皮层。
后续的大量研究发现,各种引起炎症或者疼痛的信号都能激活或者敏化TRPV1,因此,TRPV1除了被认为是伤害性热刺激或者辣椒素感受器之外,也是疼痛信号的关键处理器,所以大量实验室和药物公司都在以TRPV1为靶点研发镇痛药物。
薄荷与冷感受器
“多年以后,面对行刑队,奥雷里亚诺·布恩迪亚上校将会想起父亲带他去见识冰块的那个遥远的下午。”在小说《百年孤独》中,让一位族长式的人物在临死前仍记忆犹新的,竟然是第一次接触冰块时,手上每一根神经给他带来的异样感觉,以至于让他惊呼:“它在烧!”。这里涉及另一种温度感觉——冷感觉。
朱利叶斯通过辣椒素发现了热感觉的分子受体TRPV1以后,他想用类似策略寻找冷感觉的分子受体。他们联想到会让人觉得“凉”丝丝的薄荷,于是开始寻找薄荷的提炼物——薄荷醇的分子受体。与寻找辣椒素受体的表达克隆策略一样,他们假设薄荷醇反应也是由单个基因介导的,只要把这个基因放到原来对薄荷醇不敏感的细胞里,就可以让这些细胞变得对薄荷醇敏感。
他们测试了从三叉神经里提取制备的cDNA文库中的1万多个DNA片段,最终发现了与TRPV1同属TRP通道家族的薄荷醇受体TRPM8 [6],并进一步证明TRPM8也是介导生理冷感觉的冷感受器 [7]。
那时候,帕塔普蒂安(A. Patapoutian)也开始进行研究。与朱利叶斯相比,帕塔普蒂安的经历则要坎坷一些。他1967年出生于黎巴嫩首都贝鲁特,是家中三个孩子里最小的一个。
黎巴嫩从1975年到1990年一直在内战,他在贝鲁特美国大学上了一年大学后就被军队抓了。几个月后,18岁的他以难民身份来到美国洛杉矶。刚到美国的第一年,他过得很艰辛,为了生存,他打工送披萨,还每周帮当地一家亚美尼亚报纸写星座运势赚钱。后来他获得了加州大学洛杉矶分校的录取通知,重启大学生活。
在大学里,为了获得教授的推荐信去申请医学院,他加入伦吉尔(J. A. Lengyel)的果蝇发育生物学实验室学习分子生物学。当得知读研究生可以拿到每个月1000美元的津贴(多么朴素的理由!),他毅然弃医从理,申请去加州理工学院读博士,导师是沃尔德(B. Wold)教授。
1996年,他加入朱利叶斯所在的加州大学旧金山分校进行博士后研究,导师是赖卡特(L. Reichardt)教授。2000年,帕塔普蒂安加入位于南加州圣地亚哥的斯克里普斯研究所,建立了自己的实验室,开展独立研究工作至今。受到热感受器TRPV1发现的启发,他对寻找冷感受器也充满了兴趣,几乎是同时,帕塔普蒂安的实验室也发现了TRPM8是冷感受器。
感受压力的细胞与触觉感受器
“触觉先于视觉,先于语言。它是最初之语也是最后之语,它从不说谎(Touch comes before sight, before speech. It is the first language and the last, and it always tells the truth)。” 加拿大著名小说家、诗人阿特伍德(M. Atwood)在她的小说《盲眼刺客》(The Blind Assassin)里如此描述触觉。
发现新的温度感受器后,帕塔普蒂安没有停下探索的脚步,开始把目光移向机械力感受器。他和他的博士后科斯特(B. Coste)首先找到了一种特殊的细胞,这种细胞会对机械力有反应,当用一个玻璃电极去戳这个细胞时,细胞会产生一个微小的电流,并能够被特殊的电生理仪器——膜片钳系统采集到。然后,他们挑选了300多个在这类细胞里高表达的膜蛋白基因,用RNA干扰技术一一抑制这些候选基因的表达,再观测细胞对机械力刺激的电反应有无变化。
当筛到第72个基因时,他们观察到细胞受机械力刺激产生的电流极大地减小了,这意味着该基因对于细胞机械力感受反应是必需的。他们给这个基因起名“Piezo1”,Piezo 源自希腊语的“压力” [8]。随后,通过基因序列比对,发现这个基因所在家族中还有另外一个成员“Piezo2”,并通过后续一系列研究,证明Piezo2基因编码介导触觉和本体感觉的机械力感受器 [9,10]。
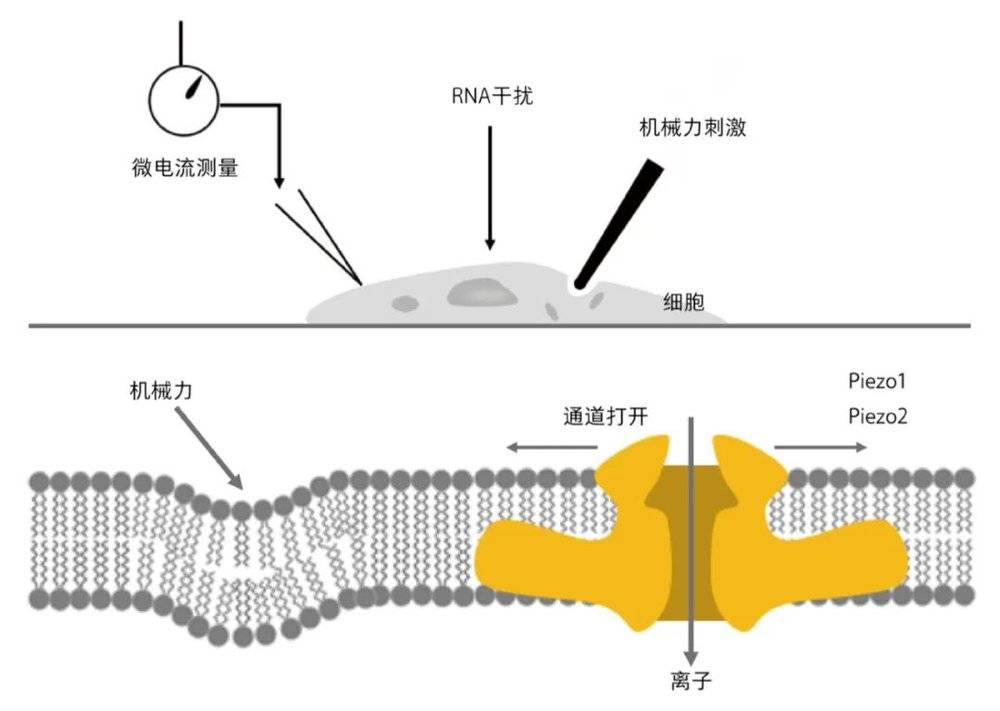 通过对一种机械力敏感细胞进行功能缺失筛选,发现Piezo通道
通过对一种机械力敏感细胞进行功能缺失筛选,发现Piezo通道
Piezo分子可以表达在包括感觉神经元、血管内皮细胞、红细胞、平滑肌细胞、上皮细胞以及成骨细胞等多种细胞类型中,参与身体内各种组织器官和生理过程的机械力感知。其中,Piezo1参与血管发育、红细胞体积调节、骨骼生成和修复、肠蠕动和结肠炎等多种生理病理过程。而Piezo2则是初级感觉神经元和皮肤感受器细胞(如Merkel细胞,一种位于神经末梢的树枝状细胞)上的机械力感受器,除了介导触觉和本体感觉以外,Piezo2还能介导被敏化的机械痛觉,以及呼吸调节和排尿的生理过程。
肺鼓胀到一定程度,分布在肺部的感觉神经可感知肺牵拉,把信号传递给大脑,调整呼吸节奏,这种对肺牵拉的机械力感知就是Piezo2介导的;膀胱充盈产生尿意,Piezo2帮助感觉神经元感知膀胱充盈产生的机械力刺激。
诺奖的背后
受新冠疫情影响,新冠疫苗研究的相关成果成为很多人预想中今年诺贝尔生理学或医学奖的获奖热点,而结果使大家觉得今年的诺奖项目“爆冷”;即使朱利叶斯和帕塔普蒂安认为自己迟早会获奖,他们自己可能也没想到今年会获奖。所以,两位教授获知自己得奖的方式都很有趣。由于时差,颁奖委员会公布结果的时间,对于身处美国加州的朱利叶斯和帕塔普蒂安都不算友好(半夜两点半),两位教授都没在第一时间接到颁奖委员会的电话。
朱利叶斯先是收到来自他嫂子的信息:“瑞典有个叫佩尔曼(委员会总秘书)的人找到了我,想给你打电话,我不想把你的电话号码给他,但我在网上搜了下,他似乎还挺靠谱的,所以我要了他的电话,你可以自己打回去。”朱利叶斯的太太英格勒厄姆(H.Ingraham)也是加州大学旧金山分校的教授,她认识佩尔曼,于是他们决定给他回个电话,看看是否是她熟悉的声音。
电话打通了,确实是。但是电话那边的佩尔曼说他只能聊三分钟了,因为再过五分钟,他就要去开新闻发布会宣布这个消息,他们可以自己上网看直播。于是朱利叶斯和太太一起泡了杯咖啡,在厨房看起了直播。而帕塔普蒂安教授则是先接到了自己住在洛杉矶的92岁老父亲的电话,告诉他颁奖委员会因为打不通他的手机(晚上开了免打扰模式),找到了自己。幸运的是,他父亲知道怎么绕过免打扰模式找到他。
科学家们对TRP通道和Piezo通道的研究,从分子水平上揭开了人体感知温度和机械力的神秘面纱,虽然戴上诺奖皇冠的人只有朱利叶斯和帕塔普蒂安二位,但研究成果的背后也离不开相关领域内诸多其他科学家的贡献。
其中,两位华人科学家的研究工作,都起到了举足轻重的作用,一位是朱利叶斯多年的合作伙伴、加州大学旧金山分校的程亦凡教授,他解析了包括TRPV1在内的多个TRP通道的分子结构;另一位是帕塔普蒂安曾经的博士后、现就职于清华大学药学院的肖百龙教授,他解析了Piezo1和Piezo2通道的分子结构。他们的工作,为我们理解温度和机械力感受器是如何工作的,提供了关键信息,在此也应当被铭记。
参考资料:
1.Julius D, MacDermott A B, Axel R, et al. Molecular characterization of a functional cDNA encoding the serotonin 1c receptor. Science, 1988, 241: 558-564.
2.Caterina M J, Schumacher M A, Tominaga M, et al. The capsaicin receptor: a heat-activated ion channel in the pain pathway. Nature, 1997, 389: 816-824.
3.Caterina M J, Leffler A, Malmberg A B, et al. Impaired nociception and pain sensation in mice lacking the capsaicin receptor. Science, 2000, 288: 306-313.
4.Davis J B, Gray J, Gunthorpe M J, et al. Vanilloid receptor-1 is essential for inflammatory thermal hyperalgesia. Nature, 2000, 405: 183-187.
5.Vandewauw I, De Clercq K, Mulier M, et al. A TRP channel trio mediates acute noxious heat sensing. Nature,2018, 555: 662-666.
6.McKemy D D, Neuhausser W M, Julius D. Identification of a cold receptor reveals a general role for TRP channels in thermosensation. Nature,2002, 416: 52-58.
7.Bautista D M, Siemens J, Glazer J M, et al. The menthol receptor TRPM8 is the principal detector of environmental cold. Nature, 2007, 448: 204-208.
8.Coste B, Mathur J, Schmidt M, et al. Piezo1 and Piezo2 are essential components of distinct mechanically activated cation channels. Science, 2010, 330: 55-60.
9.Ranade S S, Woo S H, Dubin A E, et al. Piezo2 is the major transducer of mechanical forces for touch sensation in mice. Nature, 2014, 516: 121-125.
10.Woo S H, Lukacs V, de Nooij J C, et al. Piezo2 is the principal mechanotransduction channel for proprioception. Nat Neurosci, 2015, 18: 1756-1762.
本文来自微信公众号:科学杂志1915 (ID:kexuemag),作者:范小治 谢阳 唐逸泉

