2月10日晚间,国产PD-1肿瘤药——信达生物(01801)信迪利单抗直面美国食品和药物管理局(FDA)肿瘤药物咨询委员会(ODAC)会议审评,讨论其基于中国临床数据的有关联合疗法能否在美国获批上市。
这是国产PD-1肿瘤药首次直面ODAC,闯关FDA,因此引发行业和投资者多方关注。最终ODAC要求信达生物补充额外的临床试验,信迪利单抗在美国上市申请暂时遇挫。
11日信达生物发布公告称,该公司将和相关方继续与FDA配合,完成新药上市申请的审评工作。ODAC就已上市和临床中的肿瘤药品,为FDA提供独立的专业性意见。FDA在新药审批过程中将采纳ODAC的投票意见,但ODAC投票意见不具有对FDA决策的约束力。

公告截图
人体免疫细胞上有一个蛋白PD-1 (程序化死亡分子),而肿瘤细胞会产生一个免疫球蛋白样的分子PD-L1(细胞程式死亡-配体1)。两个分子结合时,会降低免疫细胞的活性,帮助肿瘤隐藏。
PD-1/PD-L1抗体药可以阻断两者结合,从而让免疫细胞保持活性,杀伤肿瘤细胞。单抗即单克隆抗体。相比于化学药物,单抗药物通常不会错误识别和攻击正常细胞,具有用药量小、副作用小等特点,多用于肿瘤治疗。
因此PD-1/PD-L1抗体药,常被看作“明星肿瘤药”、“抗癌神药”,备受追捧。以PD-1默沙东K药为例,它2020年全球大卖143.8亿美元,到2021年第三季度保持了22%的增长。全球范围内获批的适应症近30种,甚至已有不限癌种适应症获批。
另据弗若斯特沙利文早年分析,到2023年,全球PD-1/PD-L1市场规模可以达到600亿美元以上,中国市场也将接近千亿元水平。综合因素之下,PD-1也一直被视为中国创新药发展的“风向标”。恒瑞医药、百济神州、君实生物和信达生物等企业,都在该赛道上有所布局。
官网信息显示,信达生物成立于2011年,从事开发、生产和销售用于治疗肿瘤等重大疾病的创新药物。2018年10月31日,信达生物制药在香港联交所主板挂牌上市。
信迪利单抗是信达生物制药(苏州)有限公司自主研发的创新生物药,由信达与礼来制药公司共同开发和商业化。信迪利单抗为全人源化的IgG4单克隆抗体,能特异性结合T细胞表面的PD-1分子,阻断这条免疫逃逸通路,重新激活T细胞,释放细胞因子杀伤肿瘤细胞。
信达生物方面表示,信迪利单抗注射液的商品名为达伯舒。2021年12月,达伯舒成为唯一一个拥有包含一线非鳞状非小细胞肺癌、一线鳞状非小细胞肺癌、一线肝癌及霍奇金淋巴瘤在内的四项适应症获批,并均被纳入国家医保的PD-1抑制剂。
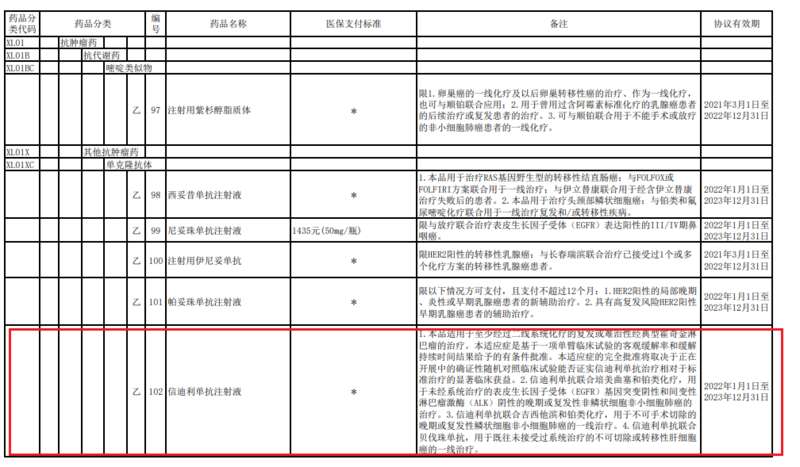
《国家基本医疗保险、工伤保险和生育保险药品目录(2021年)》 协议期内谈判药品部分截图
信迪利单抗此番闯关FDA暂时受阻,或许与其三期临床试验有关。
资料显示,引发中美双方关注的ORIENT-11研究是一项评估信迪利单抗注射液或安慰剂联合培美曲塞和铂类用于晚期或复发性非鳞状非小细胞肺癌一线治疗有效性和安全性的随机、双盲、III期对照临床研究。
该研究共入组397例受试者,按照2:1随机入组,分别接受信迪利单抗注射液200mg或安慰剂联合培美曲塞和铂类治疗,每3周给药1次,完成4个周期治疗后,进入信迪利单抗或安慰剂联合培美曲塞维持阶段,治疗直至疾病进展、毒性不可耐受或其他需要终止治疗的情况。对照组疾病进展后可有条件交叉至信迪利单抗单药治疗。
综合FDA文件等公开资料,ODAC提出异议的主要原因是,信迪利单抗所基于的ORIENT-11三期临床仅在中国进行而非国际多中心临床研究(MRCT),不符合临床试验人群的多样性原则。此外,该临床试验以无进展生存期(PFS)为临床终点,FDA则认为应当以总生存期(OS)为临床终点,且应该把已批准的PD-1疗法作为对照组进行头对头试验。该委员会建议,应在获批前补充额外临床试验,以证明信迪利单抗在美国人群和美国医疗实践中的适用性。
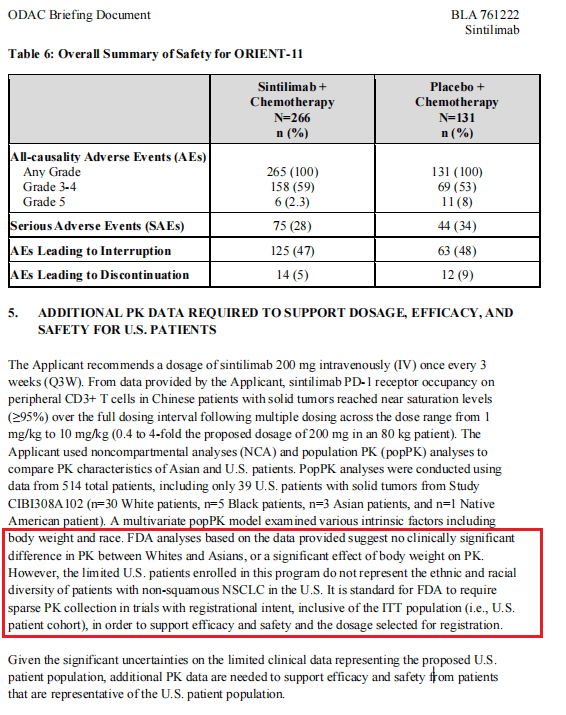
信迪利单抗需要更多的药物动力学数据 图源FDA网站
对于此事,信达生物制药集团总裁刘勇军表示:“ ORIENT-11是一项高质量、高标准、由经验丰富的临床研究者参与的符合全球认证GCP要求的中国临床试验。ORIENT-11试验结果数据展示了信迪利单抗的综合获益大于风险。FDA没有任何对于信迪利单抗安全性问题的质疑。虽然对于这次ODAC投票结果感到遗憾,我们将与礼来共同配合FDA继续完成BLA申请的相关审评工作。我们对信迪利单抗的质量与价值一如既往充满信心。”
礼来制药肿瘤事业部总裁纳尔登(Jacob Van Naarden)则表示:“虽然我们对今天关于信迪利单抗的ODAC投票结果感到遗憾,我们依旧感谢有这个机会能公开充分地讨论信迪利单抗的注册申请,以及针对单一国家临床研究的监管尺度的广泛讨论,礼来和信达会一起配合FDA继续完成BLA的相关审评工作。”
今日(2月11日)港股收盘,信达生物报每股31.6元,收跌7.47%。综合《每日经济新闻》报道,除信达生物外,君实生物、百济神州、恒瑞医药等国产PD-1企业也已向FDA递交上市申请,集体闯关FDA。国产PD-1出海之路值得进一步观察。
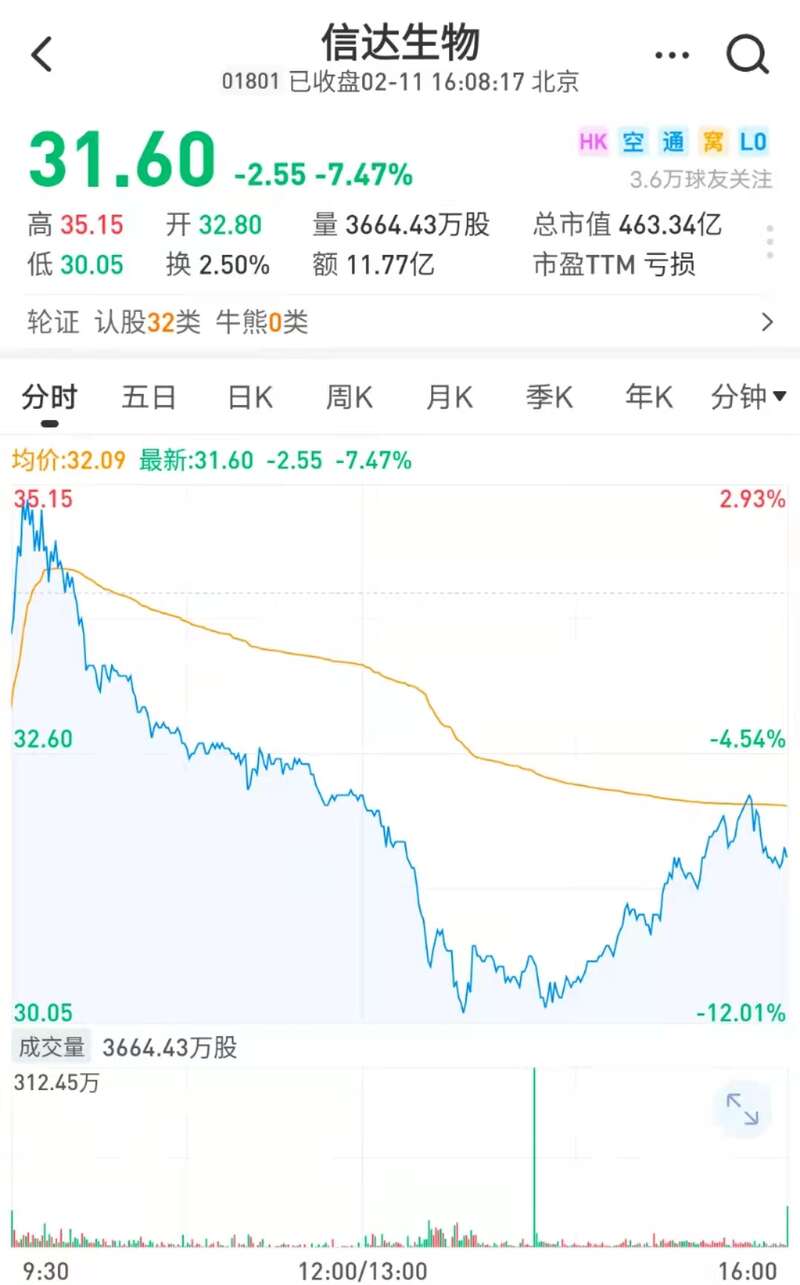
雪球网截图
FDA委员会不建议批准礼来肺癌新药
FDA委员会不建议批准礼来肺癌新药,因其仅在中国试验

位于马里兰州银泉的美国食品与药品管理局总部。该机构专家组的决定源于一个长期争议问题:未经美国试验、仅在他国测试过的药物能否被接受? JIM LO SCALZO/EPA, VIA SHUTTERSTOCK
周四,美国食品与药品管理局(简称FDA)的一个顾问委员会以压倒性多数投票拒绝建议FDA批准一种肺癌药物,该药物仅在中国进行过试验和销售。
该药物名为信迪利单抗(sintilimab),是检查点抑制剂——一种通过激发免疫系统来攻击肿瘤的免疫疗法。该药由信达生物在中国研发和试验,并与礼来制药公司达成协议,如获批准,将由礼来负责在美国的销售。该药物将和化疗一起被用于转移性非小细胞肺癌患者的治疗。
FDA专家组争论的一个长期存在的疑问在于:批准药物时应采用何种标准?是否应该接受缺乏美国国内试验、仅在中国或美国以外的其他国家试验过的药物?
尤其考虑到美中近年来在中国科学家的研究成果上的矛盾,这一决定可能会受到密切关注,因其可能暗示两国的紧张关系会否进一步加剧。免疫疗法在美国非常昂贵,因此,将一种更廉价的疗法推向市场的可能性也成为了周四讨论的重要背景。
周四,FDA肿瘤学部门的权威主任专家理查德·帕兹杜尔解释了他为何一改自己在2019年更欢迎此类药物的立场,当时他曾表示,FDA可能会考虑批准仅在中国试验的检查点抑制剂。
“在过去的两三年里,这个国家经历了巨大的社会变革,”他在会上表示。“我们明确听到了各类患者群体的声音,那就是想要看到和自己一样的面孔。”他说,这对建立公众对临床试验和被试验药物的信心也很重要。
他说,仅在中国进行试验的药物是“一种倒退”。
在美国临床试验中纳入能反映不同族裔和种族的多样化患者群体和解决健康状况差异的问题上,该机构面临着相当大的压力。
礼来发布声明表达了失望,并称公司原本“希望信迪利单抗能依靠有竞争力的定价策略,为患者和美国医疗系统带来积极影响”。
但该公司表示,“我们承认,形势已经发生了巨大变化,”而礼来“完全认同伦理在临床试验过程和临床试验多样性中的重要性。”
该公司称“将会配合FDA开展下一步工作”。
礼来将该药物提交美方审批的决定也引发了争议。FDA对该药物在中国试验结果的分析报告对于方法的要求非常严苛。报告指出,试验未能向对照组患者提供获得批准的标准疗法;对一些此前没有此类试验经验的调查员的能力表示了怀疑;提到了受试患者群体比美国肺癌患者群体更年轻、男性更多、吸烟者更少;还对一个并不总是可靠的临床试验终点的使用提出了批评。
礼来在推广该药物的应用时曾表示,希望信迪利单抗能成为打破癌症免疫治疗天价的利器。
市面上已经有了另外几种检查点抑制剂,这些药物通过阻断蛋白来攻克癌症,肿瘤会利用这种蛋白形成防护,以免受免疫系统的攻击。这类免疫治疗药物可被用于结肠癌、乳腺癌、肝癌和肺癌等癌症,价格几乎一样——每位患者每年平均要花费大约15万美元。
礼来表示,如果该公司研发的药物获得批准,价格将降低40%。在中国使用信迪利单抗一年的费用为6000美元(约合3.8万人民币)。
生物科技行业投资人布拉德·隆卡尔表示,礼来想要打破此类药物价格锁定是“非同小可”的想法。
“据我所知,没有任何一家公司,尤其是像礼来这种规模和信誉的公司,会宣称这样的折扣价就是他们计划的创新方式,”隆卡尔说道。
他还表示,现在,该药物的审批基本不会通过“意味着美国拒绝了大幅降低药价的实际选择”。(FDA通常会遵循其顾问委员会的建议。)
其他人则没有被礼来声称自己是市场颠覆者的主张说服。

若能获批,该药物将由礼来制药负责在美国的销售,并将与化疗一起被用于转移性非小细胞肺癌患者的治疗。 MIKE SEGAR/REUTERS
西雅图福瑞德·哈金森癌症中心的健康经济学家和癌症专家斯科特·拉姆齐就是对礼来的动机持怀疑态度的人之一。“得了吧,”他评价道。
“他们是在谈论他们目前的药物对价格造成的束缚吗?”拉姆齐问道。“也许他们可以考虑给这些药品降价40%”——标价为每月13400.32美元至15075.36美元的胃癌药物欣锐择(Cyramza)和同价位的乳腺癌药物唯择(Verzenio)。
拉姆齐谈到礼来的价格颠覆时说:“我不相信这种说法。”他将其归结为公关噱头。
众所周知,FDA在评估药物是否应获批时是不允许考虑价格的。这意味着任何FDA决定必须完全基于药物是否符合其标准。
出于这个原因,哈佛大学陈曾熙公共卫生学院医学教授、医药行业专家亚伦·凯塞尔海姆感到困惑。
他说:“我没听说过任何公司会在AdComm会议之前宣布其定价策略,尤其是当普遍认为FDA会说数据似乎不支持批准。“AdComm指的是该机构的咨询委员会小组。“这似乎是一种策略,旨在为AdComm的审议注入不应该考虑的考虑因素。”
信替利单抗的故事可以追溯到2019年美国癌症研究协会年会。帕兹杜尔在那里发表讲话说,该机构愿意考虑仅在其他国家试验过的药物。
礼来曾表示不打算在中国以外销售信替利单抗,该公司在会议上表示,它后来决定试试该药能否在美国获得批准。2020年,礼来与该机构三次会面,并着手申请销售许可。
然而,在随后的几年里,帕兹杜尔表达了越来越多的担忧,即大大小小的公司似乎都急于将检查点阻断剂推向市场。
12月,在《新英格兰医学杂志》上,帕兹杜尔博士指出,超过2000个检查点阻断剂的临床试验正在进行中,其中许多试验在中国进行。
帕兹杜尔补充说:“检查点阻断剂的肆无忌惮的快速增长导致了药物开发的狂欢,这里有大量商业赞助商、临床试验和过剩的开发计划。”
“每家大公司甚至小公司都有检查点阻断剂,”休斯顿M·D·安德森癌症中心的统计学教授和癌症临床试验专家唐纳德·贝瑞说。他还说:“令人惊讶的是,做这些东西是多么容易。”
帕兹杜尔在2月4日发表在《柳叶刀肿瘤学》杂志上的一篇文章中写道,“至少有25份来自中国的申请处于药物开发、计划提交或正在审批阶段。”
该机构长期以来对批准仅在海外试验的药物有严格的规定,要求数据适用于美国的患者和医疗实践,研究人员具有“公认的能力”,并且该机构能够验证数据。
FDA指派进行分析的工作人员严厉批评了礼来提交的这项来自中国的新试验,说信迪利单抗的应用在每个方面都达不到要求。其中一个问题是如何评估这种药物。该研究探索了多久后癌症会复发或患者死亡,即无进展生存期。帕兹杜尔在会议上说,这样的治疗目标对于此类研究来说已经过时了。相反,他建议,适当的目标是他们能活多久,这是对患者最重要的。
“有一个关于阿瓦斯汀(Avastin)治疗转移性乳腺癌的著名故事,”贝瑞说。“治疗显示出对无进展生存期的巨大益处,但进一步的研究显示它对总生存期无益。”
几年前,无进展生存期可能更容易被接受,但帕兹杜尔说,现在已经不再是这样了,这是“情况发生了变化”的另一个例子。为了让礼来的药物获得批准,专家组投票建议要求另一项适用于美国患者的试验。
但南加州大学医学副教授豪尔赫·涅瓦是唯一持不同意见的专家组成员,他说没有证据表明数据不可靠,而且判断市场上的药物是否太多也不是专家组的工作。
“我认为,让更多的药物竞争同样的患者,这对公平性的影响比高于其对临床试验注册所需的多样性的影响,我认为这很重要,”涅瓦说。
但帕兹杜尔的观点占据了主导地位,或许暗示了更多的政策变化。
他说:“对于从国际试验中想要获得什么,我们的看法发生了变化。”迄今为止,中国很少参与这样的试验。
“我们想让中国参与进来,”帕兹杜尔说。“我们觉得我们都会受益。”

