市场分析指出,此次港股抗疫概念股集体“暴跌”与新冠肺炎治疗药物取得重大进展有关。上周五(当地时间10月1日),美国默沙东和Ridgeback生物技术公司宣布,双方合作开发的在研抗病毒口服药物Molnupiravir在对轻度或中度新冠肺炎患者开展的三期研究中,获得积极的期中分析结果,与安慰剂相比,降低了患者住院或死亡的风险约50%。默沙东计划尽快在美国寻求紧急使用授权,并向全球监管机构提交申请。如果获得授权,Molnupiravir有望成为首款治疗新冠肺炎的抗病毒口服药物。
据业内人士此前对21世纪经济报道介绍,Molnupiravir是一种小分子药物,相比目前已获紧急使用授权的新冠抗体药物,小分子药物在价格和生产上更有优势,更具可及性和可负担性。单抗药物的生产成本比小分子药物要高很多,需要依赖生物制药方法生成,耗时耗材。
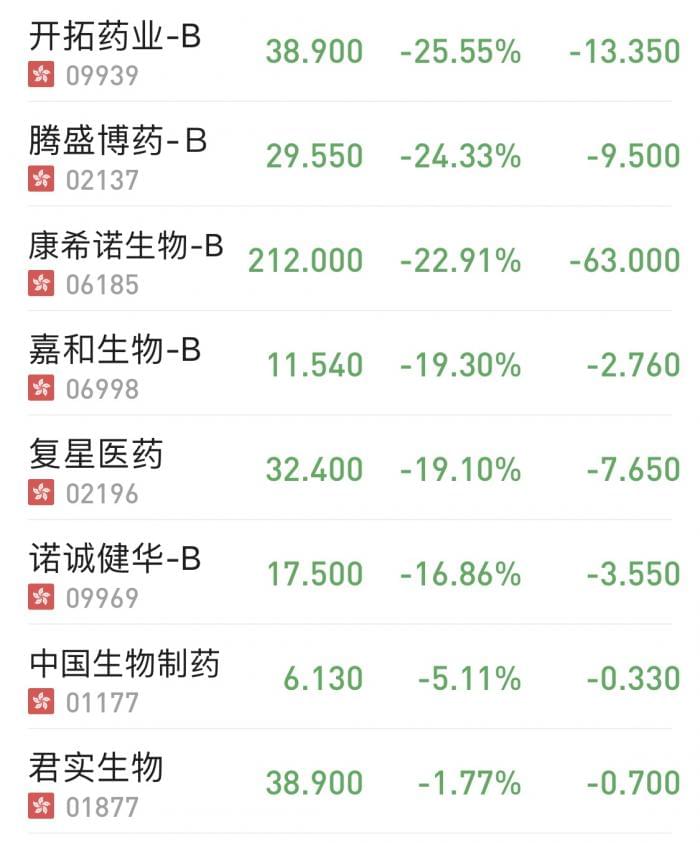
因此,一旦默沙东新冠口服药物率先获批紧急使用授权,将对其它在研的新冠口服药、新冠抗体药物以及新冠疫苗产生不利影响。在此次跌幅居前的抗疫概念股中,开拓药业在研新冠口服药物目前已进入全球多中心三期临床试验阶段;腾盛博药在研的新冠中和抗体疗法也进入了国际三期临床试验阶段,并取得积极结果;而康希诺生物和复星医药均属新冠疫苗概念。此外,虽然君实生物也有新冠中和抗体药物,但是其已在全球多个主要市场获批应用,并且获得了欧美的采购订单。
默沙东口服药对所有新冠变异毒株有效
从目前的进展来看,默沙东这款口服抗病毒药有望成为全球首个获批应用的抗新冠病毒口服药物。
据此次默沙东披露的数据,具体来看,在对有暴露风险的、轻度至中度新冠肺炎非住院成年患者开展的MOVe OUT临床试验的计划内期中分析中,Molnupiravir显著降低了住院或死亡的风险。在该期中分析中,Molnupiravir将住院或死亡的风险降低了约50%;接受Molnupiravir治疗的患者中,有7.3%的患者在随机入组后至第29天期间住院或死亡(28/385),而接受安慰剂的患者的这一比例为14.1%(53/377);P值为0.0012。截至第29天,接受Molnupiravir治疗的患者没有死亡报告,而接受安慰剂的患者有8例死亡。
美国国家过敏症和传染病研究所所长安东尼·福奇(Anthony Fauci)指出,在Molnupiravir的临床试验中,安慰剂组有8人死亡,而服用该药的患者中无人死亡。“这一数据令人印象深刻,所以我们真的很期待这一药物的应用,并期待它对感染者产生的积极影响。”
MOVe-OUT是一项全球多中心、随机、双盲、安慰剂对照的3期临床试验研究,受试者为实验室确诊的轻度至中度新冠肺炎非住院成年患者,至少具有一项疾病预后不良相关的风险因素,并且在随机入组前5天内出现症状。MOVe-OUT的主要疗效终点是通过对比Molnupiravir组与安慰剂组从随机分组至第29天期间住院和/或死亡的受试者百分比来评估Molnupiravir的疗效。
研究显示,Molnupiravir的疗效不受症状出现时间或患者潜在风险因素的影响。它还被证明在治疗所有变异毒株中始终有效,包括广泛流行和高度传播的Delta变异毒株。据默沙东透露,截至目前,Delta、Gamma和Mu变体已占到该试验中可评估病例的近80%。拉丁美洲、欧洲和非洲的招募人员分别占研究人群的55%、23%和15%。
据悉,3期临床试验的MOVe-OUT部分在全球范围内开展,包括阿根廷、巴西、加拿大、智利、哥伦比亚、埃及、法国、德国、危地马拉、以色列、意大利、日本、墨西哥、菲律宾、波兰、俄罗斯、南非、西班牙、瑞典、中国台湾、乌克兰、英国和美国等国家和地区的170多个计划地点。
新冠口服药“绝对不会”取代疫苗
默沙东表示,计划尽快在美国寻求紧急使用授权,并向全球监管机构提交申请。
福奇表示,美国食品和药物管理局(FDA)将“尽可能快地”审查默沙东和Ridgeback生物治疗公司的新型抗病毒药物的数据,并批准紧急使用授权。
福奇强调,“大家必须确保给FDA时间,令他们可以非常仔细地审查数据,并做出紧急使用授权的决定。我不能预测FDA何时会做出决定,但我可以告诉你一件事:他们会尽快行动。”
当被问及Molnupiravir最终是否会专门用于未接种疫苗的人群时,福奇表示,他希望避免在FDA做出最终决定之前进行猜测。完全接种疫苗的人仍然可能感染新冠病毒,特别是在疫苗效力减弱的情况下,但疫苗仍能对重症和死亡保持高度的保护。
福奇警告称,美国人不应该因为认为可以服用特效药而不接种疫苗。默沙东这种药物“绝对不会”替代新冠疫苗,但他补充道,该药物在未来的实施前景广阔。
白宫新冠病毒响应协调员Jeff Zients补充道,这种新冠口服药最好的使用方式是作为疫苗的补充,而不是替代疫苗。“接种疫苗仍然是应对疫情的最佳工具。”
一旦FDA批准紧急使用授权,Molnupiravir将成为首个对抗新冠病毒的口服抗病毒药物。今年年初,默沙东与美国政府达成了一项采购协议,根据该协议,在Molnupiravir获得美国FDA的紧急使用授权或上市批准后,默沙东将向美国政府供应约170万个疗程。
Zients在10月1日的新闻发布会上透露,如果药物获得批准,政府可以选择购买更多剂量的药物。
默沙东承诺,如果Molnupiravir获得授权或批准,将及时在全球范围内供应Molnupiravir,并计划根据世界银行的国家收入标准实行分级定价方法,这一标准将反映各个国家为应对这场大流行病向公共卫生提供资金的相对能力。
作为其承诺将广泛向全球供应的一部分,默沙东此前宣布,公司已经与成熟的仿制药制造商签订了Molnupiravir的非独家自愿许可协议,以便在100多个中低等收入国家(LMIC)获得上市批准或紧急使用授权后加快Molnupiravir的供应。
此外,默沙东已经与全球多个国家政府签订了Molnupiravir的供应和购买协议,等待监管部门的授权,目前正在与多个国家政府进行磋商。
据报道,日本政府也正在商讨购买默沙东公司的新冠药物。日本厚生劳动省正就购买默沙东公司的抗病毒药物Molnupiravir进行谈判,希望能在今年内批准其使用。如果默沙东公司申请该药物在日本使用,日本厚生劳动省将考虑快速批准。

