出品丨虎嗅医疗组
作者丨苏北佛楼蜜
题图丨东方IC
你的肠子和肠道里的细菌,或许比你想象的更重要。
科学家发现,药物是否有效、效果如何似乎不是一个确定问题,它受到人类肠子内的细菌影响。
近日,刊登在《自然》杂志上的一项实验室研究发现,肠道细菌可以积累常见的药物,这可能会改变细菌的功能和活动,降低药物的有效性。
大脑和肠子,真的有联系
“One apple a day,keep the doctor away”,这句已流传数百年的西方著名谚语早已拥有了科学注解。
2015年7月Nutrients发表的一项研究证明,苹果预防心血管疾病与肠道菌群分不开。实际上肠道菌群并非新名词,早在17世纪中后期,被誉为微生物学之父的Antoni van Leeuwenhoek首次在从不刷牙老人的牙垢里发现了微生物,他甚至还用自己的粪便进行细菌研究。此后,越来越多关于肠道菌群的研究不断展开。
直到2008年,全球启动人类基因组计划,对人体内所有共生的微生物群落进行测序和功能分析。肠道菌群成为了广袤而又神秘的新大陆,关于肠道菌群与一系列疾病,如糖尿病、肥胖、类风湿性关节炎、炎症性病等的关系逐渐陆续被探明发现,神秘的面纱正在被渐渐揭开。
人类微生物组由100万亿个细菌、病毒和真菌组成,主要居住在人类肠道内。微生物组在人类生活中起着至关重要的作用。例如,提供免疫力,免受有害微生物的侵害,产生能量(短链脂肪酸)、合成维生素,更重要的是,肠道菌群似乎能够调节中枢神经系统,影响人的大脑甚至是部分神经系统疾病的诱因,下面这场图并非全部在玩梗,拥有科学依据,科学将这些联系称为“脑肠轴”。
由于参与调控肠和脑的活动,肠道细菌失调可能导致肠-脑疾病,人类常见的肠-脑疾病包括肠易激综合征(IBS)、炎性肠道疾病(IBD)和肝性脑病 (HE)。 这类疾病不仅具有明显的肠道症状(如排便异常、消化不良、腹痛、腹胀和肠道炎症等),同时还伴有焦虑、抑郁和认知功能减退等神经精神症状。
已有大量的研究发现,肠-脑疾病患者的肠道菌群发生了显著改变,且肠道菌群失调会导致动物出现类似于人类的肠。此外,肠道菌群失调还可能导致中枢神经系统(CNS),如多发性硬化症、精神分裂、 慢性疲劳综合征、阿尔兹海默症和帕金森症等。
因此,对于肠道菌群失调导致的心理和精神异常,调节和恢复正常肠道菌群的疗法可能更直接和安全有效。
不仅如此,肠道细菌产生了人体中大约95%的血清素,血清素是大脑中的一种神经递质,可调节情绪和胃肠道(GI)功能。环境因素可能诱发微生物组的变化,作为对饮食、抗生素或疾病的反应。非抗生素药物也可以改变肠道微生物组的组成和功能。
肠道微生物组可以影响一个人对某种药物的反应,可以改变药物在体内的活性、毒性或生物利用度,也就是药物进入血液的程度和速度。
对小鼠的初步研究表明,一些抗抑郁药,如度洛西汀,通过增加人类的血清素和去甲肾上腺素水平来治疗抑郁症和焦虑症,也可能改变肠道微生物组的来源,科学家们还不了解度洛西汀对人类微生物组的影响。
这启发了一项由英国剑桥大学医学研究委员会(MRC)毒理学组和德国欧洲分子生物学实验室的研究人员领导的研究,以研究肠道细菌和药物之间相互作用背后的潜在机制。
科学家们将25种常见的肠道细菌与总共15种药物进行培养,以三种药物作为对照组,并在375个不同的“细菌-药物”配对组中研究它们的相互作用,研究人员发现了29种以前未知的相互作用,涉及18种细菌和7种药物。
新的机制
在29种新的“细菌-药物”相互作用中,有17种是由细菌储存药物造成的,科学家称之为生物积累,有12种是由细菌对药物的改造、或生物转化造成的。
研究人员利用核磁共振和液相色谱质谱法,进一步证实了度洛西汀在四种肠道细菌中的生物累积作用。
MRC毒理学组的特约作者和调查员Kiran Patil博士在接受海外媒体Medical News Today采访时阐述道,“药物和肠道细菌之间关系的重要性以前就已经被认识到了,但分子机制并不完全清楚,大部分的重点是药物分子是否被化学修饰--一个叫做生物转化的过程”。
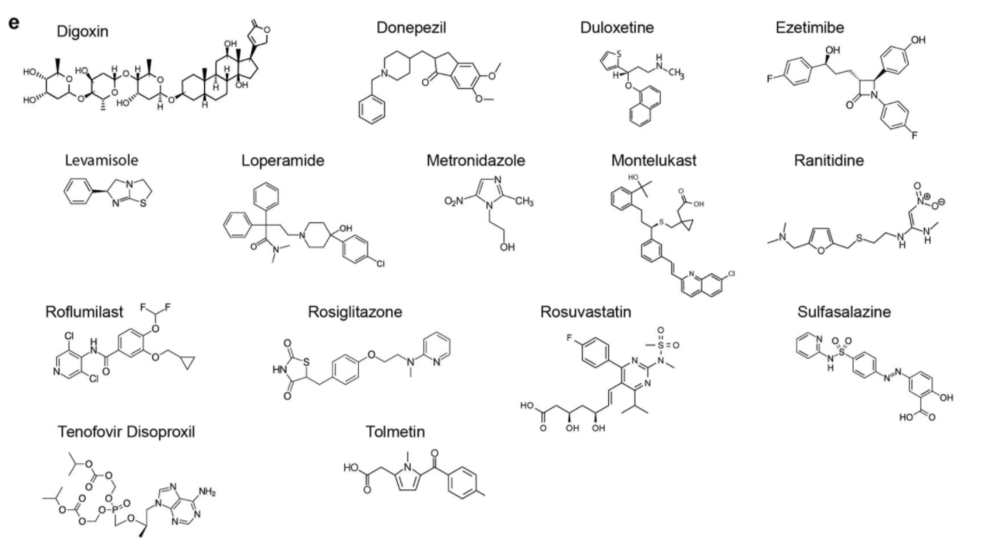
“我们发现,一些常用的药物,包括抗抑郁药,不经化学修饰就被肠道细菌生物累积,选择度洛西汀是由于它会产生与消化道相关的副作用,如体重增加等问题”。
该研究的作者发现,度洛西汀与细菌中的代谢酶结合,改变了它们的代谢产物。研究人员用度洛西汀培养了五种肠道细菌,以评估这些与生物蓄积有关的代谢变化是否会导致社区肠道细菌组成的变化,并观察到,度洛西汀会利用“积累吸纳大量度洛西汀”的细菌所产生代谢物,这一过程极大地改变了细菌群落的组成,其他细菌以这些“药物-细菌”的代谢物为食,导致了肠道细菌群落的额外变化,这影响了患者对药物的有效利用和吸收。
研究人员随后检查了积累度洛西汀的细菌与那些没有积累度洛西汀的细菌对“秀丽隐杆线虫”的影响,它是一种用于研究肠道细菌的线虫。科学家发现,与没有积累的细菌相比,积累了度洛西汀的细菌改变了线虫的行为。
这些发现的临床意义尚不清楚,需要进行人体研究,根据肠道微生物组的组成来评估和分类药物反应,从而有可能实现个体化和优化药物治疗。
未来的某一天,我们或许可以通过采集粪便中的细菌,洞悉肠道内的微生物环境,给每个人制定相应的药方,来让药物最大化的被人体利用。在中秋假期到来的第一天,在阅读这篇科学研究后,也希望你在大快朵颐中善待自己的胃肠。
我是本文作者苏北佛楼蜜,人类最后的严肃都该留给生物技术。珍惜所有与你沟通的机会,微信:Pinkfloyddddd,欢迎您来。

