图片来源:pixabay
昨日,《自然·医学》发表的一篇论文对南非新冠肺炎大流行前6个月中分离得到的1300多个新冠病毒近全基因组进行了分析,发现了16个新的病毒变异体。其中3个变异体在南非的第一波疫情中广泛传播,引发了当时南非全国约42%的感染。新发现的C系变种C.1则是截至2020年8月底在南非地理分布最广泛的种类。
撰文丨杨心舟
南非在去年3月5日报告了首例新冠病毒感染病例,仅隔了不到半个月,南非就宣布了封城措施,尽管从当时的反应来看,南非的应对措施算得上迅速,但截至去年11月,南非的累计确诊人数已经超过了78.5万。为了找到前期南非新冠病毒的传播演化途径,南非夸祖鲁-纳塔尔大学的研究人员再次回溯分析了南非实验室基因监测网络(Network Genomic Surveillence)中上传的基因序列。
而南非最近引起关注的突变体501.V2也是基于这个监测网络分析得到的。目前,官方认为,501.V2突变体在南非第二波疫情中占据了主导地位,科学界对该突变体的出现都表示出担忧,原因在于其会引起免疫逃逸,从而可能降低疫苗有效性。
但实际上,南非第一波疫情可能更加复杂,《自然·医学》的新研究报告了南非在第二波疫情之前出现过的一系列突变体,在去年3月至8月间的近全基因组分析中,一共有16种新的突变体浮出水面。其中三种突变体B.1.1.54、B.1.1.54和C.1在第一波疫情中传播广泛,引发了当时南非约42%的感染。按照当下新冠病毒的系统谱系,谱系A主要指的是在亚洲流行,传播至其他地区的病毒分支,而谱系B则是主要在欧洲地区流行,并传播到其他地区的病毒分支。而此次南非发现的谱系C,则被认为是从B.1.1.1演化而来,并在南非特异性传播的变异体。
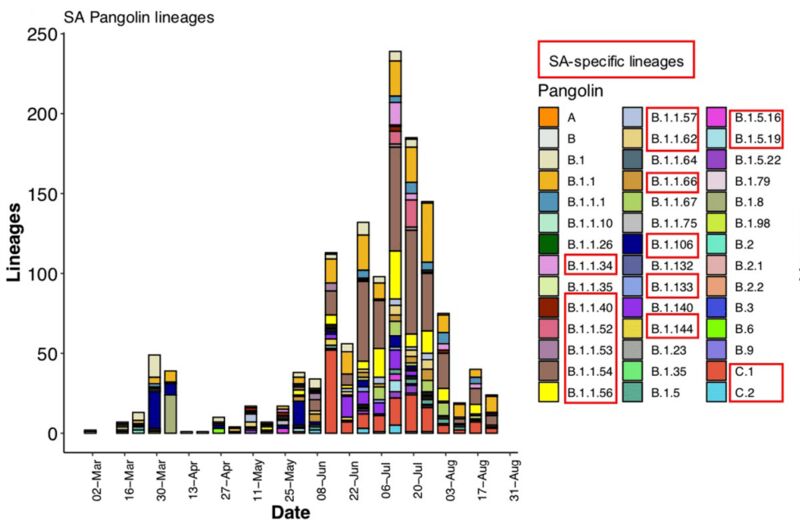
红框中为南非发现的新变异体。图片来源论文。
研究按照南非当地的管控措施流程回溯了去年的流行病学阶段,第一阶段主要包括旅行者相关的早期传播事件,第二阶段则是传播高峰过程。在这两个阶段中,有效再生数Re(单个患者的平均传染人数)仍然是判断新冠病毒传播力的标准,Re>1则代表流行病增长期。其中,比较标志性的是南非首例病例出现后到3月中旬,期间Re>3;而当封城措施提出后,Re迅速降至1以下;4月,南非开始出现局域性的暴发事件,包括一些医院感染,Re重新回到1以上;直到8月之后,Re重新回落到1以下,这也符合第一波疫情结束的时间点。
在这种Re不断变化的时间段中,新冠病毒样本也在源源不断地被收集,这些样本的基因序列都上传到了南非实验室基因监测网络中。之前报告的501.V2突变体来自于监测系统中, 10月15日至11月25日之间夸祖鲁-纳塔尔省、东开普省和西开普省的190个基因组序列分析结果。
而《自然·医学》此次主要分析了去年3月6日到8月26日之间的数据,其中研究重点关注了16种突变体中的3种:C.1、B.1.1.54和B.1.1.56,这3个突变体在封城期间以及后续大规模传播事件中有着重要影响。
根据研究后续开展的地理谱系模型,这3种突变体出现在去年2月15日~5月24日之间。其中B.1.1.56预估在3月中旬出现在南非夸祖鲁-纳塔尔省(KZN)的德班,从6月开始,这一突变株就迅速地在KZN省的各个地区传播,这一点与南非将封锁等级下降的时间是密切相关的。
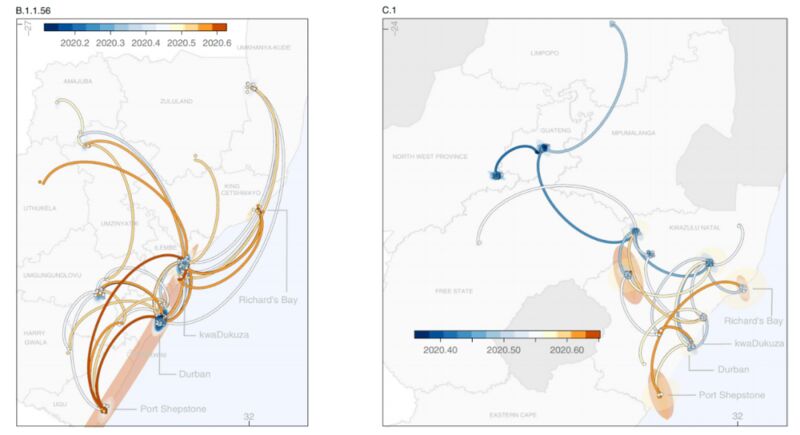
B.1.1.56和C.1的时空传播路线。图片来源论文
C.1突变体可能出现在去年5月初,流行于豪登省的约翰内斯堡,这一病毒株迅速地传播到了临近的西北省,并造成了大型的医院暴发;C.1突变体还以两次独立事件分别传播到了林波波省和KZN省的西北部。
模型并未能展示B.1.1.54突变体的传播模式,但研究分析应该是KZN省和豪登省最先采集到了该突变体,并且其随后在KZN省、西北省和自由州省传播开来。
与中国公布的在武汉流行的病毒序列相比,C.1病毒株大约有16处突变,B.1.1.54和B.1.1.56则大约有13~14处突变位点。根据突变位点,三个病毒株都有共同的父系B.1.1。B.1.1带有D614G突变,曾经最早出现在欧洲,在去年下半年传播比例猛增,已经占据了全球公布的病毒株测序序列的绝大部分。
B.1.1.54的重要突变位点则还包括非结构蛋白NSP8突变,类似的,B.1.1.56则有NSP3突变。另外,C.1和B.1.1.56的刺突蛋白基因上都出现了两个高频突变位点,但这两个位点突变属于同义突变(不会改变氨基酸),这一点与当下重点关注的501Y.V2突变体有着本质区别。另外,这几个主要的突变病毒株的刺突蛋白基因区域,还有频率非常低的3个非同义突变(A688V、G769V、A1078S),大约只有1.2%~3.6%。研究认为,刺突蛋白维持原样,南非流行的新冠病毒在第一波疫情中算是保持了演化稳定性。
为了探究病毒的传播效力,研究以循环阈值作为了病毒载量的近似判断标准,循环阈值是实时荧光定量多聚核苷酸链式反应中的一个重要参数,由它可以绘制出标准曲线,进而判断模板(研究参考的便是新冠病毒)的起始拷贝数。
从循环阈值数来看,3种突变病毒株并没有与其他谱系病毒有明显的差异,这说明这3种突变病毒很有可能是一些偶发的暴发性事件快速传播开来的,而并非是这3种突变体获得了额外的演化优势。
就南非的情况来说,这种暴发很可能来自多次发生的医院感染事件。包括去年4月在西北省的医院感染促成了C.1病毒株的扩增。实际上,KZN省4月的医院感染还促成了另一种突变体B.1.106的暴发性传播,但这一病毒株在医院感染事件得到控制以后已经消失了。
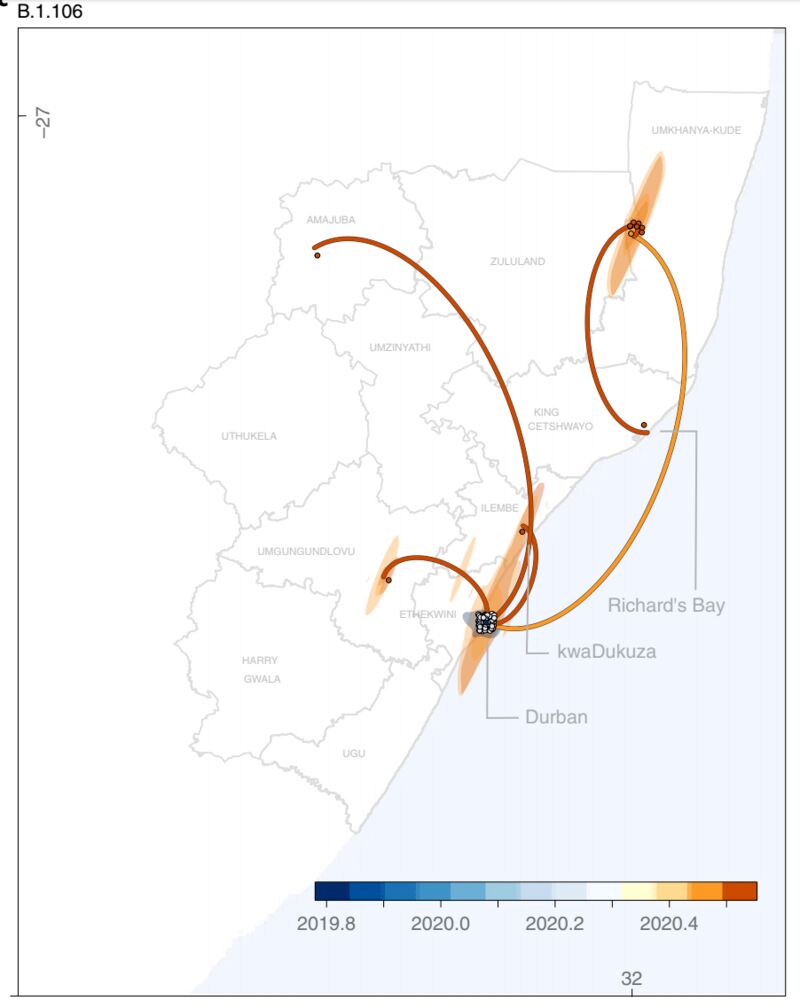
B.1.106曾随着医院感染传播过一段时间,但在管控过后已经消失。图片来源论文。
目前,这项研究来还无法判断传播很窄的刺突蛋白突变是否会给病毒带来生存优势,例如增加传播力、病毒复制力等。但值得警醒的是,如此多的变异体在一个地区传播,又随着人群流动再次带去新地区,很可能会引起有限的免疫交叉反应,最终导致抗体依赖增强效应(ADE)。
这种情况在登革热病毒感染中就有出现,当一个已经感染过登革热的病人,第二次感染了不同株的登革热病毒后,第一次感染产生的抗体会结合新毒株,但不会有中和效应,甚至还能增强新病毒的感染性过程。研究指出,如果新冠病毒持续传播,新旧变异体不断在一个地区停留,很有可能也会导致ADE,使得疫苗作用大打折扣。
原始论文:
Sixteen novel lineages of SARS-CoV-2 in South Africa
https://www.nature.com/articles/s41591-021-01255-3#ethics

