道阻且长的药物研发
阿尔茨海默病(Alzheimer’s disease,AD)作为最常见的一种痴呆,正迅速成为全球性的公共卫生挑战。据统计,目前全球约有四千万人受到AD的困扰,预计到2050年,这一数字将激增至1.52亿。随着患者数量的增加,记忆力和认知功能的逐步衰退不仅对患者及其家庭构成重大影响,而且对整个社会经济也带来了沉重的负担。
面对AD的肆虐,医学界也在努力寻找对策。过去几十年间,科学家在AD发病机理的认识上取得了长足进展,先后提出了以β-淀粉样蛋白(Aβ)、Tau蛋白等为靶点的多种假说,一些有前景的药物也陆续进入临床试验。然而,到目前为止,获批上市的药物寥寥无几,且多为症状改善性质,尚无一种能够真正治愈AD的药物问世。
目前风头正盛的单抗药物中,2022年上市的Aduhelm由于效果争议与安全隐患,目前已被开发商渤健和卫材渐渐抛弃;2023年获批的Leqembi能使早期AD患者18个月内的认知下降减缓27%,但受限于高昂的价格与有限的保险范围,到2026年,预计全球也仅有39.8万名患者有资格接受治疗。
与高血压患者服用降压药即可控制病情不同,仅靠服用几粒药丸就能治愈AD的美好愿景,目前看来尚未成为现实。然而,我们是否还有其他选择?近年来,一种全新的非药物疗法悄然走进了人们的视野——40Hz声光刺激疗法。这一疗法治疗机制独特、操作简便,在动物实验和初步临床试验中初显成效,或许能为攻克AD带来新的曙光。
另辟蹊径的40Hz声光刺激
我们的大脑包含约860亿神经元,它们就像一只庞大的交响乐团一样通力合作,共同实现复杂的认知功能。正如乐团成员需要配合他人的演奏和指挥的协调,神经元之间也通过电信号互相传递信息。当乐团演奏时,各种乐器会按照一定的节奏和旋律协同工作,产生和谐悦耳的乐章;而在我们的大脑中,大量神经元的同步放电也会形成特定节律的振荡,我们称之为“神经振荡”。
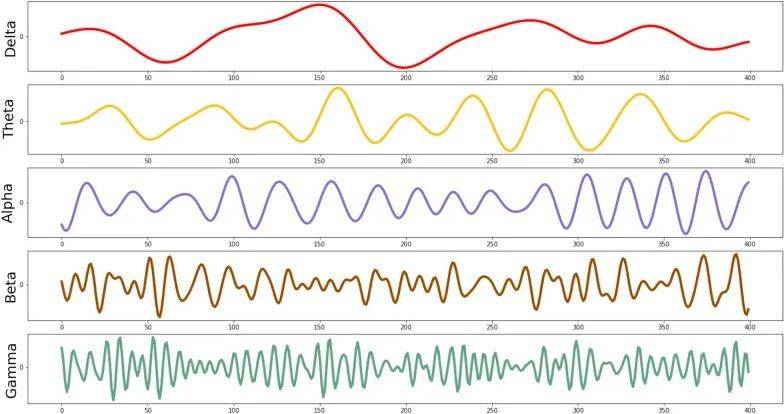
▷不同波段的神经震荡。图源:Pandey, Pankaj, Richa Tripathi, and Krishna Prasad Miyapuram. "Classifying oscillatory brain activity associated with Indian Rasa s using network metrics." Brain Informatics 9.1 (2022): 15.
就像乐曲有高低不同的音调,神经振荡也有快慢不等的频率。根据频率的不同,研究人员将其划分为δ(1-4Hz)、θ(4-8Hz)、α(8-12Hz)、β(12-30Hz)和γ(30-100Hz)等频段。每个频段的振荡都与特定的脑功能相关。例如,α波出现在清醒放松时,而γ波则参与感知、记忆、注意等高级认知活动。
如果把γ振荡比作乐队演奏的高潮乐章,那么在AD患者的大脑中,这一乐章就变得支离破碎,难以成曲了。脑电图和脑磁图研究发现,AD患者和动物模型脑中γ振荡明显减弱,神经元的同步放电能力下降。这种异常扰乱了大脑不同区域间的信息传递和整合,在AD的病程发展中可能扮演着重要的角色。
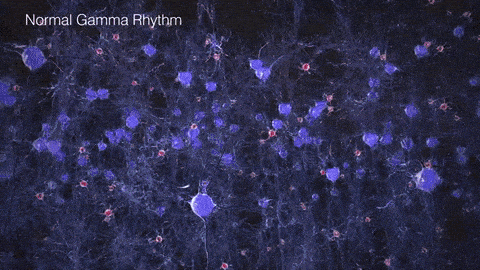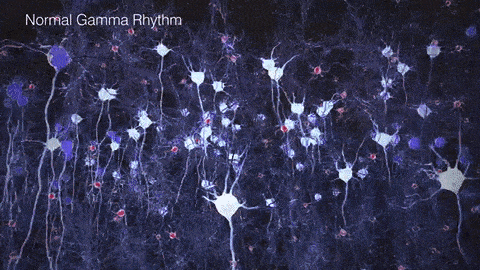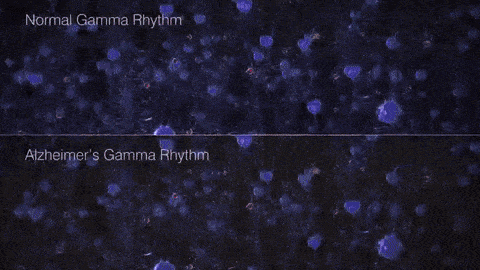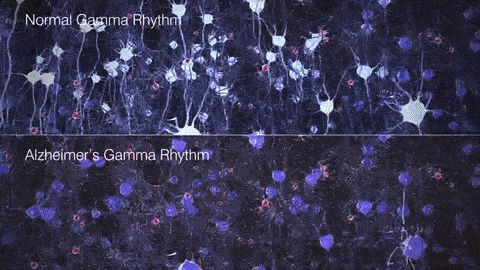
▷健康人与AD患者脑中的γ节律差异。图源:https://brainhealth.org.uk/?p=624
那么,我们能否通过某种方法,恢复AD患者大脑中失常的γ振荡,让神经元重新打起节拍,奏响和谐的乐章呢?答案或许非常简单,从外部施加一个40Hz的刺激就能奏效!
2016年,麻省理工学院蔡立慧教授团队在权威杂志《自然》上发表了一项开创性研究,首次揭示了40Hz光刺激治疗AD小鼠的显著疗效。这一发现,源于对AD小鼠模型的研究,这些小鼠虽然尚未形成明显的淀粉样斑块,但已经出现了明显的γ节律紊乱。而γ振荡恰恰与感知、学习、记忆等高级认知功能密切相关。
为探究γ节律与AD病理的关系,研究人员用光遗传技术激活小鼠大脑内的一类关键中间神经元。当这些神经元以40Hz频率被刺激时,小鼠脑中致病淀粉样蛋白Aβ显著减少,而其他频率无此效应。深入分析发现,40Hz刺激一方面抑制Aβ的产生,另一方面促进小胶质细胞对Aβ的吞噬清除。受刺激的小胶质细胞变得更加活跃,向斑块聚集发挥“清道夫”的功能。这表明γ节律的调控可通过双管齐下的机制改善AD。
光遗传是个神奇却伤脑筋的技术。它需要往脑中注射病毒,埋入光纤,目前只能用于动物实验,离临床应用还很远。但令人惊喜的是,科学家发现,改用40Hz频率的闪烁光从外部照射AD小鼠,哪怕只有1小时,就能使脑中Aβ水平下降近60%。而让小鼠连续7天每天接受1小时光照后,脑中的淀粉样斑块也明显减少。
光刺激可以抵抗AD,那声刺激呢?在2019年发表于《细胞》的论文中,他们进一步探索了听觉刺激的疗效。
研究发现,40Hz声刺激不仅能使AD小鼠听觉皮层的Aβ沉积减少,还能使海马和内侧前额叶等关键脑区的神经元活动与40Hz同步,从而在更大范围发挥治疗作用。小鼠在空间记忆和物体识别等认知任务中的表现也明显改善。
但当声和光结合,疗效达到新的高度。这种多感官刺激方案不仅能引起更强烈的免疫反应,还能使内侧前额叶的Aβ显著下降。全脑三维成像发现联合刺激能显著减少整个大脑皮层的斑块,还能降低过度磷酸化的tau蛋白水平。这些发现表明,40Hz声光刺激疗法的作用不局限于初级感觉区,而是能影响到海马、前额叶等学习记忆的关键枢纽,并从行为上改善AD小鼠的认知功能。
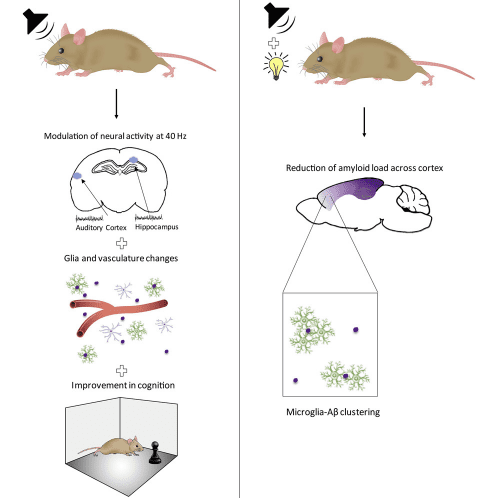
▷声光刺激治疗AD小鼠,图源:Martorell, Anthony J., et al. "Multi-sensory γ stimulation ameliorates Alzheimer’s-associated pathology and improves cognition." Cell 177.2 (2019): 256-271.
同年发表在《神经元》杂志上的另一项研究深入探讨了40Hz光刺激疗法的作用机制。研究人员发现,40Hz光刺激能在海马、视觉皮层、体感皮层、前额叶等其他脑区提升γ节律。此外,它能够减缓这些脑区神经元和突触的丢失,改善小鼠的空间学习和记忆能力。
分子水平的研究揭示了几种潜在的保护机制:在小胶质细胞中抑制促炎基因表达、减轻神经炎症;在神经元内上调与突触功能相关基因、增强突触可塑性并诱导神经保护因子产生;减少神经元DNA损伤、有助维持基因组稳定性。
值得注意的是,这种40Hz刺激不仅能调节阿尔茨海默病相关的病理改变,即使在正常老化小鼠中也能观察到类似的调节作用,这表明它能够普遍改善神经功能。
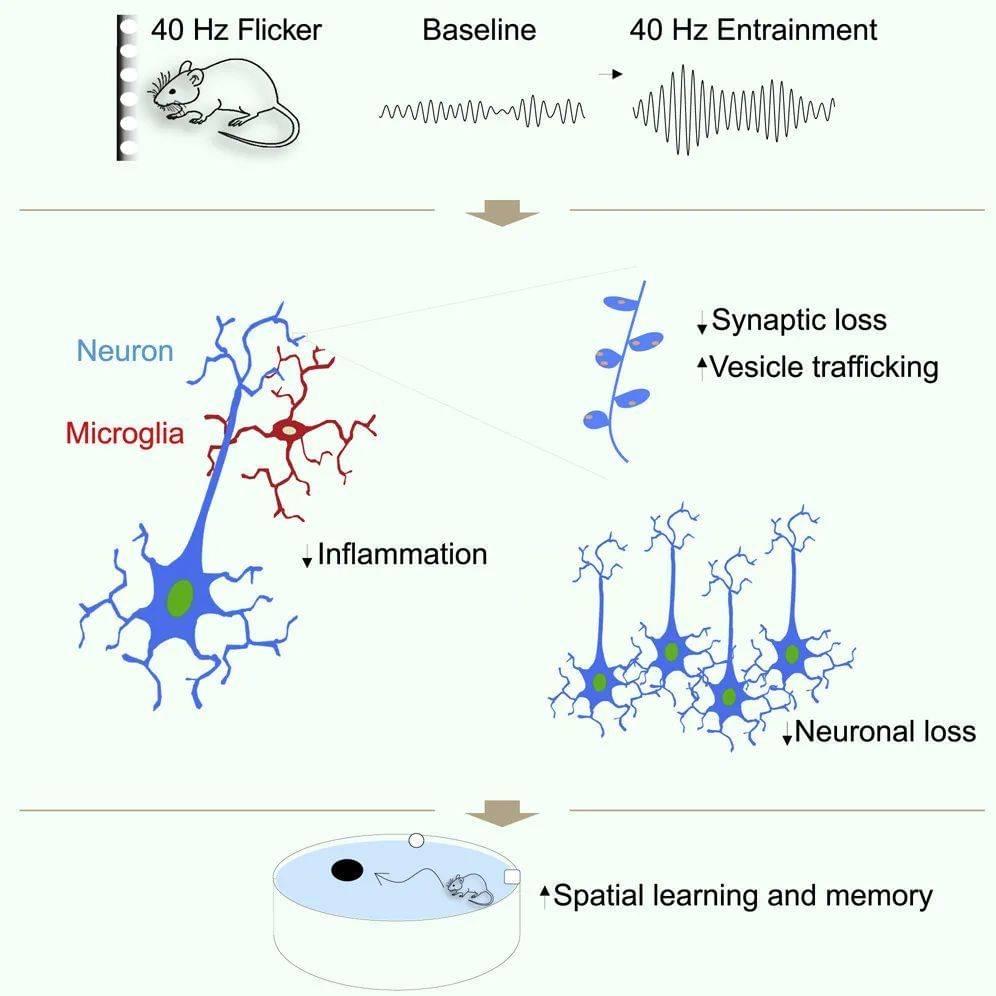
▷治疗机制。图源:Adaikkan, Chinnakkaruppan, et al. "γ entrainment binds higher-order brain regions and offers neuroprotection." Neuron 102.5 (2019): 929-943
来自其他团队的质疑
然而,就在学界为如此简单的疗法能产生惊人的疗效啧啧称奇时,2023年3月纽约大学的György Buzsáki团队发表于《自然-神经科学》的研究却给40Hz疗法来了一记“当头棒喝”。
他们在视觉皮层、内嗅皮层和海马等脑区记录了神经活动,却发现40Hz光刺激并没有诱发γ振荡,对深部脑区的影响也十分微弱。进一步的实验表明,AD小鼠似乎不喜欢并会主动回避40Hz闪烁光。
研究者接着考察了40Hz光刺激对AD病理的影响。然而他们使用了多种实验方法,都没有发现淀粉样斑块数量的变化,小胶质细胞的形态也无明显差异,Aβ40和Aβ42水平在治疗组和对照组间无统计学差异。尽管一些病理学指标有所改善,但并不稳定可靠。
40Hz声光刺激治疗AD就此无效了吗?答案也不尽然。影响生物实验结果的因素繁多,即使所有数据都真实可靠,关键实验步骤的差异、小鼠品系的不同、环境的细小改变都有可能导致实验结果相差甚远。
另外,该研究仅聚焦于大脑内的分子病理变化,而并未探讨40Hz疗法对认知功能的影响,后者显然更为关键。正如作者所言,们的结果不也应被视作反对其治疗AD的证据,对40Hz声光刺激疗法的开发仍需经过进一步的探索。
新研究再次登顶《自然》
面对质疑,蔡教授的团队于2024年3月再次在《自然》发表新的研究论文,为40Hz刺激疗法找到了新的治疗机制。
要保证大脑的正常运转,需要“垃圾清理系统”不断地将脑中的废物搬运出大脑。作为重要的“排污管道”之一,脑淋巴系统的正常运转依赖于脑脊液和间质液的无阻流动。而γ振荡的异常则可能会扰乱这一过程,加重AD。
新研究发现,40Hz声光刺激1小时就能够增加AD小鼠大脑皮层脑脊液流入和间质液流出,而这背后的推手则是星形胶质细胞上的关键蛋白AQP4。通过小分子TGN020抑制AQP4则会使脑脊液的内流减少,40Hz刺激对Aβ的清除作用也会减弱。相关结果在敲除掉AQP4蛋白对应基因的小鼠上得到了验证。进一步的研究表明,40Hz刺激是通过促进AQP4在细胞膜上的极化来加强脑脊液的流动。
此前的研究表明动脉搏动调控着脑脊液的流动,淋巴管则能将脑脊液引流出脑外,顺带将Aβ搬运出去。于是研究从这两个角度开展实验,发现40Hz声光刺激还会增强小鼠脑中的动脉搏动,扩大淋巴管管径,增强Aβ的清除作用。
那么,是谁在操盘这一切过程?进一步的实验表明,它们由分泌血管活性肠肽(VIP)的VIP中间神经元调控。前人已经发现,VIP通路参与了血管直径调控、星形胶质细胞代谢、水通道蛋白转运等多个生理过程。若在40Hz刺激前抑制VIP神经元,则Aβ的清除、AQP4极化与动脉搏动都会减弱。
这项工作系统阐释了一个崭新的机制:40Hz刺激通过γ节律促进了以VIP中间神经元为核心的神经-血管-胶质细胞环路的协同作用,加快了AQP4介导的脑脊液流动,从而带走了致病蛋白。这一过程涉及从基因表达到细胞功能再到组织水平的多层次调控,揭示了神经活动、脑脊液循环与AD病理之间的内在联系,是40Hz声光刺激能有效抵抗AD的又一例证。
如火如荼的临床转化
基于这些突破性发现,蔡立慧教授与合作者成立了Cognito Therapeutics公司,正式开启了将40Hz声光疗法从实验室推向临床的航程。
在2021年的阿尔茨海默病/帕金森病大会上,Cognito公布了一项多中心随机对照II期临床试验(NCT-03556280)结果。经过6个月的治疗,轻中度阿尔茨海默病患者对该公司研发的40Hz声光刺激设备Gamma Sense的耐受性良好。与安慰剂或假刺激组相比,治疗组患者的认知衰退减缓84%,日常生活能力下降减慢83%,相关脑萎缩也减少61%。
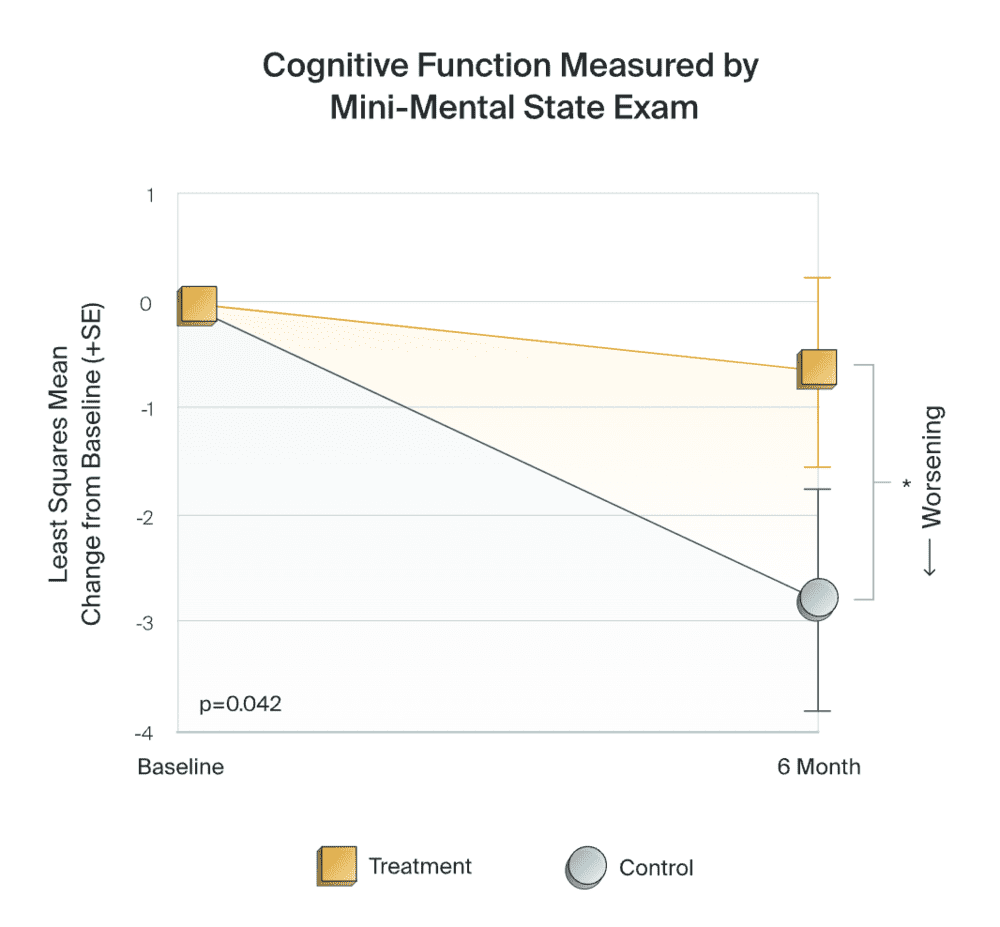
▷临床试验,减缓认知功能下降。
同年,Gamma Sense获得FDA突破性医疗器械认证。进一步的结果也发表在了2024年3月的《神经科学前沿》上。
II期试验初现成效后,III期临床试验也在紧锣密鼓地展开。III期实验预计招募超过500名患者,连续12个月每天接受声光治疗,预计2025年完成。
结语
毋庸置疑,40Hz声光刺激疗法具有独特的优势。与传统药物疗法相比,它通过调控神经振荡这一更上游的环节,在多个层面协同发挥神经保护作用,有望延缓阿尔茨海默病进程的多个环节。作为一种非侵入性物理疗法,它操作简便、安全性高,病人在家中即可自行完成治疗,将极大提高患者依从性并降低治疗成本。
当然,我们也必须清醒地认识到,这一疗法目前仍处于临床试验阶段,早期研究由于样本量小、随访期短等因素,其结论仍有局限性。如果III期临床试验能持续显示出良好疗效和长期安全性,再结合个体化的适应症筛选,40Hz声光刺激疗法就有望真正造福于广大患者,成为一种无创、安全、可负担的延缓AD进展的新手段。
值得指出的是,40Hz声光刺激疗法与现有药物疗法并不冲突,两者能够协同增效。我们可以展望这样的一个愿景:患者定期接受抗体药物注射,同时每天使用头戴式声光刺激设备,两种疗法相得益彰,药械结合,实现精准个体化治疗。
虽然前景光明,但临床转化之路仍任重道远。我们期待通过基础与临床研究的持续努力,能够进一步阐明治疗机制、评估长期使用的耐受性、确认疗效的持久性以及对不同人群的适用性等关键科学问题,让这一创新疗法真正开花结果,帮助人类抵抗AD这一猛兽。
参考文献
[1] https://www.who.int/news-room/fact-sheets/detail/dementia
[2] https://www.fiercepharma.com/pharma/eisai-dials-sales-ambitions-alzheimers-med-leqembi-amid-launch-growing-pains
[3] Stam, Cornelis J., et al. "Generalized synchronization of MEG recordings in Alzheimer’s disease: evidence for involvement of the γ band." Journal of Clinical Neurophysiology 19.6 (2002): 562-574.
[4] Iaccarino, Hannah F., et al. "γ frequency entrainment attenuates amyloid load and modifies microglia." Nature 540.7632 (2016): 230-235.
[5] Martorell, Anthony J., et al. "Multi-sensory γ stimulation ameliorates Alzheimer’s-associated pathology and improves cognition." Cell 177.2 (2019): 256-271.
[6] Adaikkan, Chinnakkaruppan, et al. "γ entrainment binds higher-order brain regions and offers neuroprotection." Neuron 102.5 (2019): 929-943.
[7] Soula, Marisol, et al. "Forty-hertz light stimulation does not entrain native γ oscillations in Alzheimer’s disease model mice." Nature neuroscience 26.4 (2023): 570-578.
[8] Murdock, Mitchell H., et al. "Multisensory γ stimulation promotes glymphatic clearance of amyloid." Nature (2024): 1-8.
[9] Jiang-Xie, Li-Feng, et al. "Neuronal dynamics direct cerebrospinal fluid perfusion and brain clearance." Nature (2024): 1-8.
[10] Chan, Diane, et al. "γ frequency sensory stimulation in mild probable Alzheimer’s dementia patients: Results of feasibility and pilot studies." PloS one 17.12 (2022): e0278412.
[11] https://www.wired.com/story/cognito-wearable-device-light-sound-treatment-alzheimers-dementia/
本文来自微信公众号:追问nextquestion (ID:gh_2414d982daee),作者:郑宸,编辑:存源

