对九名死于严重 COVID-19 的人进行的尸检显示,肺血管结构和血栓形成的变化模式截然不同。文章首次描述了由感染引起的内皮损伤和相关血栓现象的亚细胞方面。
文章指出,急性炎症对肺部微血管循环的影响是导致严重 COVID-19 的关键因素,这有助于加深对该疾病病理生理学的理解和新型治疗策略的开发。"这项研究最终证明了我们从疫情一开始就指出的一点--严重的 COVID-19 是一种血栓性疾病。SARS-CoV-2病毒对血管内皮细胞(即血管的细胞层)有吸附作用。当它侵入内皮细胞时,首先会影响微血管循环。
"文章第一作者、圣保罗大学医学院(FM-USP)教授、肺病学家埃尔纳拉-内格里(Elnara Negri)说:"问题始于肺部的毛细血管(环绕肺泡的微小血管),然后是可到达任何其他器官的较大血管的凝血。"她是世界上最早得出严重COVID-19是一种血栓性疾病这一结论的研究人员之一。
南太平洋大学的研究人员分析了九名死于 COVID-19 的患者的肺组织。资料来源:Elia Caldini
在这项由 FAPESP 资助的研究中,研究人员使用透射和扫描电子显微镜观察了病毒对 COVID-19 重症患者肺内皮细胞的影响,这些患者死于 FM-USP 运营的综合医院--Clínicas 医院。
通过微创尸检获得的九份样本都显示出血栓性微血管病的高发病率--小动脉和毛细血管中的微小血凝块可导致器官损伤和缺血性组织损伤。这些样本来自2020年3月至5月期间住院的患者,他们需要插管和重症监护,并因难治性低氧血症和急性呼吸衰竭而死亡。
值得注意的是,这项研究中的所有患者都没有接受抗凝血剂治疗,因为这不是当时 COVID-19 治疗方案的一部分。在此期间,也没有任何 COVID-19 疫苗可用。
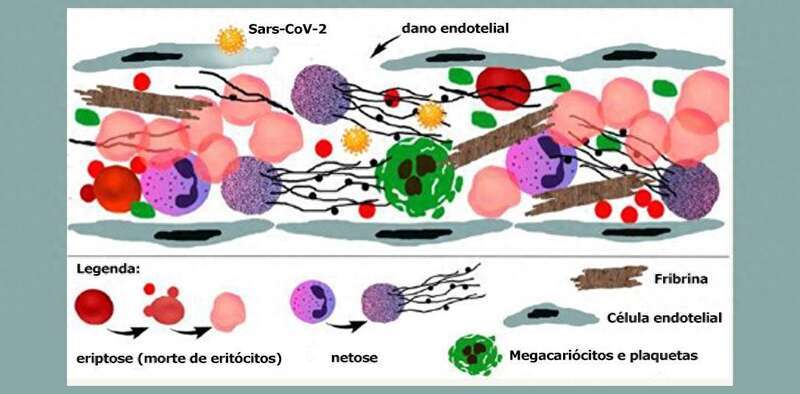
内皮糖萼脱落
内格里解释说,内皮本身有一层凝胶状的糖蛋白层,称为糖萼,它是调节大分子和血细胞进入内皮表面的屏障。这层屏障通过抑制血小板与内皮的相互作用来防止血管凝血。
圣保罗联邦大学的海伦娜-纳德以前进行的研究表明,SARS-CoV-2主要通过与受体ACE-2(呼吸系统上皮细胞和内皮细胞等各类细胞表面的一种蛋白质)结合侵入细胞,但在此之前,它会与硫酸肝素(一种多糖)结合,硫酸肝素是内皮细胞糖萼的一种主要成分。"当它侵入内皮细胞时,会引发糖萼的脱落和破坏,导致组织暴露和血管内凝血。这一过程始于微循环,"Negri 解释说。
研究人员在研究中发现,内皮损伤往往先于呼吸窘迫病例中的两个常见过程:肺泡-毛细血管膜渗漏和肺泡内纤维蛋白积聚(与血液凝固和伤口愈合有关)。
由 Thais Mauad 领导的同一研究小组在 FM-USP 进行的一项包括转录组学(分析所有RNA转录本,包括编码和非编码)在内的研究表明,在肺泡受损患者的肺部发生炎症之前,一些与凝血和血小板激活相关的通路已经被激活。
分析还证实,凝血并不是由凝血因子激活引发的典型过程。Negri说:"在COVID-19中,凝血是由于内皮损伤,并因NETosis[一种通过形成中性粒细胞胞外捕获物或NET而导致程序性细胞死亡的免疫机制]、红细胞畸形和血小板活化而加剧,所有这些都使血液变得更粘稠,并导致许多并发症。"
她补充说,当血液粘稠、血栓形成率高时,患者必须保持水分充足,而其他原因导致的急性呼吸窘迫综合征的弥漫性肺泡损伤则需要减少水分补充。此外,抗凝的时机和严格控制也是至关重要的。
玛丽莎-多尔尼科夫(Marisa Dolhnikoff)和埃利亚-卡尔迪尼(Elia Caldini)等同一组研究人员进行的另一项研究显示,重症 COVID-19 患者的肺损伤与 NETosis 的程度有关:尸检获得的肺组织中 NET 的水平越高,肺损伤越严重。
内格里说,在大流行病早期,她就开始怀疑 COVID-19 与血栓形成之间存在联系,当时她注意到了一个现象,回想起大约 30 年前,她在使用体外循环和气泡氧合器(因会造成内皮损伤而不再使用)进行开胸手术后,病人出现微血管凝血的经历。
"这是 30 年前广泛使用的一种技术,但它造成的肺损伤与 COVID-19 中看到的非常相似。所以我早就见过。除了肺损伤外,另一个相似之处是出现外周血栓现象,例如红脚趾,"她说。
当严重的 COVID-19 发病时,血氧水平的下降会继发于肺部毛细血管血栓形成。起初,肺部没有积液,没有'饱和',也没有失去顺应性或弹性。这意味着早期重症 COVID-19 患者的肺部不会像急性呼吸窘迫综合征 [ARDS] 患者那样像海绵一样充满液体。相反,与严重 COVID-19 相关的呼吸衰竭涉及肺脱水。肺泡充满空气,但由于毛细血管凝结,氧气无法进入血液。这就导致了我们所说的'快乐缺氧',患者不会感到呼吸急促,也不会意识到自己的血氧饱和度已经低到危险的程度。
在观察一名重症 COVID-19 患者的插管过程时,Negri 意识到对这类病例的治疗应该与大流行开始时完全不同。她说:"治疗重症 COVID-19 患者的秘诀是保持患者体内水分充足,并按正确的剂量使用抗凝剂,即在医院环境中氧饱和度开始下降(即血液中氧含量低)时所需的剂量。之后,必须每天根据血液检查结果计算抗凝剂的治疗剂量,而且必须始终在医院环境中进行,以避免任何出血风险。出院后平均四到六周内都需要进行预防,因为内皮再生需要这么长的时间"。
她解释说,之所以需要这种水合和抗凝方案,是因为与其他类型的 ARDS(肺部氧气主要因肺泡炎症而无法进入血液)不同,肺毛细血管内皮损伤是早期重症 COVID-19 的主要障碍。
"在大流行之初,没有人知道 COVID-19 和其他类型 ARDS 之间的这种区别。事实上,这就是许多意大利病人死在重症监护室的原因。"她回忆说:"当时使用的治疗方案是不同的。"
2020 年,在这项研究在《应用生理学杂志》上发表之前,Negri 和她的研究小组已经观察到,使用抗凝剂肝素可以改善危重病人的血氧饱和度。2021 年,他们与多个国家的同事合作开展了一项随机临床试验,成功证明肝素治疗可降低 COVID-19 重症患者的死亡率。研究结果发表在《英国医学杂志》上。
Negri说:"这项研究表明,当需要补充氧气但尚未接受重症监护的患者开始接受抗凝治疗时,COVID-19的死亡风险降低了78%,从而帮助全球改变了COVID-19治疗指南。"
她解释说,对于严重的COVID-19,应立即使用抗凝血剂逆转内皮功能障碍。她说:"必须尽快阻止血液凝固,以避免出现急性呼吸窘迫和疾病的其他后果,例如现在被称为Long-COVID的问题。"
英国研究机构的研究人员最近在《自然医学》(Nature Medicine)杂志上发表了一篇文章,报告了一项研究,其中发现的唯一Long-COVID 预后标志物是纤维蛋白原和 D-二聚体,它们都是与凝血有关的蛋白质,这进一步证实了该疾病的血栓性。
"这项研究表明,Long-COVID 是血栓治疗不当的结果。微循环问题会在多个器官中持续存在,包括大脑、心脏和肌肉,就像病人有小的心脏病发作一样,"Negri 说。
编译来源:ScitechDaily

