
不算标题698个字,言简意赅的程度令人佩服。而且看了一圈发出来的新闻,大家的信息源也就这一个公告。
可是这样一个新闻稿,对于一个批准上市的药物来说,缺失太多基本以及必要的信息了(另外,仅从上市公司的新闻公告来看,连forward looking statements,前瞻性陈述都没有,让chatGPT写也不能写成这样啊)。
首先,我们来说点现实的,紧急使用的人群和适用情况是什么?是成人,还是包括了青少年?是只用于增强针?还是基础免疫也批了?
这些信息都没有,是打算如何投入使用?
其次,还是很现实的问题,这个疫苗剂量是多少啊?打几针?在网上真没找到剂量的相关信息,公告里完全没说剂量。clinicaltrial.gov上搜了该疫苗的编号SYS6006,出来四项临床试验[2]:
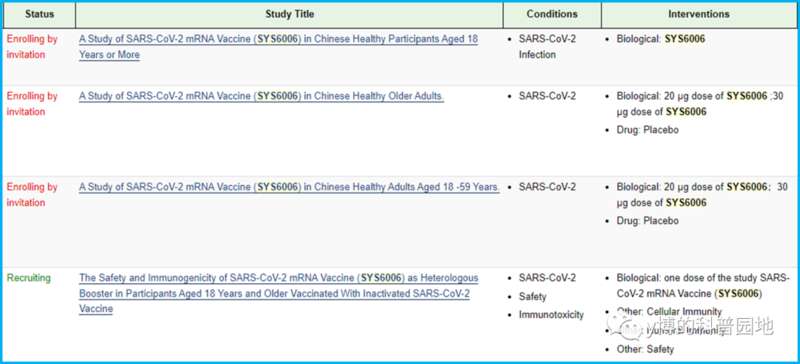
前三项都是早期确定剂量的临床试验,测两个剂量,20与30微克,第四项是研究序贯接种,即作为增强针来混打,也是最大规模的研究,预计招募1000人,和公告里说的4000人序贯接种试验也对不上。先不管这些,问题是这第四项研究没说用多少剂量,只说了在接种两针或三针灭活疫苗后打一针SYS6006。
在检测不同剂量的研究里,最后选了20还是30微克?还是又选了别的?基础免疫和增强针用的是不是同一个剂量?都上市的药物,连剂量都不说清楚,似乎过了吧?
另外,SYS6006这个疫苗,我在预印服务器medRxiv上搜不到任何论文:

而在Pubmed上只找到一篇论文,只是动物模型研究[3]。
也就是说,中国的第一个新冠mRNA疫苗获批了,可是我们既不知道哪个年龄段的人可以打,也不知道什么样的情况下可以打(基础免疫,增强针,与上一针间隔,与自然感染间隔?),甚至连剂量是多少都不知道。
时至今日,不指望国产疫苗的数据透明程度与发达国家使用的疫苗相近,可从灭活疫苗上市时的临床试验数据未公布,到现在连剂量也不公布,照此发展,下一个疫苗是不是连名字都不公布了?
再来看新闻稿对有效性、安全性的描述。
安全性:
“SYS6006的各种不良事件发生率较低且程度较轻,主要不良事件为发热、注射部位疼痛,且主要为1、2级。相比于成年组,老年组的不良事件发生率及严重程度大幅降低,在老年人群中具有更好的风险获益比。”
还是最基本的问题,这安全性是基于多少人的研究,不良事件的具体比例,较低是多低,1、2级的定义?老年组是多少人,成年组是多少人?说老年组不良事件少了,因此风险获益比更高。问题是不良事件少只是风险啊,风险获益比总要有风险和收益放在一起才能算的吧?收益呢?老年人不良事件少了,是不是免疫反应也弱了呢?
有效性先来看免疫反应部分:
“加强接种1剂SYS6006后,14天的针对Omicron BA.5中和抗体的几何平均滴度(GMT)为236,是加强接种前的83倍。在灭活疫苗2剂或3剂基础上接种1剂SYS6006的序贯加强免疫,SYS6006显示出对Omicron BA.5、BF.7、BQ.1.1、XBB.1.5、CH.1.1毒株有很好的交叉中和作用。临床研究结果表明,无论是基础免疫,还是序贯加强免疫,SYS6006都可以持续诱导针对野生株、Delta、Omicron BA.2和BA.5株的特异性T细胞免疫,并在较长时间内维持高水平,且针对不同毒株的细胞免疫强度大致相当。”
抗体滴度236是多少人里测出来的?年轻人?老年人?加强前的83倍,是什么基础上的加强,上一针多久以前?这个和国内其它的加强针比是什么水平?说白了,236这个数字到底什么意思?
后面吧啦吧啦一堆废话也是一样,很好的交叉中和,什么算很好?持续诱导T细胞免疫,是指什么T细胞?CD4,CD8?较长时间是多长时间?既然有较长时间的T细胞免疫数据,那较长时间的抗体数据呢?
再来看临床试验里的有效性:
“在疫情期间(2022年12月10日-2023年1月18日)开展的4000例序贯加强免疫临床研究(研究编号:SYS6006-008)中,以重组蛋白疫苗为对照,观察加强接种后7-28天,SYS6006的保护效力为70.2%(95% CI:53.6%-80.9%);观察加强接种后14-28天, SYS6006的保护效力为85.3%(95% CI:56.9%-95.0%)。”
以重组蛋白疫苗为对照,什么意思,是对照组接种了重组蛋白作为增强针,还是以前都接种过重组蛋白,对照是没打增强针?中国现在上市的重组蛋白都多得快叫不全名字了,这试验里是哪个重组蛋白?
保护效力是怎么算的?为什么只观察了28天?受试者年龄?上一针接种是多久?打的是什么?
这些应该都是最基本的信息吧?什么都没有,怎么判断这些“有效”的实际有效程度?
上市的药物,从获批人群到剂量到安全性有效性数据,如此语焉不详,未免离谱。
挺逗的是,SYS6006连自己的抗原都说得很模糊:“涵盖Omicron BA.5突变株核心突变位点的mRNA疫苗”。
核心突变位点是什么位点?这个算是BA.5的单价疫苗?根据能找到的唯一一篇SYS6006论文,里面说该疫苗是全长S蛋白的基因序列,加入Delta,BA.5与BF.7的多个关键突变(several key mutation)。这三个突变株S蛋白上的突变可不少:
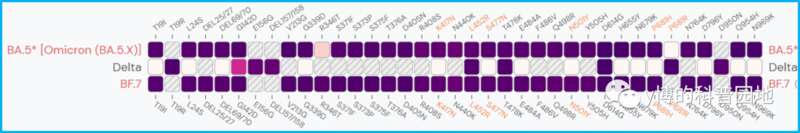
所以,到底算不算BA.5单价疫苗呢?
发表的动物模型数据上也有些和国外mRNA疫苗不太一样,或者说比较难理解的地方,比如SYS6006作为基础免疫,在小鼠中BA.2中和抗体低于原始株抗体[3]:
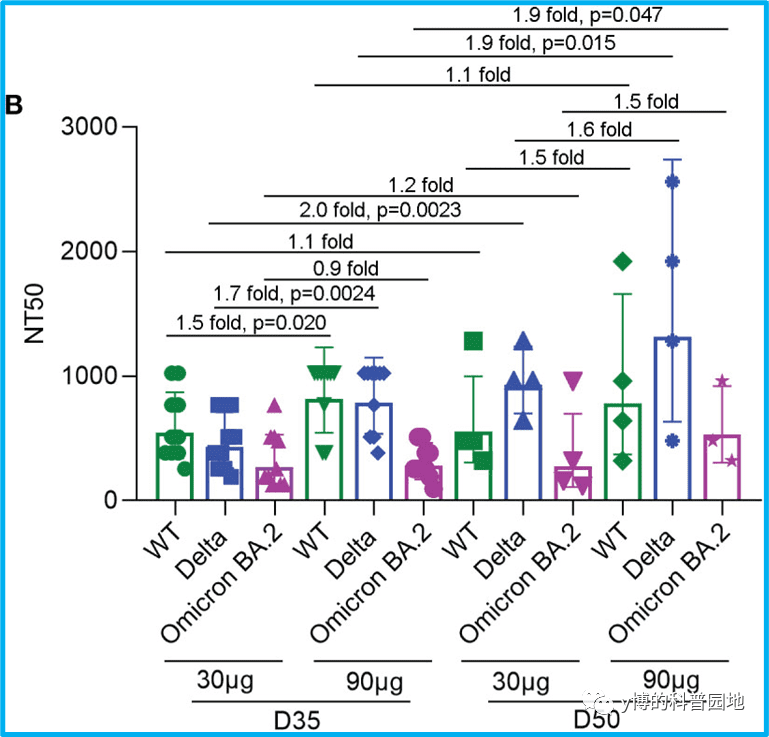
从描述来看这明明是一个奥密克戎单价疫苗,基础免疫又不会遇到抗原原罪,怎么还会奥密克戎滴度低于原始株呢?
参考Moderna在幼儿中的基础免疫(最初两针疫苗,非增强针)结果[4]:
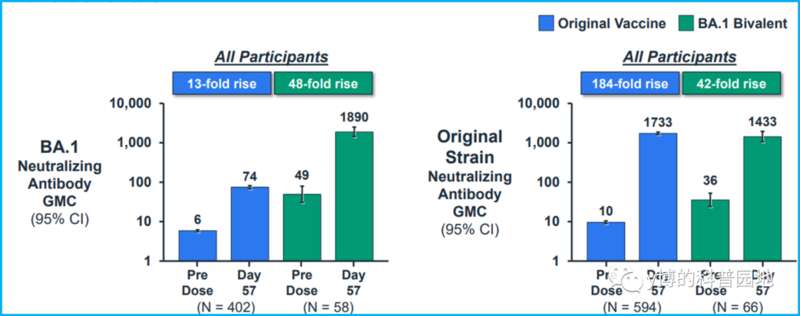
用BA.1的二价疫苗(绿色),BA.1的抗体滴度(左图)与原始株(右图)是类似的。
Moderna的结果更符合免疫学原理,当然,如果奥密克戎本身免疫原性低,形成针对性的抗体少,SYS6006的结果也说得通。可是为什么两个mRNA疫苗会有这样的差异,值得思考。不过,比起前述的从剂量到试验细节均吞吞吐吐,这些倒还真不是个事儿了。
另外,根据一些新闻报道与动物模型的论文,SYS6006是全长S基因,且用了碱基修饰。这些又让宣传的2-8度长期储存看上去颇为蹊跷。过去新冠mRNA疫苗的研发来看,采用非修饰的天然碱基,或者缩短mRNA长度(不用全长S基因),才能让做到在较高温度下存储。
所谓“超凡的主张,需要有超凡的证据”,只不过在国产新冠疫苗上,我们早已看到过各种没有证据的主张,所以SYS6006的存储条件也没什么。但作为个人,我挺好奇一件事,国产mRNA疫苗似乎非常喜欢强调非低温储存,这是医院诊所买不起冰箱,还是怎么回事?
再说个有意思的事情。SYS6006采用了S2P突变来稳定抗原,这应该是NIH的专利,也用于Moderna,辉瑞/BioNTech,Novavax,强生等新冠疫苗。如果碱基修饰是Moerna和辉瑞/BioNTech等采用的修饰方式,那应该用了Katalin Kariko在U Penn时的发明专利。
之前台湾的重组蛋白疫苗,也用了S2P,于是拼命强调自己是NIH技术,是Novavax的同门兄弟,多少有点攀亲戚的意味。到了SYS6006这里,就完全是“采用先进的自主知识产权和工艺技术”、“中国首个自主研发”了。
其实科研本来就是站在巨人的肩膀上。碱基修饰与S2P属于Moerna和辉瑞/BioNTech这两个新冠mRNA疫苗成功的重要因素。别人有好技术,积极采用是好事——当然过程中要尊重知识产权。既没必要可以攀亲戚,也没必要遮遮掩掩。
不过,作为上市药物,最不该遮遮掩掩的,还是适用人群、使用剂量、完整的有效性、安全性数据。至于为什么连前两者(适用人群、剂量)都能语焉不详,确实突破了我这凡夫俗子的想象力。

