本文来自微信公众号:NeuS (ID:neusmag),作者:老司橘,题图来自:《甄嬛传》
在全球老龄化趋势下,神经退行性疾病的诊疗在公共卫生议题中的地位中越发重要。据估计,到2050年,全球将大约有1.39亿人患痴呆症[1,2]。阿尔茨海默症(Alzheimer’s disease ,AD)是其中最普遍的一种,这种疾病剥夺了患者独立生活的能力,并给社会公共卫生带来极大的负担[3,4]。
2015年的一项研究[5]指出,我国AD患者的年人均医疗总费用约13万元,其导致的社会经济负担总额达到11472亿元,是癌症经济负担的5倍;预计到2030年,我国AD经济负担将达34710亿元,就全球来看,AD负担更将达到173580亿元。
就数量而言,AD患者规模也已不容小觑,据2020年中国全国人口普查,超过60岁人口患病占比18.7%[6],据另一项统计,中国也约有983万AD患者[7]。
![不同经济水平国家痴呆症患病人数的统计数据与估算数据。<sup>[1]</sup>](https://i.aiapi.me/h/2023/02/21/Feb_21_2023_07_43_45_7797046454212298.png)
AD是一种进行性神经退行性痴呆症,表现为记忆和空间视觉等重要认知功能受损。有证据表明AD患者的脑内病变可早于症状出现十多年[5]。美国国家老龄化与阿尔茨海默病协会于2011年更新了AD的临床诊断指南,将AD的疾病进程分为早期(此时已发生了脑内病变,但还未出现临床症状)、中期(轻度认知功能受损,尚且不影响个人独立生活)以及晚期(痴呆症状,认知功能严重受损)*[8]。
*作者注:此前的1984年版仅包括晚期阶段。
而目前临床上对AD的药物治疗多数仅能缓解症状,而不针对疾病病理,也不能延缓病程;少数针对AD病理的药物,如前不久由快速通道获FDA批准的Lecanemab以及此前同样由快速通道获批的药物Aducanumab,目前的证据仅支持它们对于AD早期患者有效[9,10]。
![2019年中国因阿尔茨海默症及相关痴呆症去世人数统计<sup>[7]</sup>](https://i.aiapi.me/h/2023/02/21/Feb_21_2023_07_44_02_7797063493993181.png)
综合AD的病程特点和药物治疗现状,AD早诊显得尤为重要——如果能实现在AD的早期诊断,当前可用的药物治疗就能发挥最大的效力,同时也会给相关的临床试验带来益处。由于AD早期并未表现出临床症状,因此检测脑内病变需要依赖于有效生物指标(biomarker,用以评估疾病风险的化学指标)的建立。
2018年的一篇论文提出了可以依赖AD的三个重要病理特征,来建立相关生物指标:Aβ沉积、病态的tau蛋白以及神经退行[11],其中前二者更容易建立AD特异性的生物指标。 目前对于早期AD患者,已经建立的可靠的临床诊断方法主要依赖正电子断层扫描(positron emission tomography,PET)技术以及提取脑脊液(cerebrospinal fluid,CSF)来检测Aβ和tau水平。
基于PET的检测价格昂贵,并且不易得;而基于CSF的检测需要进行腰椎穿刺,存在损伤性的缺点。因此,一些研究试图寻求基于血液检测的AD诊断方法。其中,血液中的很多化学物质能够反映身体各器官的功能状态,并且相比上述两种技术,血液检测价格更低,更加安全,也更容易实施。此外,对于AD患者来说,血脑屏障的损坏[12]更加会让脑功能损害体现在血液物质组成中。
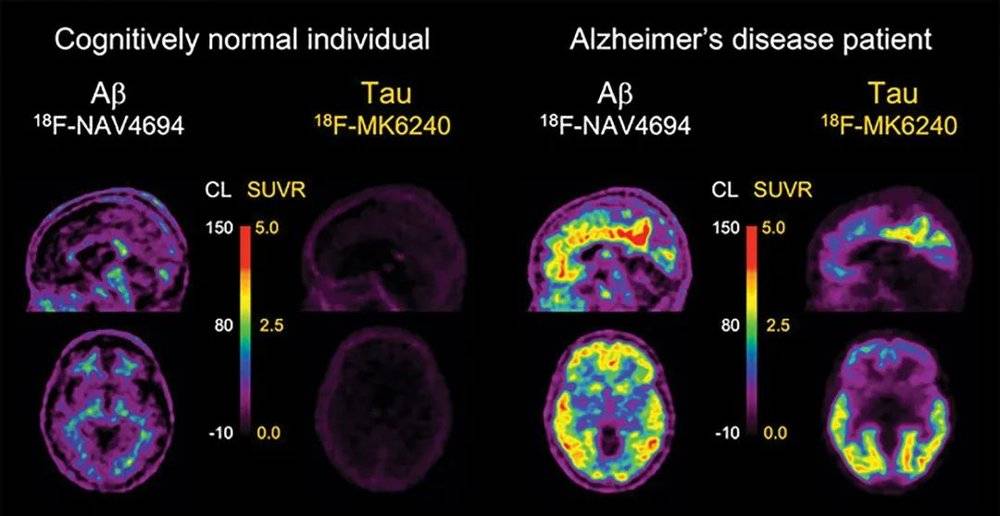
要建立基于血液检测的AD诊断方法,其中的关键就是找到血液中与AD相关的可靠生物指标。这种生物指标不仅要能检测出患者的健康异常,还需要能够将AD与其它的神经退行性疾病区分开来。另外,为了实现早诊的目的,这种生物指标需要具有较好的灵敏度,最好能在临床症状出现之前或病程初期就能预警风险。
近年来,研究者找到的适用于血液检测AD的生物指标,包括血浆中的Aβ42/Aβ40比例[14-16],p-tau181[17]、p-tau217[18,19]和p-tau231[20]等。 Aβ40和A Aβ42是两种最重要的Aβ蛋白异构体,其中Aβ42会聚集产生毒性,因此AD的病程伴随着CSF和血浆中Aβ42/Aβ40比值的降低(Aβ42在脑中沉积)。Aβ42/Aβ40指标在CSF检测中具有很好的鲁棒性,但血浆中的Aβ42/Aβ40在Aβ阳性和阴性组之间的差异相对较小,且要取得较好的检测结果需要依赖复杂的免疫沉淀质谱(IP-MS)方法[21]。
![血浆p-tau217区别AD于其它神经退行性疾病的表现<sup>[18]</sup><br>](https://i.aiapi.me/h/2023/02/21/Feb_21_2023_07_44_11_7797071905152493.png)
而针对tau蛋白的指标中,血浆中的tau总量在临床试验的不同组别中差异较小[22],但在不同位点磷酸化的tau(p-tau)表现良好[17-20],并且能同时检测Aβ和tau两种病理变化。这种方法基于免疫化学的检测手段,也更容易在大范围内应用[21]。
虽然基于p-tau的方法在Aβ沉积的检测时间上略晚于Aβ42/Aβ40指标,但也能在临床症状出现之前预警风险[19,21,23]。2020年的一篇研究[19]报告了p-tau217对于AD诊断的准确率(区别于其它神经退行性疾病)高于p-tau181,并且与基于PET和基于CSF的方法准确率没有显著差异。另外,新的研究也试图将基于Aβ和基于p-tau的检测方法结合起来,以取得更准确的诊断结果[24]。
![血浆p-tau217与其它检测方法的ROC曲线对比<sup>[20]</sup><br>](https://i.aiapi.me/h/2023/02/21/Feb_21_2023_07_44_15_7797076516876646.png)
一篇2022年的综述[23]指出(见下图),目前基于血液检测的AD诊断方法已基本进行到第三阶段(除了上述检测方法以外图中还列出了其它检测指标的发展,例如GFAP [基于Aβ病理引起的星状胶质细胞激活的指标] 和NfL [基于神经轴突损伤的指标] )。
目前基于血液检测的AD诊断尚未广泛应用到临床中,但这种技术在未来可能会有从实验室走进家门的趋势。日本的希森美康(Sysmex)公司宣布[25]其与卫材(Eisai)公司合作研发的AD血液检测盒子(基于血浆中的Aβ42/Aβ40比例)已于2022年12月19日在日本获得生产和销售批准,目前已经开始准备该产品的销售计划。
![血液检测反映AD病理的生物指标发展的五个阶段路线图<sup>[22]</sup><br>](https://i.aiapi.me/h/2023/02/21/Feb_21_2023_07_44_19_7797080148424269.png)
如果该AD血液检测盒子能有效完成使命,使得家庭早诊成为可能,那么这也许会给AD诊断带来新面貌。未来的研究有望继续提高当前建立的基于血液检测的AD诊断方法的准确度以及跨实验室稳定性;另一方面,对于AD病理的基础研究进展可能也会催生AD诊断的新机制。
参考资料
[1] World Health Organization. (2021). Global status report on the public health response to dementia.
[2] Gauthier, S., Webster, C., Servaes, S., Morais, J. A., & Rosa-Neto, P. (2022). World Alzheimer Report 2022: life after diagnosis: Navigating treatment, care and support.
[3] Scheltens, P., De Strooper, B., Kivipelto, M., Holstege, H., Chételat, G., Teunissen, C. E., ... & van der Flier, W. M. (2021). Alzheimer's disease. The Lancet, 397(10284), 1577-1590.
[4] Nandi, A., Counts, N., Chen, S., Seligman, B., Tortorice, D., Vigo, D., & Bloom, D. E. (2022). Global and regional projections of the economic burden of Alzheimer's disease and related dementias from 2019 to 2050: A value of statistical life approach. EClinicalMedicine, 51, 101580.
[5] Jianping Jia, Cuibai Wei, Shuoqi Chen, etc. The cost of Alzheimer’s disease in China and re-estimation of costs worldwide. Alzheimer’s & Dementia. 2018;14:483-491.
[6] Akimov, A. V., Gemueva, K. A., & Semenova, N. K. (2021). The Seventh Population Census in the PRC: Results and prospects of the country’s demographic development. Herald of the Russian Academy of Sciences, 91(6), 724-735.
[7] Ren, R., Qi, J., Lin, S., Liu, X., Yin, P., Wang, Z., ... & Wang, G. (2022). The China Alzheimer Report 2022. General Psychiatry, 35(1).
[8] McKhann, G. M., Knopman, D. S., Chertkow, H., Hyman, B. T., Jack Jr, C. R., Kawas, C. H., ... & Phelps, C. H. (2011). The diagnosis of dementia due to Alzheimer’s disease: Recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimer's & dementia, 7(3), 263-269.
[9] Budd Haeberlein, S., Aisen, P. S., Barkhof, F., Chalkias, S., Chen, T., Cohen, S., ... & Sandrock, A. (2022). Two randomized phase 3 studies of aducanumab in early Alzheimer’s disease. The Journal of Prevention of Alzheimer's Disease, 9(2), 197-210.
[10] van Dyck, C. H., Swanson, C. J., Aisen, P., Bateman, R. J., Chen, C., Gee, M., ... & Iwatsubo, T. (2023). Lecanemab in early Alzheimer’s disease. New England Journal of Medicine, 388(1), 9-21.
[11] Jack Jr, C. R., Bennett, D. A., Blennow, K., Carrillo, M. C., Dunn, B., Haeberlein, S. B., ... & Silverberg, N. (2018). NIA-AA research framework: toward a biological definition of Alzheimer's disease. Alzheimer's & Dementia, 14(4), 535-562.
[12] Palmqvist S, Janelidze S, Stomrud E, et al. Performance of fully automated plasma assays as screening tests for Alzheimer disease–related β-amyloid status[J]. JAMA neurology, 2019, 76(9): 1060-1069.
[13] Sweeney, M. D., Sagare, A. P., & Zlokovic, B. V. (2018). Blood–brain barrier breakdown in Alzheimer disease and other neurodegenerative disorders. Nature Reviews Neurology, 14(3), 133-150.
[14] Seppälä, T. T., Herukka, S. K., Hänninen, T., Tervo, S., Hallikainen, M., Soininen, H., & Pirttilä, T. (2010). Plasma Aβ42 and Aβ40 as markers of cognitive change in follow-up: a prospective, longitudinal, population-based cohort study. Journal of Neurology, Neurosurgery & Psychiatry, 81(10), 1123-1127.
[15] Janelidze S, Teunissen CE, Zetterberg H, et al. Head-to-head comparison of 8 plasma amyloid-beta 42/40 assays in Alzheimer disease. JAMA Neurol. 2021;78(11):1375-1382.
[16] Schindler SE, Bollinger JG, Ovod V, et al. High-precision plasma beta-amyloid 42/40 predicts current and future brain amyloidosis. Neurology. 2019;93(17):e1647-e1659
[17]Janelidze, S., Mattsson, N., Palmqvist, S., Smith, R., Beach, T. G., Serrano, G. E., ... & Hansson, O. (2020). Plasma P-tau181 in Alzheimer’s disease: relationship to other biomarkers, differential diagnosis, neuropathology and longitudinal progression to Alzheimer’s dementia. Nature medicine, 26(3), 379-386.
[18] Janelidze, S., Stomrud, E., Smith, R., Palmqvist, S., Mattsson, N., Airey, D. C., ... & Hansson, O. (2020). Cerebrospinal fluid p-tau217 performs better than p-tau181 as a biomarker of Alzheimer’s disease. Nature communications, 11(1), 1683.
[19] Palmqvist S, Janelidze S, Quiroz Y T, et al. Discriminative accuracy of plasma phospho-tau217 for Alzheimer disease vs other neurodegenerative disorders[J]. Jama, 2020, 324(8): 772-781.
[20] Ashton, N. J., Pascoal, T. A., Karikari, T. K., Benedet, A. L., Lantero-Rodriguez, J., Brinkmalm, G., ... & Blennow, K. (2021). Plasma p-tau231: a new biomarker for incipient Alzheimer’s disease pathology. Acta neuropathologica, 141, 709-724.
[21] Zetterberg, H., & Schott, J. M. (2022). Blood biomarkers for Alzheimer's disease and related disorders. Acta Neurologica Scandinavica, 146(1), 51-55.
[22] Mattsson, N., Zetterberg, H., Janelidze, S., Insel, P. S., Andreasson, U., Stomrud, E., ... & Blennow, K. (2016). Plasma tau in Alzheimer disease. Neurology, 87(17), 1827-1835.
[23] Teunissen, C. E., Verberk, I. M., Thijssen, E. H., Vermunt, L., Hansson, O., Zetterberg, H., ... & Del Campo, M. (2022). Blood-based biomarkers for Alzheimer's disease: towards clinical implementation. The Lancet Neurology, 21(1), 66-77.
[24] Janelidze, S., Palmqvist, S., Leuzy, A., Stomrud, E., Verberk, I. M., Zetterberg, H., ... & Hansson, O. (2022). Detecting amyloid positivity in early Alzheimer's disease using combinations of plasma Aβ42/Aβ40 and p‐tau. Alzheimer's & Dementia, 18(2), 283-293.
[25]https://www.sysmex.co.jp/en/news/2022/221222.html
本文来自微信公众号:NeuS (ID:neusmag),作者:老司橘

